纳米二氧化钛对佳乐麝香所引起的沙蚕(Perinereis aibuhitensis)神经毒性的影响
2018-05-02张倩茹姜丽思牟文燕王建美李斯雯
张倩茹 ,姜丽思 ,牟文燕 ,王建美 ,李斯雯
(1.中国科学院沈阳应用生态研究所 污染生态与环境工程重点实验室,沈阳 110016;2.广东省环境污染控制与修复技术重点实验室,广州 510275;3.中国科学院大学,北京 100049)
随着化学分析技术的提高和人们环境意识的增强,环境中药品及个人护理品(Pharmaceuticals and Personal Care Products,PPCPs)已日渐引起广泛关注,而我国是PPCPs生产和使用大国。合成麝香作为天然麝香的廉价代替品,由于其具有易于制得、多种特殊气味和良好的提香、定香能力等优点,被广泛应用于日用化工行业,如作为香料添加到化妆品(香水、肥皂、洗发水和面霜)和洗涤剂(柔顺剂、沐浴露和香波)中。由于其持续不断地进入环境并能够在生物体内积累,其效应类似于持久性污染物。佳乐麝香(HHCB)是目前使用量最多的一种人工合成麝香,仅2000年欧洲年使用量就达1427 t[1]。由于麝香类物质的分子结构中含有疏水性官能团,很容易吸附在污水处理系统内的沉积污泥中,当这些污泥进入土壤或地表径流及地下水时,会造成生态环境的有机污染。直接或间接排放的污水、污泥回用或垃圾填埋是人工麝香进入环境的主要途径[2]。HHCB作为多环麝香的典型代表,在环境中的浓度日益升高,由于人工合成麝香在环境中稳定性好,对生态系统的稳态存在着潜在威胁,其生态毒理效应日渐受到关注。目前研究表明,多环麝香对水生生物具有亚急性毒性、弱雌激素与抗雌激素效应以及抑制多种药物的外向转运蛋白等毒性效应,同时在水体、大气和污泥等环境介质甚至人体脂肪和母乳中均已检测出HHCB[3]。多环麝香可通过影响机体对污染物的外排机制,抑制其活性,使有毒物质在体内蓄积进而损伤机体[4]。Luckenbach等[5]已证实多环麝香可以显著抑制加州贻贝(Mytilus californianus)细胞的外排型转运体活性。除此之外,大量研究表明,HHCB能明显抑制水生生物幼虫的生长发育[6]以及促进人体胚肾细胞的繁殖[7]。目前也有研究关注人工合成麝香及其复合污染对动、植物及微生物的毒性作用[8]。律泽等[9]研究表明,HHCB和Cd单一、复合污染对土壤细菌和真菌数量都有显著影响。王雯等[10]研究表明,在吐纳麝香(AHTN)和Cd联合暴露情况下,高剂量AHTN对赤子爱胜蚯蚓(Eisenia foetida)金属硫蛋白与谷光甘肽均产生了抑制作用[10]。由于多环麝香可能通过影响多重耐药外排型转运体(Multidrug/multi-xenobiotic resistance efflux transporters)的活性而使生物体对外源化合物的排斥力减弱,因此,即使在停止多环麝香暴露后,通常被机体排斥的毒物仍然会进入细胞内部,持续积累[5]。
纳米TiO2是应用十分广泛的纳米材料之一,工业上称作钛白粉[11]。由于纳米TiO2与常规物质相比有着尺寸小、比表面积大、表面活性高等特点,因此具有一系列不同于传统金属氧化物材料的特殊物理化学性质。纳米TiO2具有很强的吸收和散射紫外线能力,无刺激性,可用于化妆品等行业[12]。研究发现,纳米材料的多种水环境行为,使其特性等发生改变,进而影响纳米材料的水生生物毒性[13]。纳米TiO2能够阻碍鱼腥藻(Anabaena variabilis)细胞的固氮活性[14],其在日光照射情况下能破坏绿藻(Chlorophyta)、刚毛藻(Cladophora)、鞘藻(Oedogonium)等细胞结构,降低光合作用,导致藻类生长受到抑制[15-16]。此外,斑马鱼(Danio rerio)在长时间低剂量纳米TiO2的慢性暴露下,随暴露时间的延长和浓度的增加,受到的毒副作用日趋明显,肝体比上升[17]。随着纳米工程材料在世界范围内的广泛应用,其可以通过空气、水、土壤、废物处置、食物链等多种途径进入生态环境,对生态环境及安全将产生何种影响还了解得不全面。目前针对纳米TiO2对生物的毒性效应研究开展较多,但对于纳米TiO2与其他污染物组合或相互作用而产生的毒性效应还知之甚少。特别是作为环境修复材料用于处理一些新兴有机污染物过程中,可能带来的复合污染生态风险还鲜有报道,因此,有必要开展新兴有机和无机复合污染毒性效应研究。
乙酰胆碱酯酶(AChE)是生物体内一种重要酶类,其作用是水解乙酰胆碱。乙酰胆碱是生物化学传递所必需的,但是它在释放后必须迅速分解,否则该物质的积累反而会引起神经传递的阻断[18]。早在20世纪50年代末就有研究将鱼脑或无脊椎动物AChE的抑制程度作为污染评价指标[19]。研究表明,海洋无脊椎动物AChE是一种最为敏感且易获得的生物标记物[20]。AChE活性高低常作为有机磷农药和神经毒剂中毒的重要诊断指标[21],由于有机磷农药和氨基甲酸酯类农药对生物体内AChE的抑制十分显著,利用农药对AChE活性的抑制,可表征环境样品中有机磷农药的含量[22]。对血浆AChE活性的测定还有助于血管性痴呆病的鉴别诊断[23]。目前,国内外对AChE的研究较多,AChE已成为环境科学和生态毒理学常用的污染评价指标。
双齿围沙蚕(Perinereis aibuhitensis)属环节动物门多毛纲,广泛分布于我国河口和海湾生境,是一种栖息于水陆交错带的无脊椎动物[24-25]。沙蚕以沉积物中营养物质为主要食物,因其具有适应性强和耐污染等特点而受到海洋环境学家的广泛关注[25]。许多沙蚕种类对污染暴露极为敏感,在污染环境中会产生各种生理应激反应,甚至死亡[26]。沙蚕对重金属、石油烃等污染物有较强的敏感性[27],因此,经常作为海陆交错带生态监测的指示生物。
本研究为探讨新兴有机和无机复合污染对海陆交错带关键性物种沙蚕的生态毒理学效应,采用微宇宙试验方法,重点考察了双齿围沙蚕毒理学指标(致死率和AChE活性)与新兴污染物(HHCB和纳米TiO2)浓度间的关系,着重关注纳米TiO2对于由HHCB所引起的沙蚕神经毒性的影响,以期为新兴复合污染评价与预警提供数据及方法学依据。
1 材料与方法
1.1 实验材料
HHCB购于SIGMA-ALORICH公司,其分子式为C18H26O;纳米TiO2购于国药集团,分子式为TiO2,分子量为79.89,分子结构式为O=Ti=O,粒径小于25 nm,纯度为99.8%。AChE试剂盒购于南京建成生物工程研究所。供试动物双齿围沙蚕采自江苏省赣榆县沙蚕滩涂养殖场,为年龄、大小较为一致的成体沙蚕。
1.2 实验方法
1.2.1 供试生物采集及培养
采集的沙蚕置于有底泥的冰盒中运至实验室,用采自其生活区域的海水清洗。挑选健康完整、大小相近的10条置于29 cm×14 cm×20 cm的养殖反应器中,加入1000 mL盐度为3.2%的人造海水,在(15±1)℃恒温培养2 d后,将健康沙蚕转至含不同浓度污染物的人造海水中培养1周后,挑选健康的沙蚕个体分别进行毒性试验。容器中投入不同浓度的HHCB和纳米TiO2,利用超声使其分散均匀。每一容器中投入10只沙蚕,每个处理组3个平行,观察沙蚕受胁迫症状,并记录死亡数目。为了消除干扰因素,减少实验误差,实验过程中使用的玻璃容器均在实验前用稀硝酸浸泡[28]。期间利用曝气装置保证氧气恒定,不投喂饵料。人造海水成分见文献[29]。
1.2.2 微宇宙试验设计
根据预实验结果,设定污染物胁迫浓度。单一胁迫组:HHCB 浓度为 0、150、450、750、1500 mg·L-1;纳米 TiO2浓度为 0、5、10、40、80、160 mg·L-1。复合胁迫组:HHCB 浓度为 150 mg·L-1和 750 mg·L-1;纳米 TiO2浓度为 5 mg·L-1和 40 mg·L-1。以不加污染物组为对照,投放沙蚕前利用超声技术使化学品分散,分别取暴露 0、1、2、4、6 d 后沙蚕活体样品进行 AChE 活性测定。
1.2.3 AChE活性测定
AChE活性测定参照南京建成生物工程研究所提供的试剂盒方法操作。将待测沙蚕在冰冷的生理盐水中漂洗,除去血液,滤纸吸干,称重。用手术剪快速剪碎组织至匀浆管中,加入9倍体积预冷匀浆介质(0.01 mol·L-1Tris-HCl、0.0001mol·L-1EDTA-Na2、0.01 mol·L-1蔗糖、0.8%氯化钠、pH 7.4缓冲液),采用组织匀浆器(Tissue Tearor,Biospec,US)冰浴匀浆 5 min。将制备好的匀浆液用高速冷冻离心机以4℃、8000 r·min-1条件离心10 min,留取上清液。按照试剂盒步骤依次加入试剂,于紫外-可见分光光度计412 nm处测定吸光值。定义每毫克组织蛋白在37℃保温6 min,水解反应体系中1 μmol基质为1个活力单位(U),计算公式:

1.3 数据处理
数据以平均数±标准差(Mean±SD)表示,采用SPSS 23.0统计软件进行单因素方差分析(One-way ANOVA),最小显著差异法(LSD)在 α=0.05和 0.01水平进行差异显著性检验,P<0.05为差异显著,P<0.01为差异极显著。
2 结果与分析
2.1 HHCB和纳米TiO2单一及复合胁迫对沙蚕的毒性效应
沙蚕在受到HHCB和纳米TiO2单一及复合胁迫后,均出现明显的中毒症状,对照组沙蚕较为安静,静卧水底并表现钻沙行为。处理组沙蚕表现出活动行为异常,对人为干扰反应灵敏,置于胁迫环境暴露1~2 d后,普遍出现抱团现象,无钻沙行为,且腹部朝上;暴露4~6 d后,出现明显的卷曲现象,身体开始出现大量红肿充血、僵硬弯曲、生理排泄以及尾部溃烂,直至死亡等症状。这表明在本试验处理浓度下,外界化学品对沙蚕产生较强的毒性效应,沙蚕为缓解中毒症状需要耗费自身能量储备,并通过自溶身体肌肉组织等方式来补充解毒所需能量。相似的这种自溶现象也发生在暴露于石油烃污染条件下的沙蚕[30]以及暴露于污染条件下的蚯蚓[31-32]。这是环节动物门生物对于外界胁迫的一种特有的生理反应。
由图1可知,HHCB单一胁迫8 d,当其浓度达到150 mg·L-1时,沙蚕死亡率为35.56%,随着HHCB胁迫浓度的不断增加,沙蚕死亡率逐渐升高,当浓度达到750、1500 mg·L-1时,沙蚕死亡率分别为95.56%和100%。由图2可知,纳米TiO2单一胁迫8 d,当其浓度从 5 mg·L-1增加到 40 mg·L-1时,沙蚕死亡率由13.33%迅速增加到66.67%;当胁迫浓度继续增大时,曲线成“凸”型,死亡率增加趋于平缓,当胁迫浓度达到160 mg·L-1时,沙蚕的死亡率达到100%。通过拟合不同曲线方程发现,Logistic回归——这种经常应用于药理学和流行病学的回归分析能够很好地反映沙蚕死亡率与污染物浓度间的剂量-效应关系[30],其回归方程分别表示为:

图1 不同浓度HHCB对沙蚕的毒性效应(8 d)Figure 1 Toxic effects of different concentrations of HHCB to P.aibuhitensis under 8 d stressed exposure

图2 不同浓度纳米TiO2对沙蚕的毒性效应(8 d)Figure 2 Toxic effects of different concentrations of nano-TiO2to P.aibuhitensis under 8 d stressed exposure
Y1=100-95.56/[1+(X1/323.08)3]
Y2=100-96.67/[1+(X2/27.72)3]
式中:X1表示 HHCB 胁迫浓度,mg·L-1;X2表示纳米TiO2胁迫浓度,mg·L-1;Y1和 Y2分别表示 HHCB 和纳米TiO2胁迫8 d条件下沙蚕的死亡率。通过拟合方程计算得到沙蚕可以耐受HHCB的半致死浓度(LC50)为 313.21 mg·L-1;纳米 TiO2的 LC50为 27.09 mg·L-1。
根据上述半致死浓度各选择高低两个浓度进行复合胁迫试验,2 d后沙蚕的毒性效应结果如图3所示。纳米TiO2的添加导致低浓度HHCB(150 mg·L-1)处理组沙蚕的死亡率明显升高,从单一胁迫的20%增加至40%~80%;而纳米TiO2存在与否对于高浓度HHCB(750 mg·L-1)所导致的死亡率(100%)均影响不大。分析其原因,可能与纳米金属颗粒结构的特殊性有关,纳米TiO2的小尺寸效应使其能够迅速进入生物体各个组织器官并与体内大分子发生反应,抑制相关蛋白或酶的活性,进而加重HHCB对生物体细胞外排机制的影响[4-5],使得沙蚕体内大量蓄积污染物,对机体造成严重损伤,最终导致死亡。此外,纳米金属颗粒的表面及界面效应也可能使其与HHCB结合后发生一系列反应,导致团聚体化学特性改变,化学毒性大大增强,最终破坏生物体免疫系统,直至死亡。
2.2 HHCB单一胁迫对沙蚕体内AChE活性的影响
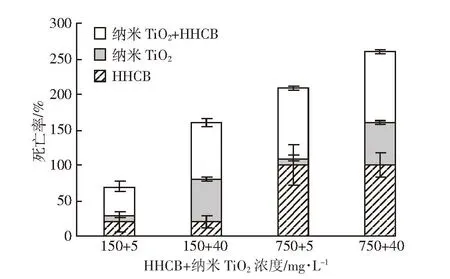
图3 HHCB和纳米TiO2复合胁迫对沙蚕的毒性效应(2 d)Figure 3 Joint toxic effects of HHCB and nano-TiO2to P.aibuhitensis under 2 d stressed exposure
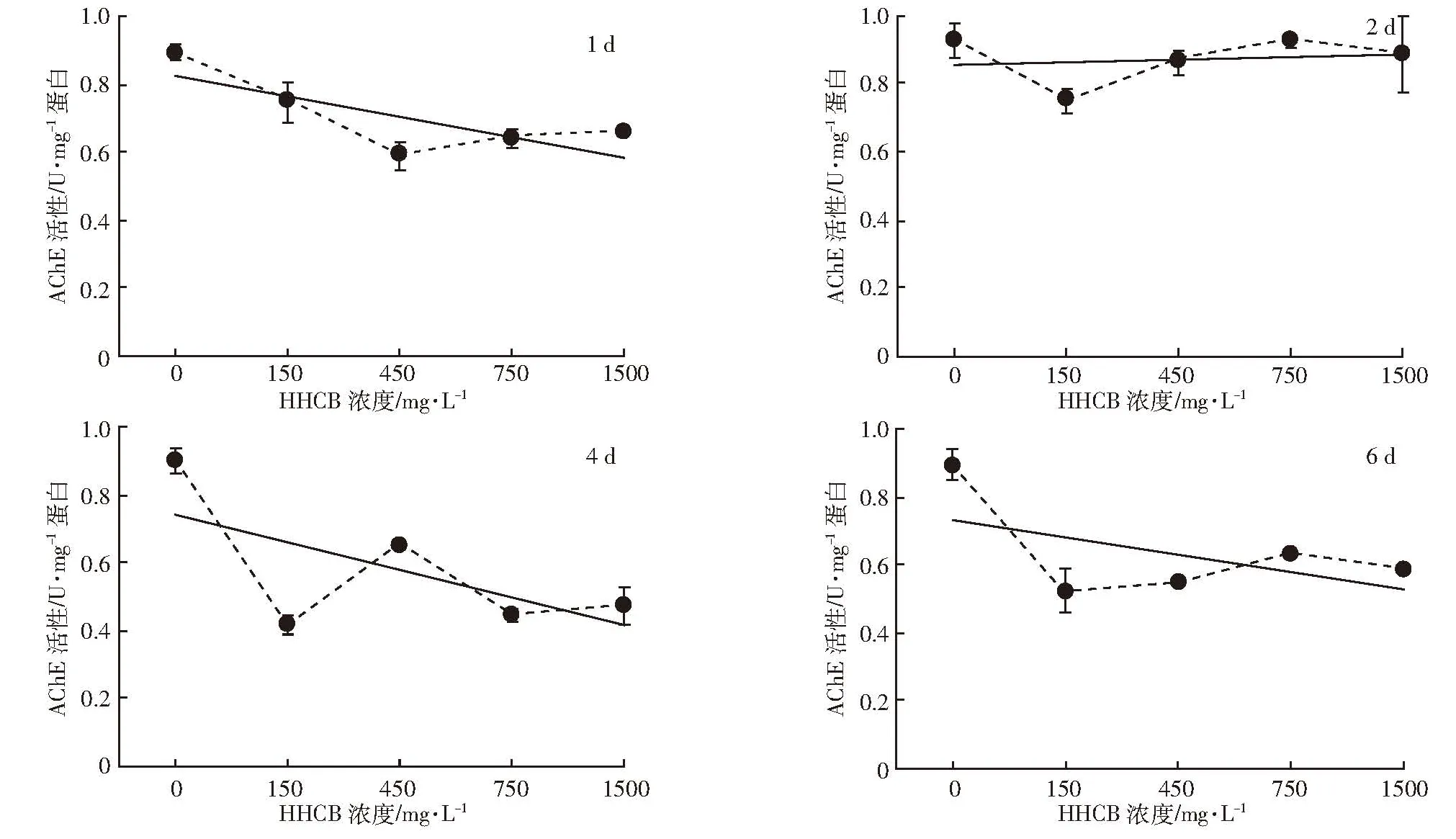
图4 不同暴露时间沙蚕体内AChE活性与HHCB暴露浓度的关系Figure 4 Relationships between AChE activity in P.aibuhitensis and the exposed concentrations of HHCB under different treatment time
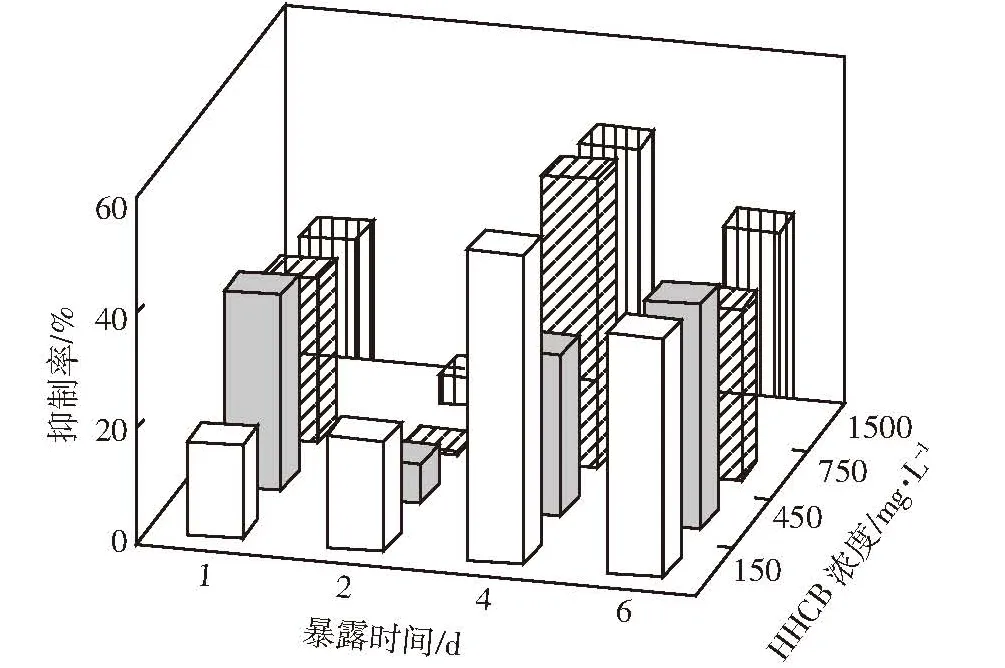
图5 不同暴露时间沙蚕体内AChE抑制率与HHCB暴露浓度的关系Figure 5 Relationships between inhibition rate of AChE in P.aibuhitensis and the exposed concentrations of HHCB under different treatment time
为探究HHCB对沙蚕所产生的神经毒性效应,考察了单一HHCB胁迫条件下沙蚕体内AChE活性及抑制率的变化。由图4可见,不同暴露时间下AChE活性基本随暴露浓度的增加而降低,即HHCB对沙蚕体内AChE的抑制率随之升高(图5)。与对照组相比,暴露1 d和2 d的抑制效应并不明显,抑制率仅在 16.08%~38.81%(1 d)和 0.64%~19.30%(2 d)范围内,HHCB的毒害抑制率均未超过50%;随着HHCB对沙蚕胁迫时间的延长,抑制率明显增高,特别是4 d时抑制率已达到了27.98%~53.62%,这表明沙蚕体内的AChE已被明显抑制。从整个胁迫周期来看,沙蚕体内AChE对于HHCB毒害作用的反应比较灵敏,其活性的高低与HHCB暴露浓度基本呈线性负相关。这与HHCB具有酮类的三环结构密不可分,这种结构能够导致该类化合物表现出天然麝香的气味[33],可对神经系统产生刺激作用,甚至毒害。有研究显示,HHCB能够影响大鼠小脑颗粒神经元(CGNs)细胞存活率,损伤细胞膜,引起氧化胁迫,诱导细胞凋亡,进而产生神经毒性效应,但它作用于神经递质并产生毒害效应的具体机制还有待于进一步探究[34]。
2.3 HHCB和纳米TiO2复合胁迫对沙蚕体内AChE活性的影响
HHCB和纳米TiO2复合胁迫暴露1、2 d对沙蚕体内AChE活性的影响如图6所示。在低浓度HHCB(150 mg·L-1)处理组中,纳米 TiO2的存在对沙蚕体内AChE活性的影响显著(P<0.05),且随纳米TiO2浓度的增加,沙蚕体内AChE活性呈升高趋势;与单一低浓度HHCB处理组相比,低浓度纳米TiO2(5 mg·L-1)的存在显著降低了AChE活性(P<0.05),高浓度纳米TiO2(40 mg·L-1)影响不显著(P>0.05)。在高浓度HHCB(750 mg·L-1)处理组中,1 d 时低浓度纳米 TiO2的存在显著促进了AChE活性(P<0.05),而高浓度纳米 TiO2影响不显著(P>0.05);2 d 时纳米 TiO2的存在显著降低了AChE的活性(P<0.05)。这表明胁迫初期纳米TiO2的存在对HHCB神经毒性产生的作用受胁迫浓度和作用时间影响;当进入胁迫稳定期纳米TiO2的存在可以钝化AChE对HHCB的敏感性,进而抑制了酶活性。这可能是由纳米TiO2自身的结构及化学特征所决定,HHCB与其复合后发生一系列反应,增强了对沙蚕的神经毒性效应,使其体内神经传递受到阻断,导致沙蚕机体生理生化过程失调和破坏,进而造成免疫系统紊乱,直至死亡。
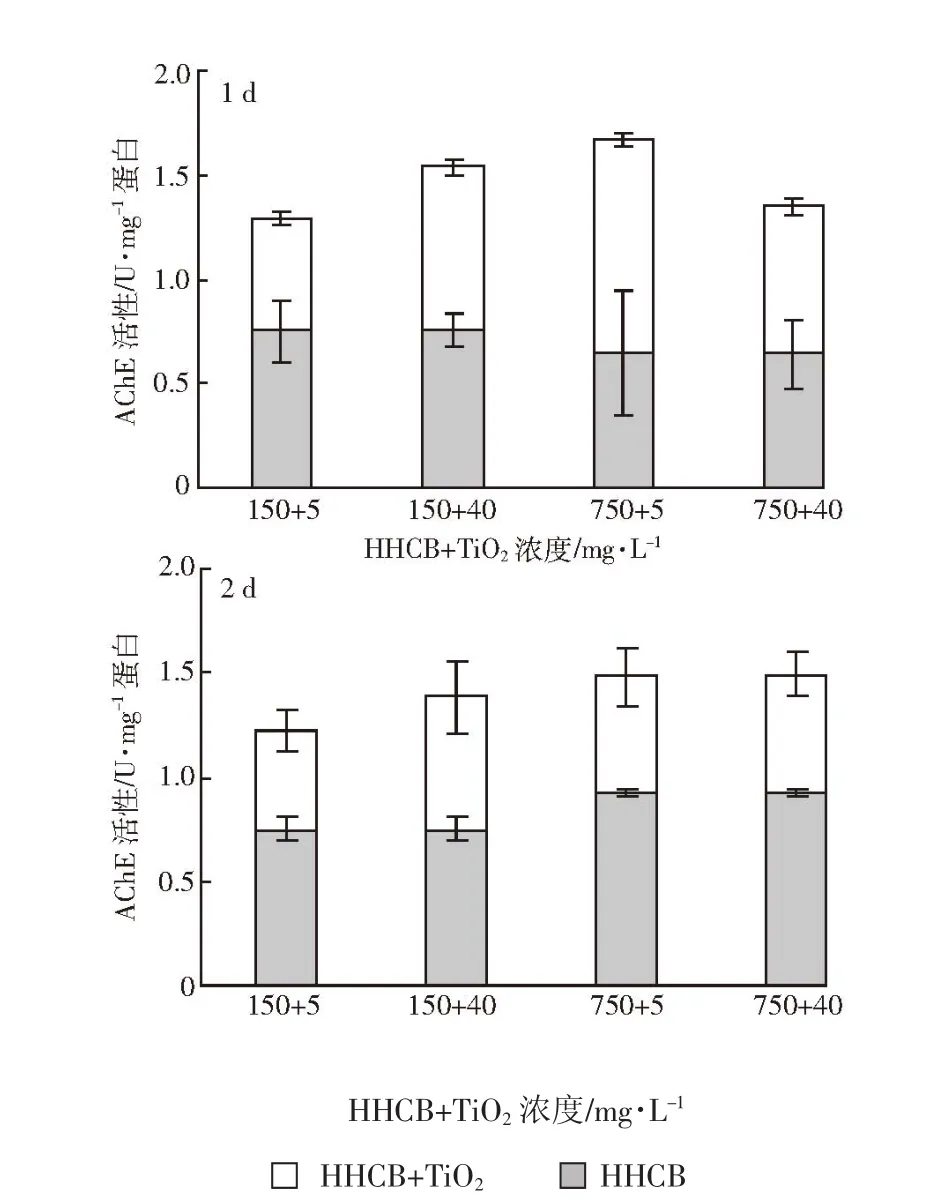
图6 不同暴露时间HHCB和纳米TiO2复合胁迫对沙蚕体内AChE活性的影响Figure 6 Effects of the joint stresses of HHCB and nano-TiO2on AChE activity in P.aibuhitensis under different treatment time
3 讨论
目前以沙蚕作为模式生物进行的一些生态毒性效应研究多集中在重金属污染胁迫下沙蚕的解毒机制及富集状况方面[35-36]。关于HHCB对海洋生物的毒性效应研究亦有报道,研究发现,HHCB对海洋桡足类动物的幼体发育有损伤和抑制作用[6,37]。此外,多环麝香会影响机体对污染物的外排机制,抑制外排转运体活性,导致污染物在体内积累,毒性增强,最终导致机体死亡[38]。本研究结果表明,沙蚕对HHCB和纳米TiO2具有较强的敏感性,随着污染物浓度的增加,沙蚕的死亡率呈上升趋势;HHCB的胁迫可显著抑制沙蚕体内AChE活性,是一种可作用于神经系统并产生神经毒性的化学物质。它通过引起乙酰胆碱酯在中枢胆碱能突触、神经肌肉接头等处的积累,表现出病状,造成生物体生理生化过程的失调与破坏,从而导致生物体死亡。本研究中,在HHCB胁迫下沙蚕体内AChE活性出现与对照组相当或升高的现象可能是由于HHCB激发了沙蚕体内AChE的从头合成,进而出现了酶活性升高的现象,这一结果与有机磷农药抑制AChE研究中酶活性的变化结论相一致[39]。Pérez等[20]研究表明,污染地区的过氧化氢酶(CAT)和谷胱甘肽转移酶(GST)活性增强,分别为对照组的7倍和2倍,而AChE活性受到抑制,仅为对照组的四分之一,由此证明该地区存在具有神经毒性和氧化应激诱导的化学污染物;AChE在两种供试生物中均表现出了相同的趋势,由此认为AChE是这些被测试指标中最为可靠且敏感的生物标志物。本实验研究结果也表明,随着HHCB浓度的升高和暴露时间的增加,沙蚕体内AChE的活性显著降低。这一结论与Pérez等的研究结果基本一致,可能是由于HHCB与AChE发生乙酰化作用,从而抑制AChE活性,乙酰胆碱无法被水解,在体内大量蓄积,诱发神经纤维长期处于兴奋状态,过度刺激神经冲动传导,导致中枢神经系统瘫痪[40]。因此,对HHCB而言,AChE是一种反应灵敏的生物标志物。
自然环境中,由于污染物来源的多样性和复杂性,通常情况下都是多种污染物共存形成复合污染。单个污染物在水体中的行为不可避免地受制于其他共存污染物。目前,针对重金属与有机物联合对生物的毒性作用研究相对较多。例如:张玄可等[41]研究表明Cd暴露对南方鲇的胆碱酯酶活性有较强的抑制作用。Zhang等[30]研究重金属与石油烃的复合污染对沙蚕AChE活性的影响表明,特定浓度的重金属可以缓解石油烃的神经毒性,这一结论与本研究结果稍有差异,这可能与化学品种类、其在生物体内的代谢途径和能否通过组织血液屏障的机制等有关[42]。此外,化学品间的浓度及组合关系,也是差异产生的另一个重要因素,这与联合效应广义理论基本一致。本研究结果表明,纳米TiO2的存在有可能增强沙蚕AChE对HHCB的敏感性,进而加剧了HHCB对沙蚕的神经毒害作用,其可能的原因是:①由于纳米TiO2的结构非常微小,可以轻松地通过细胞膜进入细胞内,同时改变细胞膜的渗透性,使得HHCB更易通过细胞膜进入细胞核内,进而导致明显的细胞毒性及炎症反应;②纳米TiO2和HHCB的配位结合能够抑制生物分子的活性,使得维持生物正常生理过程的功能受到破坏,从而导致毒性;③纳米TiO2的高化学活性又使其可以与细胞内众多细胞器以及一些生物大分子发生作用,同时对组织也有严重损伤作用[43],进而影响机体对HHCB的外排机制,抑制外排转运体活性,使得毒性较强的HHCB在沙蚕体内大量蓄积,对机体造成严重损伤,最终导致沙蚕快速死亡;④纳米TiO2是一种典型的纳米金属氧化物,推测纳米TiO2与HHCB结合时,其表面可能被HHCB分子所修饰,这些修饰后的颗粒在水中具有较好的分散性,从而防止其尺寸效应的损失,如果表面特性不能被有效控制,纳米颗粒可能迅速聚集成大的颗粒,更容易与生物分子和器官作用,从而对沙蚕产生更强的毒性效应;⑤纳米TiO2与HHCB复合污染情况下,两者通过抑制核酸的生物合成和破坏蛋白质合成机制以及破坏动物组织膜的完整性等活动诱导沙蚕衰老直至死亡。
4 结论
(1)沙蚕体内AChE对HHCB的敏感性较高,HHCB能显著抑制沙蚕体内AChE活性,对沙蚕的神经毒性作用较大。
(2)纳米TiO2的存在可加重HHCB对生物体的神经毒性,与化学品间的浓度及组合关系密切相关。
(3)AChE是佳乐麝香的靶标酶类,可以通过酶活性的变化情况来表征目标区域的污染状况,可作为该类化学品的潜在生物标志物。
(4)新型环境修复材料,如纳米TiO2在处理有机污染时需摸清使用量及组合方式,慎重考量其可能带来的复合污染毒性效应。
参考文献:
[1]Sommer C.The role of musk and musk compounds in the fragrance industry[M]//Rimkus G G.Synthetic musk fragrances in the environment.Berlin:Springer,2004:1-16.
[2]Zhou Q X,Wang M,Fan F,et al.Research progress in environmental pollution,ecological behavior and toxicological effects of synthetic musks[J].Acta Scientiae Circumstantiae,2008,28(1):1-11.
[3]Reiner J L,Wong C M,Arcaro K F,et al.Synthetic musk fragrances in human milk from the United States[J].Environmental Science&Technology,2007,41(11):3815-3820.
[4]Nakata H,Sasaki H,Takemura A,et al.Bioaccumulation,temporal trend,and geographical distribution of synthetic musks in the marine environment[J].Environmental Science&Technology,2007,41(7):2216-2222.
[5]Luckenbach T,Epel D.Nitromusk and polycyclic musk compounds as long-term inhibitors of cellular xenobiotic defense systems mediated by multidrug transporters[J].Environmental Health Perspectives,2005,113(1):17-24.
[6]Breitholtz M,Wollenberger L,Dinan L.Effects of four synthetic musks onthe life cycle of the harpacticoid copepod Nitocra spinipes[J].Aquatic Toxicology,2003,63(2):103-118.
[7]Seinen W,Lemmen J C,Pieters R H H,et al.AHTN and HHCB show weak estrogenic-but no uterotrophic activity[J].Toxicology Letters,1999,111(1/2):161-168.
[8]陈 春,周启星,刘潇威,等.多环麝香对蚯蚓的急性和亚急性毒性效应[J].生态毒理学报,2012,7(4):401-407.CHEN Chun,ZHOU Qi-xing,LIU Xiao-wei,et al.Acute and sub-acute toxicological effects of polycyclic musks on earth-worm,Eisenia fetida[J].Asian Journal of Ecotoxicology,2012,7(4):401-407.
[9]律 泽,胡筱敏,魏 炜,等.佳乐麝香和镉复合污染对土壤中细菌和真菌数量的影响[J].生态学杂志,2014,33(8):2161-2167.LÜ Ze,HU Xiao-min,WEI Wei,et al.Joint effects of galaxolide and cadmium on bacteria and fungi quantites in soil[J].Chinese Journal of Ecology,2014,33(8):2161-2167.
[10]王 雯,张 园,王秀娟,等.吐纳麝香与镉联合暴露对赤子爱胜蚓体内谷胱甘肽与金属硫蛋白的影响[J].生态毒理学报,2011,6(4):396-402.WANG Wen,ZHANG Yuan,WANG Xiu-juan,et al.Effect of joint exposure to polycyclic musk and cadmium on glutathione and metallothionein in Eisenia foetida[J].Asian Journal of Ecotoxicology,2011,6(4):396-402.
[11]Petosa A R,Jaisi D P,Quevedo I R,et al.Aggregation and deposition of engineered nanomaterials in aquatic environments:Role of physicochemical interactions[J].Environmental Science&Technology,2010,44(17):6532-6549.
[12]王江雪,李 炜,刘 颖,等.二氧化钛纳米材料的环境健康和生态毒理效应[J].生态毒理学报,2008,3(2):105-113.WANG Jiang-xue,LI Wei,LIU Ying,et al.Environmental health and ecotoxicological effect of titanium dioxide nanomaterials[J].Asian Journal of Ecotoxicology,2008,3(2):105-113.
[13]Nel A,Xia T,Mädler L,et al.Toxic potential of materials at the nanolevel[J].Science,2006,311(5761):622-627.
[14]Cherchi C,Gu A Z.Impact of titanium dioxide nanomaterials on nitrogen fixation rate and intracellular nitrogen storage in Anabaena variabilis[J].Environmental Science&Technology,2010,44(21):8302-8307.
[15]Peller J R,Whitman R L,Griffith S,et al.TiO2as a photocatalyst for control of the aquatic invasive alga,Cladophora,under natural and artificial light[J].Journal of Photochemistry and Photobiology A:Chemistry,2007,186(2):212-217.
[16]Linkous C A,Carter G J,Locuson D B,et al.Photocatalytic inhibition of algae growth using TiO2,WO3,and cocatalyst modifications[J].Environmental Science&Technology,2000,34(22):4754-4758.
[17]Chen J Y,Dong X,Xin Y Y,et al.Effects of titanium dioxide nanoparticles on growth and some histological parameters of zebrafish(Danio rerio)after a long-term exposure[J].Aquatic Toxicology,2011,101(3):493-499.
[18]卢 斌,柯才焕,王文雄.低浓度镉、锌暴露对白氏文昌鱼的毒性累积及其几种重要酶活性的影响[J].厦门大学学报(自然科学版),2012,51(4):767-773.LU Bin,KE Cai-huan,WANG Wen-xiong.Effect of sublethal Cd and Zn on selected enzymes and accumulation of amphioxus Branchiostoma belcheri[J].Journal of Xiamen University(Natural Science),2012,51(4):767-773.
[19]周启星,孔繁翔,朱 琳.生态毒理学[M].北京:科学出版社,2004.ZHOU Qi-xing,KONG Fan-xiang,ZHU Lin.Ecotoxicology[M].Beijing:Science Press,2004.
[20]Pérez E,Blasco J,Solé M.Biomarker responses to pollution in two invertebrate species:Scrobicularia plana and Nereis diversicolor from the Cádiz bay(SW Spain)[J].Marine Environmental Research,2004,58(2/3/4/5):275-279.
[21]李 昕,王忠斌,张 燕,等.乙酰胆碱酯酶在有机磷和氨基甲酸酯类农药快速检测中的应用[J].食品研究与开发,2007,28(3):127-129.LI Xin,WANG Zhong-bin,ZHANG Yan,et al.The rapid detection of organophosphorus and carbamate pesticides by acetylcholinesterase(AChE)from Musca domestica[J].Food Research and Development,2007,28(3):127-129.
[22]Lund S,Fulton P M H,Key B.The sensitivity of grass shrimp,Palaemonetes pugio,embryos to organophosphate pesticide induced acetylcholinesterase inhibition[J].Aquatic Toxicology,2000,48(2):127-134.
[23]许翠玲,王改萍,胡胜水.有机磷农药生物电化学传感器的研究进展[J].分析科学学报,2002,18(6):502-507.XU Cui-ling,WANG Gai-ping,HU Sheng-shui.The development of electrochemical biosensor of organophosphorus pesticides[J].Journal of Analytical Science,2002,18(6):502-507.
[24]吴宝铃,孙瑞平,杨德渐.中国近海沙蚕科研究[M].北京:海洋出版社,1981.WU Bao-ling,SUN Rui-ping,YANG De-jian.Chinese offshore Nereidae research[M].Beijing:Ocean Press,1981.
[25]Yuan X T,Chen A H,Zhou Y B,et al.The influence of cadmium on the antioxidant enzyme activities in polychaete Perinereis aibuhitensis Grube(Annelida:Polychaeta)[J].Chinese Journal of Oceanology and Limnology,2010,28(4):849-855.
[26]Zhou Q,Rainbow B,Smith P.Tolerance and accumulation of the trace metals zinc,copper and cadmium in three populations of the polychaete Nereis diversicolor[J].Journal of the Marine Biological Association of the UK,2003,83(1):65-72.
[27]Dallinger R,Rainbow P S.Ecotoxicology of metals in invertebrates[M].America:CRC Press,1993.
[28]Mouneyrac C,Mastain O,Amiard J C,et al.Trace-metal detoxification and tolerance of the estuarine worm Hediste diversicolor chronically exposed in their environment[J].Marine Biology,2003,143(4):731-744.
[29]张倩茹,牟文燕,张靖宜,等.石油烃对沙蚕镉生物富集特性及金属硫蛋白诱导的影响[J].应用生态学报,2014,25(9):2683-2694.ZHANG Qian-ru,MU Wen-yan,ZHANG Jing-yi,et al.Influences of petroleum hydrocarbons on accumulation of cadmium and induction of metallothionein in the polychaete Perinereis aibuhitensis[J].Chinese Journal of Applied Ecology,2014,25(9):2683-2694.
[30]Zhang Q R,Zhou Q X,Wang J,et al.Influences of Cu or Cd on the neurotoxicity induced by petroleum hydrocarbons in ragworm Perinereis aibuhitensis[J].Journal of Environmental Sciences,2008,20(3):364-371.
[31]Ramaswami V,Subbram V.Effect of selected textile dye on the survival,morphology,and burrowing behavior of the earthworm Polypheretima elongate[J].Bulletin of Environmental Contamination& Toxicology,1992,48(2):249-252.
[32]Rao J V,Kavitha P.Toxicity of azodrin on the morphology and acetylcholinesterase activity of earthworm Eisenia foetida[J].Environmental Research,2004,96(3):323-327.
[33]刘树文.多环麝香的分子结构和香气之间的关系[J].有机化学,1981(6):414-420.LIU Shu-wen.The relationship between molecular structure and odour of polycyclic musks[J].Chinese Journal of Organic Chemistry,1981(6):414-420.
[34]李卓娜,周群芳,刘稷燕,等.多环麝香(PCMs)的环境行为及毒性效应[J].化学进展,2012,24(4):606-615.LI Zhuo-na,ZHOU Qun-fang,LIU Ji-yan,et al.Environmental behavior and toxicological effects of polycyclic musks[J].Progress in Chemistry,2012,24(4):606-615.
[35]Mouneyrac C,Mastain O,Amiard J,et al.Trace-metal detoxification and tolerance of the estuarine worm Hediste diversicolor chronically exposed in their environment[J].Marine Biology,2003,143(4):731-744.
[36]van Hoof N A L M,Hassinen V H,Hakvoort H W J,et al.Enhanced copper tolerance in Silene vulgaris(Moench)Garcke populations from copper mines is associated with increased transcript levels of a 2b-type metallothionein gene[J].Plant Physiology,2001,126(4):1519-1526.
[37]Wollenberger L,Breitholtz M,KuskK O,et al.Inhibition of larval development of the marine copepod Acartia tonsa by four synthetic musk substances[J].Science of the Total Environment,2003,305(1):53-64.
[38]Luckenbach T,Epel D.Synthetic musk compounds:Luckenbach responds[J].Environmental health Perspectives,2005,113(12):A803-A804.
[39]Morgan M,Fancey J,Kiceniuk L.Response and recovery of brain acetylcholinesterase activity in Atlantic salmon(Salmo salar)exposed to fenitrothion[J].Canadian Journal of Fisheries and Aquatic Sciences,1990,47(9):1652-1654.
[40]马 铎,陈杖榴,曾振灵.恩诺沙星对土壤微生物群落功能多样性的影响[J].生态学报,2007,27(8):3400-3406.MA Duo,CHEN Zhang-liu,ZENG Zhen-ling.Effects of enrofloxacin on functional diversity of soil microbial communities[J].Acta Ecologica Sinica,2007,27(8):3400-3406.
[41]张玄可,梁 敏,程卫东,等.Cd暴露对南方鲇氧化应激及脑胆碱酯酶活性的影响[J].重庆师范大学学报(自然科学版),2015,32(1):42-45.ZHANG Xuan-ke,LIANG Min,CHENG Wei-dong,et al.Effects of cadmium exposure on oxidative stress and activity of acetylcholinesterase(AChE)in southern catfish(Silurus meridionalis Chen)[J].Journal of Chongqing Normal University(Natural Science),2015,32(1):42-45.
[42]王 艳,马泽民,吴石金.3种PAEs对蚯蚓的毒性作用和组织酶活性影响的研究[J].环境科学,2014,35(2):770-779.WANG Yan,MA Ze-min,WU Shi-jin.Study on the effect of enzymatic activity and acute toxicity of three PAEs on Eisenia foetida[J].Environmental Science,2014,35(2):770-779.
[43]Xie Y,Wang B B,Li F C,et al.Molecular mechanisms of reduced nerve toxicity by titanium dioxide nanoparticles in the phoxim-exposed brain of Bombyx mori[J].PLoS One,2014,9(6):e101062.
