磷镉交互作用对白骨壤幼苗体内镉的亚细胞分布和生理特性的影响
2018-05-02戴闽玥严重玲
王 岚,戴闽玥,严重玲*
(1.铜仁学院农林工程与规划学院,贵州 铜仁 554300;2.厦门大学环境与生态学院,福建 厦门 361102)
镉(Cd)是毒性很强、移动性大的重金属之一,广泛存在于土壤和水体中,容易在生物体内富集,对生物危害很大[1-2]。红树林是生长在热带、亚热带海岸潮间带的木本植物群落,在维持生态平衡和环境保护方面起着重要作用[3]。随着工业化的快速发展,大量污水排放,近海水域及红树林等面临着严重的重金属Cd污染问题[4]。有研究人员报道过红树林湿地沉积物中Cd 含量范围为 0.06~0.98 μg·g-1[5],Wu 等[6]研究表明漳江口红树林可利用磷为(28.41±1.07)mg·kg-1,可利用氮(97.85±4.67)mg·kg-1。磷(P)是植物生长发育不可缺少的大量元素之一,参与植物体内多种化合物的形成以及代谢调控,施加P肥能降低Cd的有效性[7],缓解Cd对植物的毒害作用[8]。
大量研究表明,细胞壁的固定和液泡区室化在植物应对重金属的毒性方面起着相当重要的作用[3,9]。Cd在植物体中主要积累在细胞壁和细胞可溶部分,说明细胞壁是植物对Cd解毒的首要屏障,Cd2+进入细胞后主要富集在液泡中,使得其他细胞器免受毒害[10-13]。植物在抗Cd的胁迫中,抗氧化酶的作用不容忽视。Cd导致活性氧(ROS)生成而对植物产生伤害,植物通过抗氧化酶类(如SOD、POD等)逐步形成保护机制来减轻或消除ROS对植物的伤害[14-15]。
白骨壤[Avicennia marina(Forsk.)Vierh]是主要的红树植物之一,也是红树林植物群落的主要树种之一,对重金属污染的耐受性较强。目前,有关重金属Cd对白骨壤的研究主要集中在Cd对白骨壤胁迫下幼苗的生理生态特性、钾钠镁吸收和分配、Si对Cd胁迫下白骨壤幼苗低分子质量有机酸代谢和Cd胁迫对白骨壤幼苗生理影响等方面[16-17],有关 P、Cd交互作用下白骨壤幼苗不同细胞器对重金属区域化固定和生理特性的研究尚未见报道。因此,本文选取白骨壤为材料,采用溶液培养,进行Cd和P交互试验处理,研究不同浓度P对Cd胁迫下白骨壤幼苗体内Cd亚细胞分布、抗氧化酶、叶绿素和蛋白质含量的影响,以说明P存在情况下Cd在白骨壤幼苗体内的分布及部分生理变化,从而缓解Cd的毒性,为红树林湿地环境安全与削减重金属污染提供基础数据。
1 材料与方法
1.1 试验材料及处理
白骨壤成熟胚轴采集于福建漳江口红树林国家级自然保护区(东经 117°24′,北纬 23°53′),沙培 120 d,培养期间统一管理。待白骨壤幼苗子叶完全枯黄掉落后,先后采用1/4、1/2、全Hoagland营养液依次进行培养直至第3对叶子成熟,调节营养液盐浓度为1%,pH控制在6.5左右(采用NaOH或HCl溶液调节)。选取长势一致、规格相同的白骨壤幼苗移栽至口径15 cm、底内径10 cm、深20 cm的塑料小桶中,用Hoagland营养液进行适应性培养7 d,然后进行不同浓度的Cd、P交互处理。试验设定9个处理,即Cd(0、0.5、5 mg·L-1),P(0、30、90 mg·L-1),每个处理重复 3盆,每盆3株,浓度搭配如表1。实验期间,每3 d更换含Cd和P的营养液,处理30 d后收苗。收苗时白骨壤幼苗根系用Mini-Q超纯水冲洗,用滤纸吸干植物体表面水分,根和叶分别用于不同亚细胞组分Cd含量、抗氧化酶活性和蛋白质含量以及对白骨壤叶片中叶绿素的测定。
表1 Cd、P交互处理Table 1 The treatments of Cd and P
1.2 试验方法
1.2.1 不同亚细胞组分的提取及测定
利用差速离心法提取不同亚细胞组分[18]。分别称取 0.50 g 根和叶鲜样,加入 10 mL 50 mmol·L-1Tris-HCl缓冲溶液(pH 7.4)、250 mmol·L-1蔗糖和 1.0 mmol·L-1二硫赤藓糖醇(DTE)的混合液,研磨成匀浆后转至离心管,500×g离心10 min,沉淀为细胞壁组分,上清液继续在10 000×g下离心10 min,沉淀为含叶绿体和细胞核组分,上清液继续在18 000×g下离心10 min,沉淀为线粒体组分,上清液为可溶性组分。全部操作在4℃下进行。所有组分用10 mL混酸(硝酸∶H2O2=2∶1,V∶V)145 ℃消化 4 h,超纯水定容至 40 mL,用0.22 μm滤膜过滤,电感耦合等离子质谱仪ICP-MS(PerkinElmer,UK)测定各亚细胞 Cd 含量。
1.2.2 抗氧化酶活性的测定
参照李合生等[19]的方法测定超氧化物岐化酶(SOD)(氮蓝四唑法)和过氧化物酶(POD)活性(愈创木酚法)。
1.2.3 叶绿素含量的测定
参照张雯[9]的方法测定叶绿素含量。去除白骨壤叶片主脉,称取0.10 g鲜样,将样品剪碎后置于带塞玻璃试管,加入 5 mL 丙酮和乙醇混合液(V∶V=1∶1),避光放置 24 h直至组织完全变白,3000 r·min-1离心10 min,分别在663 nm和645 nm处测定OD值,测定叶绿素a、b含量,并计算总叶绿素和叶绿素a/b。
1.2.4 蛋白质含量的测定
蛋白质含量的测定参照李合生等[19]的考马斯亮蓝G-250法。
1.3 数据分析
采用Excel 2013制作图表,SPSS 17.0软件进行方差分析,对同一Cd处理水平下不同P处理组进行单因素方差分析和LSD显著性检验,显著性水平为0.05。
2 结果与讨论
2.1 P、Cd交互处理对白骨壤幼苗体中Cd的亚细胞分布影响
刘芳等[20]研究了P和Cd交互作用对烟草生长及吸收积累P和Cd的影响,研究表明随着P肥用量增加,高Cd环境下烟草积累Cd量呈上升趋势,高Cd高P水平时植物增加了对Cd总量的吸收。从表2中可知,Cd 浓度从 0.5 mg·L-1增大到 5 mg·L-1时,白骨壤幼苗体内亚细胞Cd的含量均不同程度地增加,其中细胞壁和可溶性组分中Cd的含量增加较多,可能是由于细胞壁上的纤维素、半纤维素、蛋白质和多糖与Cd结合,从而限制了Cd的转移[21],研究结果与张雯等[9-10]一致。不同处理条件下,由于Cd是由根部直接进入白骨壤幼苗体内,所以根部Cd的含量明显多于叶的含量,与张雯、Qiu等[9,21]研究结果相同。本试验中,各处理中白骨壤幼苗根部Cd的含量明显多于叶的,可能是由于P的添加增加了HPO-4和H2PO-4等负离子,负离子与Cd2+结合,从而减少Cd2+从根迁移到地上部分,进一步减少Cd在叶中的含量[21-22],从而缓解了Cd对白骨壤的毒害。在相同Cd水平处理下,随着P浓度的升高,白骨壤叶和根的细胞壁中Cd含量呈上升趋势,可能是添加的P促进了根系发育,增加了根吸收Cd的含量。当Cd浓度为0.5 mg·L-1时,白骨壤叶和根中可溶性组分的Cd含量先降后升,叶中可溶性组分Cd的含量多于在细胞壁中的,施加适量浓度的 P(30 mg·L-1)能够促进 Cd 向液泡(可溶性组分)转移。在高浓度 Cd(5 mg·L-1)处理下,Cd 在可溶性组分中的含量变化不一,具体原因有待进一步研究。总体来说,随着P浓度的增加,叶和根中可溶性组分Cd的百分比升高,说明液泡也是植物细胞贮存重金属的重要场所[9]。所以,细胞壁是白骨壤对Cd解毒的首要屏障,Cd2+进入细胞后主要富集在液泡中使得其他细胞器免受毒害[3,10-13],减轻了 Cd 对白骨壤的毒害,进一步说明了细胞壁的固定及液泡区室化是白骨壤对Cd的解毒机制之一。
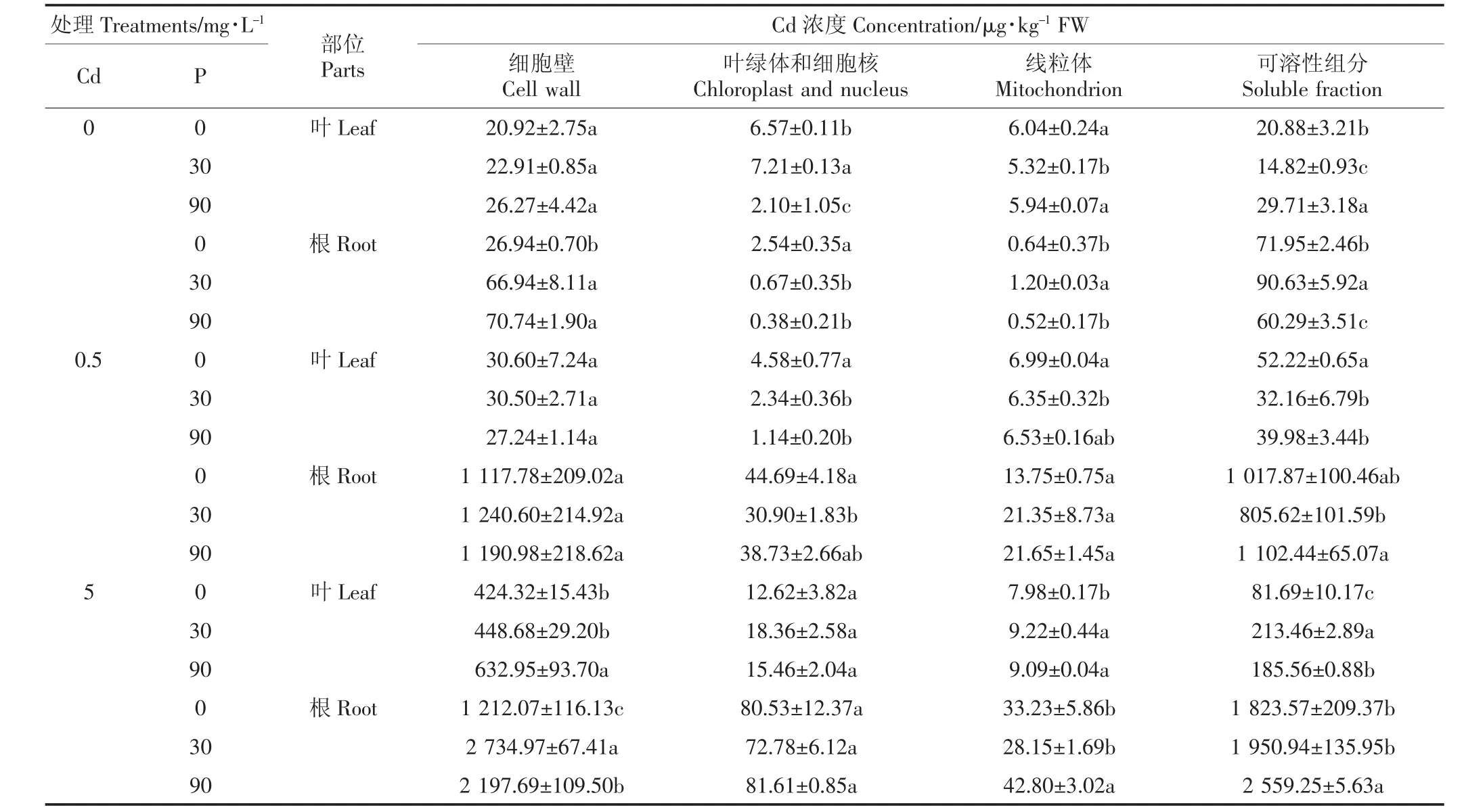
表2 P对不同Cd处理下白骨壤幼苗体内Cd亚细胞分布的影响Table 2 Subcellular distribution of Cd in A.marina seedlings under different P and Cd concentration
2.2 P、Cd交互处理对白骨壤幼苗体中抗氧化酶活性的影响
Cd胁迫能干扰许多植物的正常生长和代谢,产生ROS,使植物细胞受到伤害[23]。植物清除ROS有很多方式,其中抗氧化酶参与解毒过程是一个非常重要的方式[24]。SOD能将超氧阴离子歧化为H2O2和O2,POD利用H2O2来催化过氧化物的氧化和分解,这是植物应对逆境胁迫的响应机制之一[25]。
从图1可以看出,单Cd处理时,随着Cd浓度的增加,白骨壤叶片和根的SOD活性呈上升趋势,与Kavita等[26]研究结果一致。随着施Cd及P浓度的增加,各处理叶片和根的SOD活性均有一定的升高。添加90 mg·L-1的P后,白骨壤幼苗叶中的SOD活性增加,与对照相比差异显著,与Qiu等[27]研究结果一致,具体原因可能是施P促进了白骨壤的生长,为了应对Cd对植株的毒害,叶和根的SOD活性升高,有效清除了由Cd引起的氧化胁迫产生的活性氧。
由图1还可见,单Cd处理时,随着Cd浓度的增加,白骨壤叶片和根的POD活性变化趋势与SOD活性一致。施加相同P水平处理下,随着施Cd浓度的增加,各组叶片和根的POD活性有一定的升高,与对照相比,各处理间差异不显著。在高 P(90 mg·L-1)高Cd(5 mg·L-1)处理下,白骨壤叶和根的 POD 活性最高,可能原因是Cd胁迫下促进POD升高,P的添加进一步增加了POD的含量,提高了抗氧化能力,有效清除毒害产生的活性氧。因此,施加一定浓度的P可缓解Cd对白骨壤幼苗的胁迫和伤害。
2.3 P、Cd交互处理对白骨壤幼苗中叶绿素含量的影响
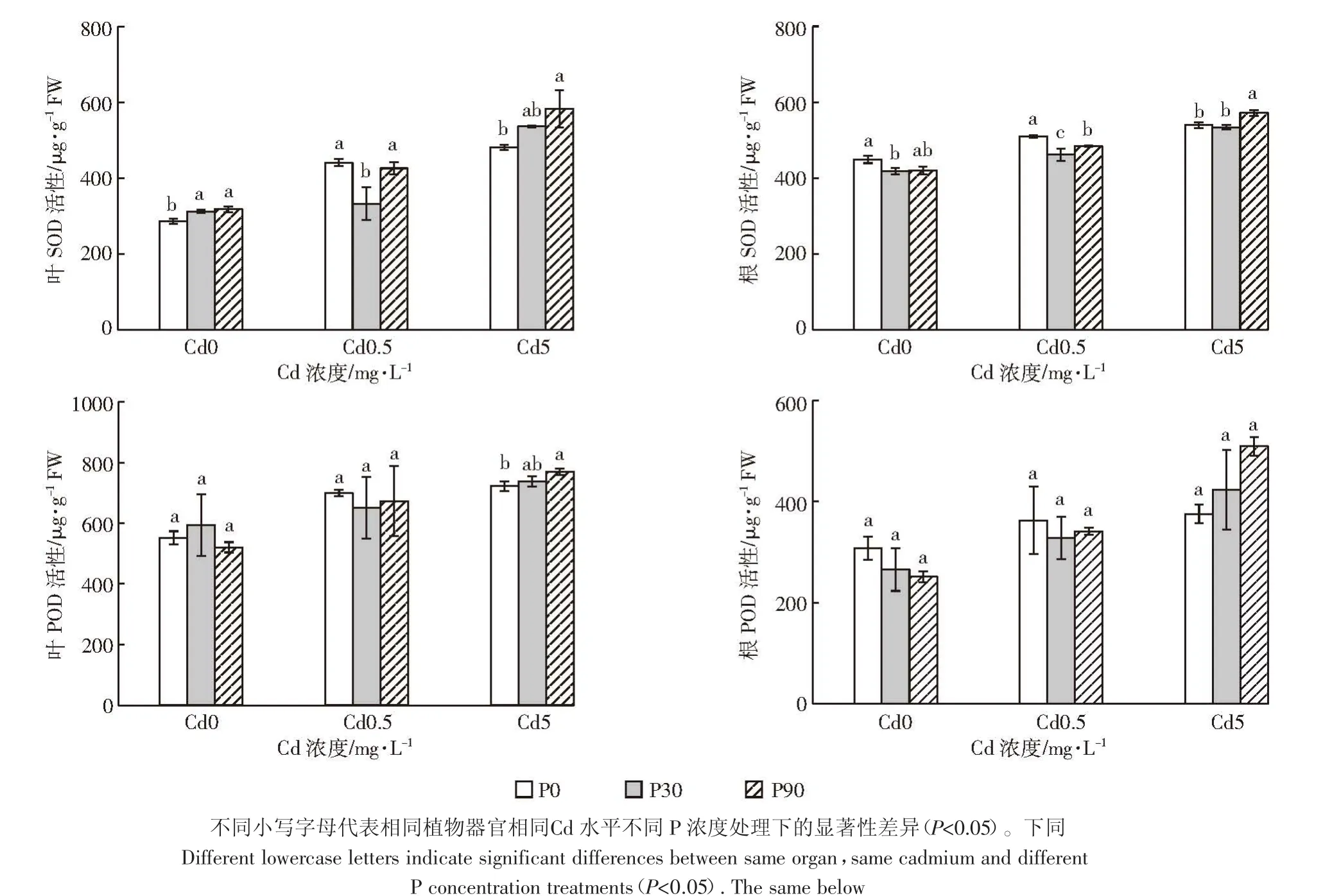
图1 P、Cd交互处理下白骨壤幼苗抗氧化酶活性Figure 1 Antioxidant enzyme activity of A.marina seedlings under P and Cd treatments
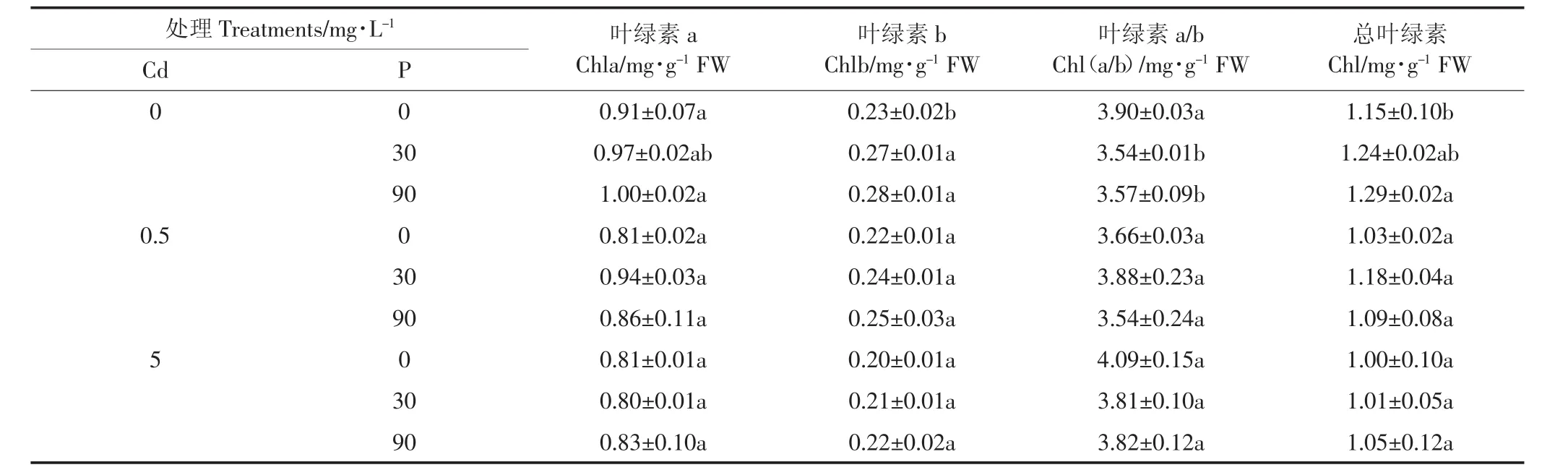
表3 P、Cd交互处理下白骨壤幼苗叶绿素含量及叶绿素a/b变化Table 3 Chlorophyll contents and chlorophyll a/b in A.marina seedlings under P and Cd treatments
从表3中可以看出,随着Cd浓度的增加,叶绿素含量总体呈下降趋势,Chla/b上下波动,变化不一。在无Cd处理下,白骨壤幼苗的总叶绿素含量随着P浓度的增大而增多,P 浓度为 90 mg·L-1时,Chla、Chlb和总叶绿素最大。在施加Cd的处理下,Chla、Chlb和总叶绿素的含量呈下降趋势,但各处理间差异不显著。实验结果说明Cd浓度增加,抑制或破坏了白骨壤幼苗叶绿素的合成,可能是由于Cd抑制叶绿素酸酯还原酶和影响氨基-γ-酮戊二酸的合成,直接破坏了叶绿体结构及功能[28]。当Cd浓度为0.5 mg·L-1和5 mg·L-1时,总叶绿素含量随着P浓度的增大而有所增多:一方面,P的添加可能在一定程度上降低了Cd的有效性[8],缓解了Cd对叶绿素的破坏,实验结果与刘芳等[29]研究一致;另一方面可能由于添加的P浓度增加,有效P也随之增加,叶绿素生物合成过程中δ-氨基-γ-酮戊酸(ALA)合成速率和卟胆原(PBG)酶活性升高,叶绿素生物合成增多[30],这也说明了P能够缓解Cd对白骨壤幼苗光合系统的破坏。
2.4 P、Cd交互处理对白骨壤幼苗蛋白质含量的影响
植物处于不良环境中,逆境蛋白增加,以增加渗透调节物质而增强植物细胞对逆境的抵抗力[19]。从图2中可知,当Cd浓度为0.5 mg·L-1时,随着P浓度增大,白骨壤幼苗叶片中的蛋白质含量呈下降趋势,各处理间差异不显著。在根中蛋白质含量先降后升,但各处理间差异也不显著。当Cd浓度为5 mg·L-1时,随着添加的P浓度上升,白骨壤叶片中的蛋白质含量也呈上升趋势,根中的蛋白质含量先降后升,各处理间差异显著。当P浓度为90 mg·L-1时,叶片和根中的蛋白质含量显著增加,分析原因可能是P为植物生长发育所需的大量营养元素,P的添加在一定程度上改善了植株的营养状况,从而促进了根系的发育和植株地上部的生长[31],提高了植物体内蛋白质的含量,进而减轻Cd对植株的毒害,增强白骨壤幼苗对Cd的耐受性。
3 结论
(1)细胞壁的固定及液泡区室化是白骨壤幼苗Cd污染解毒的重要机制之一。
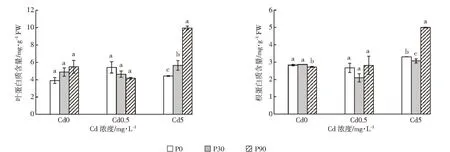
图2 P、Cd交互处理下白骨壤幼苗蛋白质含量Figure 2 Protein contents of A.marina seedlings under P and Cd treatments
(2)外源P能促使Cd向液泡转移,同时提升白骨壤植株SOD、POD活性,增加了叶绿素和蛋白质含量。
(3)外源P能够缓解Cd对红树植物白骨壤的影响,增强白骨壤对Cd的耐受能力。
参考文献:
[1]王晓娟,王文斌,杨 龙,等.重金属镉(Cd)在植物体内的转运途径及其调控机制[J].生态学报,2015,35(23):7921-7929.WANG Xiao-juan,WANG Wen-bin,YANG Long,et al.Transport pathways of cadmium(Cd)and its regulatory mechanisms in plant[J].E-cologica Sinica,2015,35(23):7921-7929.
[2]程 皓,陈桂珠,叶志鸿.红树林重金属污染生态学研究进展[J].生态学报,2009,29(7):3893-3900.CHENG Hao,CHEN Gui-zhu,YE Zhi-hong.Research progress of heavy metal pollution in mangrove wetlands[J].Acta Ecologica Sinica,2009,29(7):3893-3900.
[3]Weng B S,Xie X Y,Weiss D J,et al.Kandelia obovata(S.,L.) Yong tolerance mechanisms to cadmium:Subcellular distribution,chemical forms and thiol pools[J].Marine Pollution Bulletin,2012,64(11):2453-2460.
[4]黄志亮.Cd低积累蔬菜品种筛选及其Cd积累与生理生化特性研究[D].湖北:华中农业大学,2012.HUANG Zhi-liang.Screening of low Cd-accumulation vegetable cultivars and research on its properties of Cd-accumulation and physiology[D].Hubei:Huazhong Agricultural University,2012.
[5]李柳强.中国红树林湿地重金属污染研究[D].厦门:厦门大学,2008.LI Liu-qiang.Heavy metals in the mangrove wetland of China[D].Xiamen:Xiamen University,2008.
[6]Wu G R,Hong H L,Yan C L.Arsenic accumulation and translocation in mangrove(Aegiceras corniculatum L.)grown in arsenic contaminated soils[J].Public Health,2015,12(7):7244-7253.
[7]刘昭兵,纪雄辉,彭 华,等.磷肥对土壤中Cd的植物有效性影响及其机理[J].应用生态学报,2012,23(6):1585-1590.LIU Zhao-bing,JI Xiong-hui,PENG Hua,et al.Effects of phosphorous fertilizers on phytoavailability of cadmium in its contaminated soil and related mechanisms[J].Chinese Journal of Applied Ecology,2012,23(6):1585-1590.
[8]安志装,王校常,施卫明,等.重金属与营养元素交互作用的植物生理效应[J].土壤与环境,2002,11(4):392-396.AN Zhi-zhuang,WANG Xiao-chang,SHI Wei-ming,et al.Plant physiological responses to the interactions between heavy metal and nutrients[J].Soil and Environmental Sciences,2002,11(4):392-396.
[9]张 雯.硫硒交互对水稻幼苗Cd累积和毒害的影响机制研究[D].上海:华东理工大学,2014.ZHANG Wen.Influence mechanism of sulfur and selenium interaction on cadmium accumulation and toxicity in rice seedling[D].Shanghai:East China University of Science and Technology,2014.
[10]张 雯,林匡飞,周 健,等.不同硫浓度下叶面施硒对水稻幼苗镉的亚细胞分布及化学形态的影响[J].农业环境科学学报,2014,33(5):844-852.ZHANG Wen,LIN Kuang-fei,ZHOU Jian,et al.Effects of selenium foliar spray on subcellular distribution and chemical forms of cadmium in rice seedlings in different sulfur concentrations[J].Journal of Agro-Environment Science,2014,33(5):844-852.
[11]杜远鹏,李洪敬,尹克林,等.霞多丽苗木中镉的积累、亚细胞分布及化学存在形态[J].应用生态学报,2012,23(6):1607-1612.DU Yuan-peng,LI Hong-jing,YIN Ke-lin,et al.Cadmium accumulation,subcellular distribution,and chemical forms in Vitis vinifera cv.Chardonnay grapevine[J].Chinese Journal of Applied Ecology,2012,23(6):1607-1612.
[12]Wang X,Liu Y G,Zeng G M,et al.Subcellular distribution and chemical forms of cadmium in Bechmeria nivea(L.)Gaud[J].Environmental and Experimental Botany,2008,62(3):389-395.
[13]Fu X P,Dou C M,Chen Y X,et al.Subcellular distribution and chemical forms of cadmium in Phytolacca americana L.[J].Journal of Hazardous Materials,2011,186(1):103-107.
[14]Blokhina O,Virolainen E,Fagerstedt K V.Antioxidants,oxidative damage and oxygen deprivation stress:A review[J].Annals of Botany,2003,91(2):179-194.
[15]Shi G R,Cai Q S,Liu C F,et al.Silicon alleviates cadmium toxicity in peanut plants in relation to cadmium distribution and stimulation of antioxidative enzymes[J].Plant Growth Regul,2010,61(1):45-52.
[16]陈昌徐,陆志强,郑文教.白骨壤幼苗对镉胁迫的生长及生理生态响应[J].厦门大学学报(自然科学版),2015,5(4):485-492.CHEN Chang-xu,LU Zhi-qiang,ZHENG Wen-jiao.The growth and ecophysiological responses of mangrove Avicennia marina seedlings to cadmium[J].Journal of Xiamen University(Natural Science),2015,5(4):485-492.
[17]陆志强,陈昌徐,马 丽,等.镉胁迫对白骨壤幼苗钾钠镁吸收与分配的影响[J].应用生态学报,2015,26(5):1313-1319.LU Zhi-qiang,CHEN Chang-xu,MA Li,et al.Absorption and distribution of K,Na and Mg in Avicennia marina seedlings under cadmium stress[J].Chinese Journal of Applied Ecology,2015,26(5):1313-1319.
[18]Wu F B,Dong J,Qian Q Q,et al.Subcellular distribution and chemical form of Cd and Cd-Zn interaction in different barley genotypes[J].Chemosphere,2005,60(10):1437-1446.
[19]李合生,孙 群,赵世杰.植物生理生化试验原理和技术[M].北京:高等教育出版社,2000.LI He-sheng,SUN Qun,ZHAO Shi-jie.Principles and techniques of plant physiology and biochemistry[M].Beijing:Higher Education Press,2000.
[20]刘 芳,介晓磊,孙巍峰,等.磷、镉交互作用对烟草生长及吸收积累磷、镉的影响[J].土壤通报,2007,38(1):116-120.LIU Fang,JIE Xiao-lei,SUN Wei-feng,et al.Influence of P and Cd interaction on their accumulation in tobacco and tobacco growth[J].Chinese Journal of Soil Science,2007,38(1):116-120.
[21]Qiu Q,Wang Y T,Yang Z Y,et al.Effects of phosphorus supplied in soil on subcellular distribution and chemical forms of cadmium in two Chinese flowering cabbage(Brassica parachinensis L.)cultivars differ-ing in cadmium accumulation[J].Food and Chemical Toxicology,2011,49(9):2260-2267.
[22]Bolan N S,Adriano D C,Naidu R.Role of phosphorus in(im)mobilization and bioavailability of heavy metals in the soil-plant system[J].Environ Contam Toxicol,2003,177(2):1-44.
[23]杨卫东,陈益泰.镉胁迫对旱柳细胞膜透性和抗氧化酶活性的影响[J].西北植物学报,2008,28(11):2263-2269.YANG Wei-dong,CHEN Yi-tai.Membrane leakage and antioxidant enzyme activities in roots and leaves of Salix matsudana with cadmium stress[J].Acta Bot Boreal-Occident Sin,2008,28(11):2263-2269.
[24]Pereira G J G,Molina S M G,Lea P J,et al.Activity of antioxidant enzymes in response to cadmium in Crotalaria juncea[J].Plant and Soil,2002,239(1):123-132.
[25]Azevedo R A,Alas R M,Smith R J,et al.Response of antioxidant enzymes to transfer from elevated carbon dioxide to air and ozone fumigation,in the leaves and roots of wild-type and a catalase-deficient mutant of barley[J].Physiol Plant,1998,104(2):280-292.
[26]Kavita S,Ritambhara G K,Shalini V,et al.Effect of cadmium on lipid peroxidation,superoxide anion generation and activities of antioxidant enzymes in growing rice seedlings[J].Plant Science,2001,161(6):1135-1144.
[27]Qiu R L,Zhao X,Tang Y T,et al.Antioxidative response to Cd in a newly discovered cadmium hyper accumulator,Arabis paniculata F.[J].Chemosphere,2008,74(1):6-12.
[28]陶毅明,陈燕珍,梁士楚,等.镉胁迫下红树植物木榄幼苗的生理生化特性[J].生态学杂志,2008,27(5):762-766.TAO Yi-ming,CHEN Yan-zhen,LIANG Shi-chu,et al.Physiological and biochemical properties of Bruguiera gymnorrhiza seedlings under cadmium stress[J].Chinese Journal of Ecology,2008,27(5):762-766.
[29]刘 芳,介晓磊,刘世亮,等.褐土中磷镉交互作用对磷镉有效性影响[J].生态环境,2007,16(5):1429-1432.LIU Fang,JIE Xiao-lei,LIU Shi-liang,et al.Effect of P and Cd interaction on bioavailability of P and Cd in cinnamon soil[J].Ecology and Environment,2007,16(5):1429-1432.
[30]吴 楚,王政权,孙海龙,等.氮磷供给对长白落叶松叶绿素合成、叶绿素荧光和光合速率的影响[J].林业科学,2005,41(4):31-36.WU Chu,WANG Zheng-quan,SUN Hai-long,et al.Effects of different concentrations of nitrogen and phosphorus on chlorophyll biosynthesis,chlorophyll a fluorescence,and photosynthetic rate in Larix olgensis seedlings[J].Scientia Silvae Sinicae,2005,41(4):31-36.
[31]刘世亮,刘忠珍,介晓磊.施磷肥对Cd污染土壤中油麦菜生长及吸收重金属的影响[J].河南农业大学学报,2005,39(1):30-34.LIU Shi-liang,LIU Zhong-zhen,JIE Xiao-lei.Influence of phosphate fertilizer application on lettuce plant growth and absorbing of heavy metals in Cd polluted soil[J].Journal of Henan Agricultural University,2005,39(1):30-34.
