miR-532-5p在胃癌中的表达及其对MKN45细胞增殖迁移能力的影响
2018-05-02陈新华李风萍陈昭宇郭伟洪南方医科大学南方医院广东广州510515
陈新华,李风萍,陈昭宇,郭伟洪 (南方医科大学南方医院,广东广州510515)
0 引言
胃癌(gastric cancer,GC)的发病率和死亡率均位居全球前列,严重危害人类健康[1-2],尤其在我国,GC以局部进展期胃癌(advanced gastric cancer,AGC)为主(80%~90%)[3],肿瘤迁移和侵袭能力强、预后差的特点非常显著[4]。近年来,分子生物学技术的进步给肿瘤的诊断和治疗提供了新思路。因此,分析和探索GC的分子生物学特性,并转化为治疗的新靶点和新方法,仍然具有非常高的临床需求和很突出的时代需求。近年来,越来越多的研究[5-6]提示microRNAs(miRNA)是调节 GC发生发展的重要机制,有望成为潜在的治疗新靶点。
miRNAs是一类单链内源性的非编码微小RNA,能对细胞凋亡、增殖及分化、神经系统发育、免疫调节等众多生命过程起到重要调控作用[7-8]。近期大量研究[9-11]表明,miRNAs的突变或异常表达与人体各种肿瘤的发生发展相关,可以促进肿瘤的进展,也可以发挥抑癌作用。miR-532-5p位于人类染色体的Xp11.23上,具有3'非翻译区的互补序列,可以通过抑制转录下调多种基因产物。miR-532-5p首先被发现在皮肤黑色素瘤中具有促癌作用[12],但相继也有研究[13-15]发现其在多种实体肿瘤,如卵巢癌、肺癌以及肝癌中表达下调,而细胞功能试验也提示其有抑制肿瘤细胞增殖的作用。Xu等[16]首次报道了 miR-532-5p对人类GC细胞的调节作用和机制,体外试验中过表达miR-532-5p可以显著增加GC细胞集落形成和迁移的潜力,减少G1期细胞的比例,阻滞细胞周期,并且促进细胞凋亡,然而,在临床胃癌组织的检测中并未得到一致的结果。该研究未对此作进一步的延伸探索,但也提示我们,miR-532-5p与胃癌的发生发展可能存在一定关系。因此,结合目前临床上胃癌的诊治亟需开发潜在新靶点的时代需求,进一步深入明确和阐述miR-532-5p在GC发生发展过程的调节作用具有较大的科学意义,甚至可能为GC未来的诊治提供更好的选择。
模板按照逆转录试剂盒说明书进行逆转录反应,所得cDNA应用 SYBR Green I法进行荧光定量 PCR反应。试验设置3个重复,以U6作为内参,按照说明书推荐的程序进行扩增反应。计算得到的miR-532-5p的相对表达量数值以中位数为截断值,将miR-532-5p的表达水平分为低表达和高表达两组,并分析其表达高低与临床病理参数的关系。
1.2.2 细胞培养和转染 胃癌MKN45细胞株常规培养使用含 10%胎牛血清的 1640培养基,置于37℃、含5%CO2培养箱中培养。当细胞处于对数生长期时接种于6孔板,接种密度控制为4×105个/孔左右,24 h后按照转染试剂说明书利用 Lipofectamine3000转染 miR-532-5p-NC,miR-532-5p-mimics和miR-532-5p-inhibitor,根据不同实验时间要求后收集细胞进行后续实验。实验分为3组,阴性对照组(negative control, NC)、过表达组(mimics)以及干扰组(inhibitor)(表 1)。

表 1 miR-532-5p NC、mimics及 inhibitor序列
1 材料和方法
1.1 主要材料 组织标本:60例新鲜冰冻癌组织和配对癌旁组织标本选取自2016~2017年在南方医科大学附属南方医院普通外科行手术治疗的胃癌患者,所有患者术后均经病理学检查确诊,在术前没有接受放化疗等抗肿瘤治疗。试验所取癌组织为距离病灶边缘1 cm以内组织,癌旁组织为距离癌灶3 cm以外的粘膜组织。所有组织标本的采集均获得患者知情同意,并且由南方医院伦理委员会批准。
试剂:MKN45胃癌细胞购自中科院上海细胞库;RNA提取试剂盒、逆转录试剂盒和荧光定量PCR试剂盒购自Takara;引物由上海生工公司设计合成;D1640培养基、胎牛血清、胰蛋白酶购自HyClone;Lipofectamine 3000转染试剂购自Invitrogen;Mir-532-5p干扰序列inhibitor及过表达序列mimics由江苏吉玛公司设计合成;CCK8细胞增殖检测试剂盒购自上海碧云天公司;Matrigel基质胶、Transwell培养板购自Corning公司。
1.2 方法
1.2.1 荧光定量 PCR检测miR-532-5p的表达 按照RNAiso(TAKARA,日本)试剂说明书提取癌组织及其配对新鲜冰冻组织总RNA;取500 ng总RNA为
1.2.3 CCK8法检测细胞的增殖能力 转染 24 h后收集细胞,按照每孔 1×103的细胞数接种 96孔板,每组每个时间点均设置5个重复,每孔培养体积为100 μL。 24 h 细胞贴壁后,取0、12、24、48 h 作为时间点分别加入 10 μL CCK-8试剂(DOJINDO,日本),置于37℃环境中孵育2 h,然后在450 nm波长处测定吸光度,并绘制细胞生长曲线。
1.2.4 Transwell法检测细胞的迁移能力 转染 48 h后收集细胞,以200 μL不含胎牛血清的 RIPM 1640培养基重悬细胞,按照每孔 5×104的细胞加入到Transwell上室,下室加入 600 μL含10%胎牛血清的RIPM 1640培养基,孵育24 h后取出上室,去掉上室的培养基,4%多聚甲醛固定细胞15 min,用0.2%结晶紫染色25 min,用棉签擦去上室细胞,用自来水洗上室3次,正置显微镜下随机选择5个视野进行细胞计数并拍照保存。
1.2.5 Transwell法检测细胞的侵袭能力 实验方法基本同迁移实验,唯一区别为所使用是经过Matrigel基质胶包被的上室,制作方法为液态的基质胶原液以不含胎牛血清的 RIPM 1640培养基稀释8倍,取50 μL加入上室中,置于37℃环境,待基质胶凝固30 min后使用。
1.2.6 划痕试验 培养板接种细胞之前先用marker笔在12孔板背面画横线标记,细胞消化后种入12孔板,细胞铺满板底后,用10 μL枪头垂直于孔板沿着横线标记均匀用力制造划痕,吸去细胞培养液,用PBS轻轻冲洗孔板三次,洗去划痕产生的细胞碎片。加入无血清培养基,拍照记录。将培养板放入培养箱培养,每隔4~6 h取出拍照,直至划痕基本愈合。
1.3 统计学处理 采用SPSS22.0软件进行数据分析。实验数据以±s表示,两组数据比较采用Mann-Whitney U检验。CCK-8实验和流式凋亡实验多组数据比较采用单因素方差分析,组间数据比较采用LSD-t检验。用卡方检验或 Fisher确切概率法及Spearman法进行相关性分析。检验水准为α=0.05,采用双侧性检验。
2 结果
2.1 GC癌组织和癌旁组织中miR-532-5p表达水平的比较 荧光定量PCR试验分析表明,60例胃癌/癌旁组织中,83.3%呈低水平(图1A),且miR-532-5p的相对表达量低于癌旁组织的相对表达水平(P=0.0135,图 1B)。

图1 miR-532-5p在GC癌组织中的表达量
2.2 miR-532-5p在GC癌组织中表达量与临床参数之间的关系 miR-532-5p表达量与肿瘤直径(r=0.314, P=0.024)、远处转移(r= 0.536, P= 0.035)具有显著相关性(表2)。
2.3 NC、mimics和 inhibitors组的 MKN45 细胞内miR-532-5p表达水平 MKN45细胞转染后,与NC空白对照组相比,mimics组的miR-532-5p表达显著上调(∗∗P=0.00015),而转染 inhibitor后,miR-532-5p表达显著下调(∗P=0.00295),这提示 miR-532-5p低表达和过表达细胞模型构建成功。

表2 miR-532-5p表达与GC患者临床病理参数的关系

图2 NC、mimics和inhibitors组的MKN45细胞内miR-532-5p表达情况(∗p <0.005,∗∗p <0.001)
2.4 NC、mimics和 inhibitors组 MKN45 细胞增殖能力的比较 CCK8增殖实验显示,相比NC空白对照组,mimics组miR-532-5p表达上调后MKN45细胞生长曲线在4天时间点显著位于NC组下方(∗∗∗p<0.001),inhibitors组 MKN45 细胞生长曲线在 2 天(∗p<0.05)、3 天(∗∗∗p<0.001)、4 天(∗∗∗p<0.001)时间点均显著位于NC组上方。这表明,说明增强miR-532-5p的表达可以抑制MKN45细胞的增殖,而敲低miR-532-5p的表达可以增强MKN45细胞的增殖。
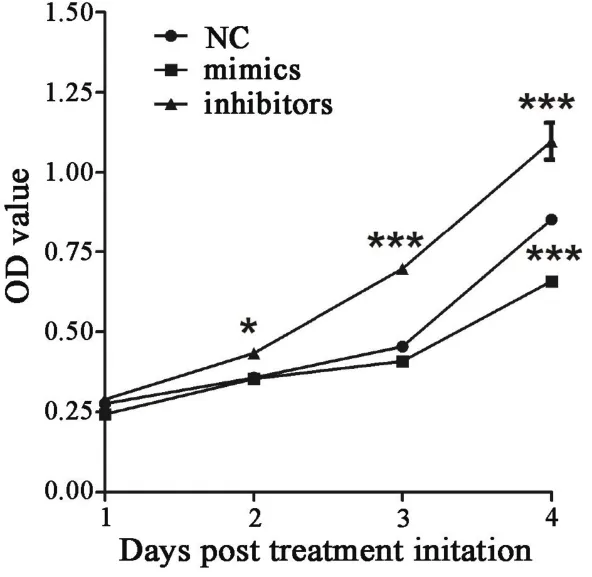
图3 miR-532-5p NC、mimics和inhibitors转染MKN45细胞后在1、2、3、4天时间点加入CCK8,在490 nm处分析去荧光OD值(∗p <0.05, ∗∗∗p <0.001)
2.5 NC、mimics和 inhibitors组 MKN45 细胞迁移实验 迁移实验结果显示,相对于NC对照组(实验细胞穿过上室的数量为 185.0±5.8),mimics 组发生迁移的细胞数目(60.0±2.9)显著减少(∗∗∗P =0.0005),inhibitors 组发生迁移的细胞数目(292.0+6.9)显著增加(∗P=0.0318)。 说明过表达 miR-532-5p可以抑制MKN45细胞的迁移能力,反过来敲低miR-532-5p表达可以增强MKN45细胞的迁移能力。

图4 NC、mimics和inhibitors组MKN45细胞迁移能力比较。(∗表示 p <0.05, ∗∗∗表示 p <0.001, 标尺为 200×)
2.6 NC、mimics和 inhibitors组 MKN45 细胞侵袭能力的比较 细胞侵袭实验结果显示:相对于NC对照组(实验细胞穿过上室的数量为 103.3±5.3),mimics组发生侵袭的细胞数目(20.7±2.2)较 NC 组显著减少(∗∗P=0.0061),inhibitors组发生迁移的细胞数目(223.0±11.6)较 NC 组显著增加(∗∗P= 0.0054)。说明过表达miR-532-5p可以抑制MKN45细胞侵袭能力,干扰miR-532-5p表达可以增强MKN45细胞的侵袭能力。

图5 NC、mimics和inhibitors组MKN45细胞、侵袭能力比较。(∗表示 p <0.05, ∗∗∗表示 p <0.0001, 标尺为 200×)。
2.7 NC、mimics和inhibitors组的划痕实验结果
相对于NC对照组,mimics组MKN45细胞在24h时内的迁移比例相对降低(∗P=0.0192),而 inhibitors组MKN45细胞在24 h时的迁移比例相对增强(∗P=0.0105)。说明过表达miR-532-5p可以抑制MKN45细胞迁移能力,干扰 miR-532-5p表达可以增强MKN45细胞迁移能力。
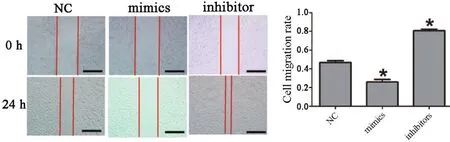
图6 NC、mimics和inhibitors组MKN45细胞划痕实验(∗p <0.05,标尺为 200×)
3 讨论
成熟的miRNA可以通过抑制转录调节多种基因产物,在组织中具有空间和时间的表达特异性,在细胞增殖、凋亡和分化中起重要作用[7-8,17]。 近期大量研究[11,18]表明 miRNA和肿瘤的发生发展相关。 其中,miR-532-5p被研究发现在多种肿瘤中具有调节肿瘤生物特性的功能[12,14,19]。 miR-532-5p 和 GC 发生发展的关系也有相关研究。Xu等[16]的体外实验表明,过表达miR-532-5p可以增强胃癌细胞的增殖能力,其体内实验也证实,过表达miR-532-5p可以增加小鼠体内肺重量及肺移植瘤数量。然而,该研究对新鲜GC癌组织标本进行检测,并未得到相应的实验结果。该研究未对此进一步延伸探索,但也提示我们,miR-532-5p与胃癌的发生发展可能存在一定关系。鉴于miR-532-5p潜在的肿瘤增殖调节功能和胃癌对诊治新靶标的需求,我们对此进行了进一步深入探究,以明确miR-532-5p与胃癌发生发展的关系。我们利用荧光定量PCR实验检测60例GC患者癌组织及其配对癌旁组织中miR-532-5p的表达水平,发现胃癌组织中miR-532-5p的相对表达量低于癌旁组织的相对表达水平。进一步分析miR-532-5p表达与胃癌患者临床病理参数的关系,发现肿瘤体积较大者(直径≥3 cm)和发生远处转移的癌组织中的miR-532-5p表达水平显著下调。因此,我们有理由假设miR-532-5p可以抑制GC的增殖、侵袭和转移,并且进行了后续的细胞功能实验作为验证。后续细胞功能实验进一步证实,miR-532-5p参与抑制GC的增殖、迁移和侵袭。
细胞增殖、迁移、侵袭和转移能力强是恶性肿瘤的主要特征,主要表现为肿瘤细胞的无限增殖能力、细胞周期和侵袭转移的异常调控[20-21]。目前对GC病情判断的诊疗手段有限,主要是体表超声、CT检查、MRI检查、PET-CT检查、超声内镜,往往难以精确判断病情进展[22]。而目前对GC病情的分期主要基于UICC/AJCC制定的TNM分期,现有诊断技术基础上进行TMN分期难以在治疗前对病情做出精确预判[22],不利于做出最佳治疗方案的选择,只有结合分子生物学诊断,才能做到个体化和精准化治疗[5]。结合临床观察,GC癌组织的miRNA异常表达与胃癌的恶性程度及预后存在密切的联系,在胃癌的动态监测复发、预后甚至治疗等方面具有潜在的应用前景[5]。而本研究提示miR-532-5p能够抑制GC的增殖、侵袭和转移,GC癌组织中 miR-532-5p低表达可作为肿瘤体积较大、发生远处转移的标志,因此,miR-532-5p能够作为胃癌的病情评估、治疗方式选择和判断预后的潜在依据。综上所述,本研究提示miR-532-5p可能通过抑制GC的增殖、迁移、侵袭和转移能力而发挥抑癌作用,潜在可能作为GC抗肿瘤侵袭转移的作用靶点。miR-532-5p在GC演进中的生物相关性是一个值得深入研究的方向,可以为发病率高、预后差的GC的生物学研究提供新的方法和思路。
本研究尚存在一些不足,如组织样本较少,后期可能需要进一步大样本、多中心前瞻性临床研究来验证;其次,miR-532-5p对GC的抑癌机制尚未进一步研究,需要后续进一步实验补充。
【参考文献】
[1] Hartgrink HH, Jansen EP, van Grieken NC, et al.Gastric cancer[J].Lancet,2009,374(9688):477-490.
[2] Siegel RL, Miller KD, Jemal A.Cancer statistics, 2017[J].CA Cancer J Clin,2017,67(1):7-30.
[3] Hu Y, Huang C, Sun Y, et al.Morbidity and mortality of laparoscopic versus open d2 distal gastrectomy for advanced gastric cancer:A randomized controlled trial[J].J Clin Oncol,2016,34(12):1350-1357.
[4] Chen W, Zheng R, Baade PD, et al.Cancer statistics in China,2015[J].CA Cancer J Clin,2016,66(2):115-132.
[5]任传利,王立红,韩崇旭,等.循环microRNA在胃癌早期诊断价值的研究进展[J].转化医学电子杂志,2017,4(5):37-39.
[6] Zhao X, Dou W, He L, et al.MicroRNA-7 functions as an anti-metastatic microRNA in gastric cancer by targeting insulin-like growth factor-1 receptor[J].ONCOGENE,2013,32(11):1363-1372.
[7] Ambros V.The functions of animal microRNAs[J].Nature,2004,431(7006):350-355.
[8] Sempere LF, Freemantle S, Pitha-Rowe I, et al.Expression profiling of mammalian microRNAs uncovers a subset of brain-expressed microRNAs with possible roles in murine and human neuronal differentiation[J].Genome Biol,2004,5(3):R13.
[9] Wang W, Luo YP.MicroRNAs in breast cancer: oncogene and tumor suppressors with clinical potential[J].J Zhejiang Univ Sci B,2015,16(1):18-31.
[10] Kohlhapp FJ, Mitra AK, Lengyel E, et al.MicroRNAs as mediators and communicators between cancer cells and the tumor microenvironment[J].Oncogene,2015,34(48):5857-5868.
[11] Liz J, Esteller M.LncRNAs and microRNAs with a role in cancer development[J].Biochim Biophys Acta,2016,1859(1):169-176.[12] Kitago M, Martinez SR, Nakamura T, et al.Regulation of RUNX3 tumor suppressor gene expression in cutaneous melanoma[J].Clin Cancer Res,2009,15(9):2988-2994.
[13] Wang F, Chang JT, Kao CJ, et al.High Expression of miR-532-5p,a tumor suppressor,leads to better prognosis in ovarian cancer both in vivo and in vitro[J].Mol Cancer Ther,2016,15(5):1123-1131.[14] Griesing S, Kajino T, Tai MC, et al.Thyroid transcription factor-1-regulated microRNA-532-5p targets KRAS and MKL2 oncogenes and induces apoptosis in lung adenocarcinoma cells[J].Cancer Sc,2017,108(7):1394-1404.
[15] Song X, Wang Z, Jin Y, et al.Loss of miR-532-5p in vitro promotes cell proliferation and metastasis by influencing CXCL2 expression in HCC[J].Am J Transl Res,2015,7(11):2254-2261.
[16] Xu X, Zhang Y, Liu Z, et al.miRNA-532-5p functions as an oncogenic microRNA in human gastric cancer by directly targeting RUNX3[J].J Cel Mol Med,2016,20(1):95-103.
[17] Bartel DP.MicroRNAs: genomics, biogenesis, mechanism, and function[J].Cell,2004,116(2):281-297.
[18] Meltzer PS.Cancer genomics: small RNAs with big impacts[J].Nature,2005,435(7043):745-746.
[19] Song X, Wang Z, Jin Y, et al.Original article loss of miR-532-5p in vitro promotes cell proliferation and metastasis by influencing CXCL2 expression in HCC[J].Am J Transl Res,2015,7(11):2254-2261.
[20] Zou M, Baitei EY, Binessa HA, et al.Cyp24a1 attenuation limits progression of BrafV600E-induced papillary thyroid cancer cells and sensitizes them to BRAFV600E inhibitor PLX4720[J].Cancer Res,2017,77(8):2161-2172.
[21] Sun J, Shi R, Zhao S, et al.E2F8, a direct target of miR-144,promotes papillary thyroid cancer progression via regulating cell cycle[J].J Exp Clin Cancer Res,2017,36(1):40.
[22]武爱文,季加孚.胃癌分期与临床诊治相关性[J].中国医学前沿杂志(电子版),2012,4(5):4-6.
