特发性矮小遗传学研究及展望*
2018-04-28杨万岭
杨万岭 班 博
(1香港大学儿童及青少年医学系,香港 999077;2中国生长发育行为医学研究中心,3济宁医学院附属医院内分泌科,济宁 272029)
身材矮小的原因很多,矮小常常是某些综合征表现的一部分[1],如:小于胎龄儿而且缺乏生长追赶、不对称性骨骼发育异常、小头畸形、有明显的智力发育异常、有明显的生长激素缺乏或多种垂体激素缺乏、对生长激素或胰岛素样生长激素不敏感、明显的面部或身体的特殊表现、第二性征发育异常等。观察表现阳性往往提示矮小是某种综合征表现的一部分,应该结合患者的其他性状综合考虑,进一步行临床和遗传学检测,明确分子诊断。另外,详细采集三代家族史、孕史、发育史,全面评估骨骼发育、激素水平、功能试验及生长激素治疗效果等,均有利于对疾病做出准确诊断、规范治疗。本文将着重阐述特发性矮小的遗传学病因及鉴别,判断是单一基因导致的遗传病,还是多种基因和环境因素共同造成的复杂性疾病,以及如何选择有效的分子诊断方法对患者进行遗传学检测或研究。
1 特发性矮小
特发性矮小(idiopathic short stature,ISS)是指患者身高低于同年龄、同性别、同种族儿童身高平均值至少2个标准差(SD),生长速率缓慢,无其他可识别的生长激素-胰岛素样生长因子轴异常,无明显的骨骼发育不良、小头畸形、智力发育障碍等。可分为家族性矮小和非家族性矮小。家族性矮小指患者身高较参考人群矮小,但依据父母的身高推算尚属期待范围。非家族性矮小指患者相对于参考人群和家庭都属矮小。有些特发性矮小患者会有不太明显的软骨或骨发育不良。
人类的身高呈正态分布,遗传在身高增长方面起最重要的作用,可以解释大约80%的个体身高差异。在许多复杂性疾病或人类性状的研究中,若样本的其他性状和疾病对身高的增长没有明显的影响,可以同时研究影响身高的遗传因素。
2 特发性矮小的遗传学
任何遗传性疾病的研究,首先要明确它是复杂性疾病,还是单一遗传因素导致的疾病,特发性矮小的研究也是如此。人类智力、性情等性状及自身免疫性疾病、精神性疾病、2型糖尿病、中风、动脉粥样硬化、高脂血症等疾病,除极个别情况外,都与复杂性遗传有关。遗传因素对这些性状或疾病起着重要作用。很多疾病有高度家族遗传倾向,而其他非遗传因素也与疾病有密切关系。遗传因素起作用的方式较复杂,可能是成百上千个基因位点共同起作用的结果,每一个位点的作用比较细微。
如果矮小是某综合征多种表现之一,往往是由单一遗传因素导致。比较严重矮小(如身高小于3标准差或0.15个百分位),即使没有其他的明显表现,其为单基因病的可能性也大大增加。除了依据病史、临床表现和实验室检查外,如果有比较明确的家族史,并且能够明确一种遗传模式,如常染色体显性、常染色体隐性遗传和性染色体连锁遗传,也可以确定是单基因遗传病。常染色体显性遗传的特点是每一代都有人发病。常染色体隐性遗传的特点是先证者一代有一个或多个发病,而父母一代一般没有人发病。性染色体连锁遗传的特点是携带者母亲将致病基因遗传给儿子。
家族性矮小一般认为是遗传因素起主要作用。但应该注意的是,这并不一定就是单基因病的表现。如果家系分析很难判断是常染色体显性遗传、常染色体隐性或性染色体连锁遗传,则说明遗传因素有可能较复杂,可能不是单一基因位点变异导致发病。相反,非家族性矮小未必不是单基因引起,因为有相当一部分致病突变是新发突变。因此,如果父母和家系中其他人身高都正常,患者身材非常矮小,则可能是新发突变造成的(也可能是常染色体隐性遗传)。比较严重的特发性矮小,既可能是复杂性性状的一部分,也可能是一些不同的单基因病的混合。即使他们不是由单基因造成的,但是否更有可能存在一些作用比较大的罕见变异,也是一个有待回答的问题。
3 特发性矮小遗传检测方法
不同的遗传方式要选择不同的检测或研究手段(图1)。对于怀疑单一位点变异导致的疾病,可以用核型分析、染色体微阵列(chromosomal microarray,CMA),也可对全基因组、全外显子组、一组备选基因进行二代测序。这些方法各有其适应症、优缺点(表1),应该选择性使用或联合使用。如染色体核型分析用于检测大的结构性缺失和扩增、染色体单体、染色体三体和平衡异位等。女性矮小常常需要进行核型分析以排除Turner 综合征。另外,荧光原位杂交(fluorescence in situ hybridization,FISH)可以定位检测特定位点的变异,如SHOX基因的全缺失、22q11.2、Xp13.2 区域的微缺失等。
3.1 靶基因测序
单一基因的检测曾经在遗传检测中占有重要地位,如不对称骨骼发育不良者需检查FGFR3,怀疑Noonan综合征的患者需检查PTPN11或其他 ras-MAPK通路的基因等。下丘脑-垂体-生长激素轴的异常,可以检查GH1,GHRHr或IGF1R。对于不同机制造成的矮小的已知致病基因[2]见表2。
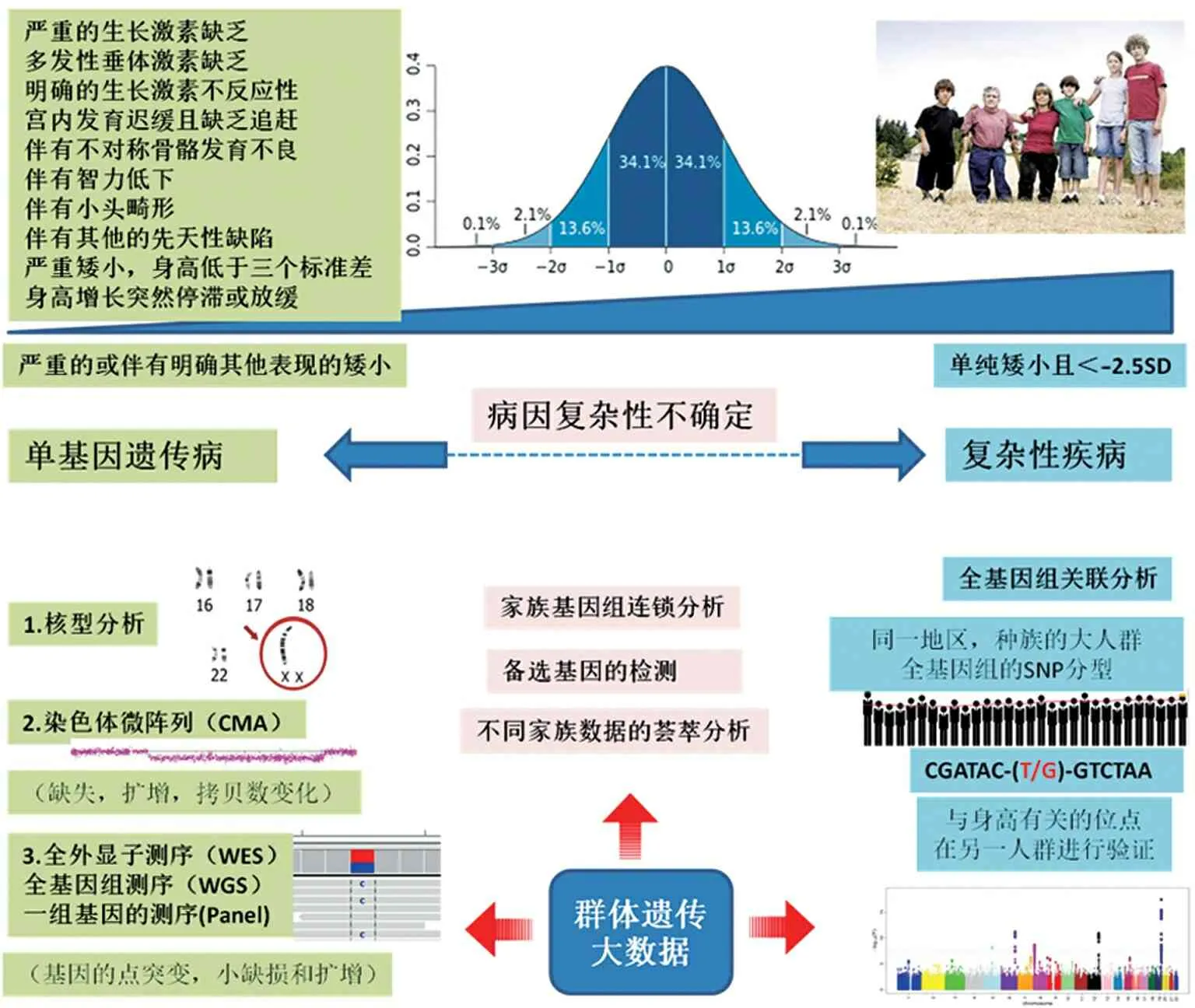
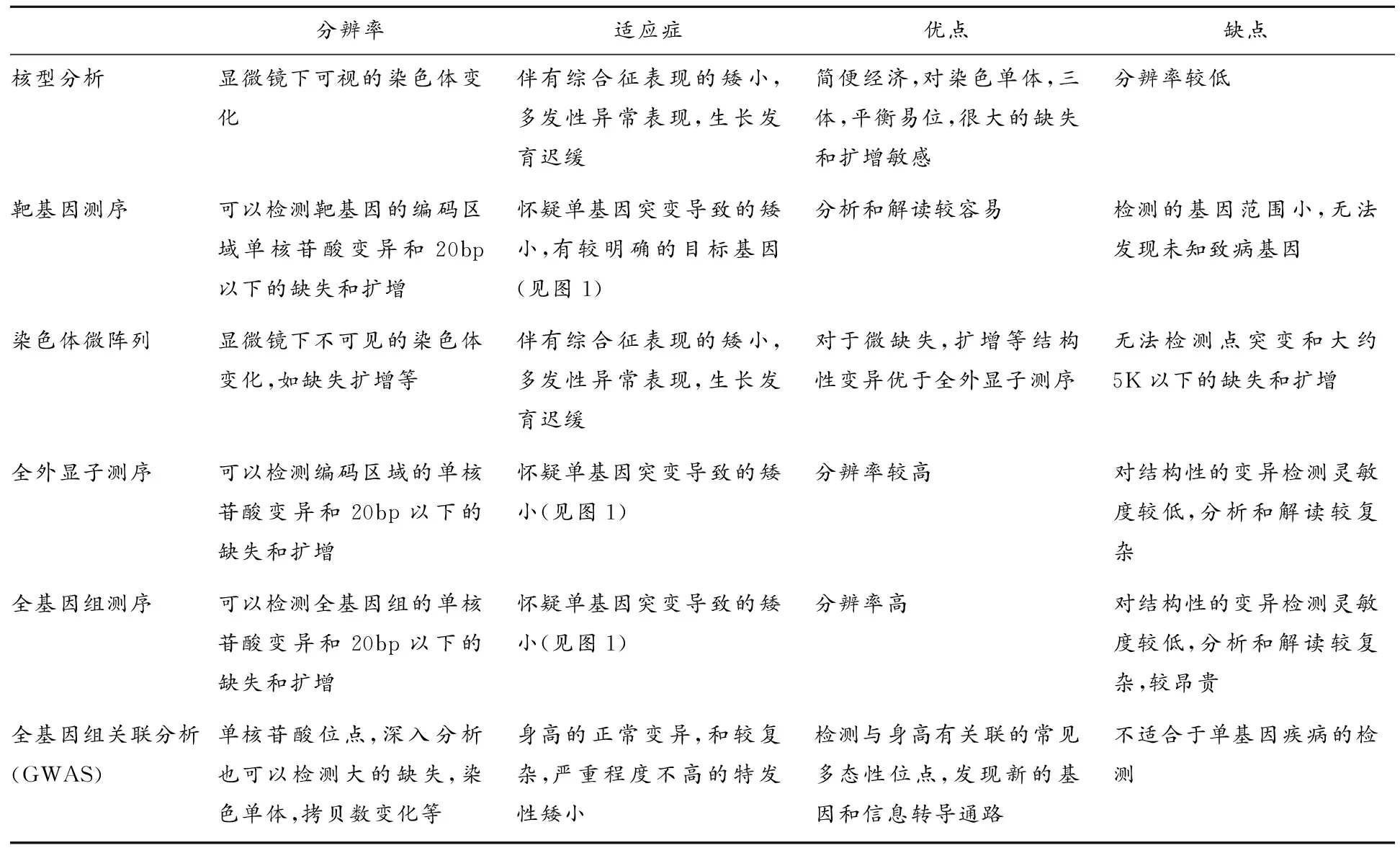
图1 矮小遗传学研究思维

表2 不同机制造成的矮小已知致病基因
注:AR,常染色体隐性;AD,常染色体显性;XLR,性染色体连锁隐性
3.2 特发性矮小的单基因研究
对特发性矮小的单基因研究主要是外显子测序,一个或一组基因的靶向测序[3]。近年来,一些针对性较强的检测发现了一些已知的严重疾病致病基因中有杂合而非纯合的突变,或者对功能冲击相对较小的突变造成较不典型的临床表现。如对86个特发性矮小患者,Hattori等[4]检测了ACAN,FGFR3,NPR2,SHOX,GHRHG,GH1,STAT5B,IGF1,IGFALS,IGF1R等10个基因,因为这些基因和骨骼发育异常、生长激素-胰岛素样生长因子轴有关,但也有报道这些基因的某些突变或杂合子的变异可能造成特发性矮小。在19个病人中他们发现了18个较罕见的杂合突变。他们认为ACAN 的突变有可能和无明显骨骼异常的特发性矮小有关。SHOX基因的杂合缺失造成的单体剂量不足也是最常见的单基因性矮小的致病基因之一,据认为大概出现于2%~15%的特发性矮小患者中[5]。David等[6]研究了144名特发性矮小患者SHOX基因的杂合缺失,发现有7.6%的患者有SHOX缺失。另外,杂合子的NPR2突变和IGF1 杂合缺失造成的单倍剂量不足也有报道[7]。Quintos 等[8]对一家三代疑似常染色体显性遗传的矮小研究发现了ACAN 上的一个无义突变,且患者伴有明显的骨龄超前。Hauer等[9]研究了428个特发性矮小的家庭,发现4个家庭有ACAN 基因的杂合无义突变,2个家庭有可能致病的错义突变。这些患者平均身高在-3.2SD左右。需要指出的是,这些研究一般样本量不大,要完全证实这些常见致病基因的一些突变是否导致相对较轻微的临床表现,还需要更大样本的独立研究加以验证。从另一角度来说,针对这些基因,设计整个基因的捕获和深度二代测序,也许是增加灵敏度和诊断成功率、降低费用的有益尝试。
3.3 染色体微阵列
随着测序价格的进一步降低,一个或数个基因的检测将会逐渐被全外显子或全基因组测序所取代。对于核型分析无法检测到的缺失或扩增,可以用染色体微阵列的方法。它对于生长发育不良和先天性异常的检测,已经达到了取代核型分析的地位[10]。二代测序的方法则是分辨率可以高到单核苷酸变异的程度,而且可以发现新的致病基因。缺点是对结构性的突变敏感性不高,数据的分析和解读比较复杂。目前对于怀疑单基因异常导致的疾病,且核型分析没有明确发现的,可以采取微阵列加全外显子测序的方法。
3.4 全基因组关联分析
对于大部分非严重矮小,且无明显的其他异常,则可能是复杂性状的一种较极端表现。目前对于复杂性疾病的遗传因素,最有效的研究方法是全基因组的关联分析(genome-wide association studies,GWAS)。这是一种对基因组中的单核苷酸多态性(single nucleotide polymorphism,SNP)进行分析的方法。每个芯片可以同时对基因组中数万到上百万不等的SNP进行分析。SNP 的选择是基因组中人群频度较高的位点,再略去那些相互之间有高度连锁不平衡性,信息重复的位点。因为不同种族之间SNP的频度有很大区别,有些芯片针对特别人群设计,如中华芯片。也有专门注重于编码区域的外显子芯片等。2010年发表的一项身高全基因组关联分析研究[11],发现基因组中的180个位点和身高有关,这些位点解释了大约10%的身高差异。然而,这些位点并非在基因组中随机分布,而是突出表现了骨骼发育信息通路和已知的与骨骼发育有关的基因在身高增长中的作用。另一方面,这也表示对身高的关联分析有可能会发现与身高有关的重要基因,加深对生长发育机制的认识。2014年,《自然遗传学杂志》发表了一项基于25万多人的研究,发现了697个遗传多态性变异[12]。他们报道基因组中频度较高的常见遗传变异大约能够解释身高差异的60%。2017年发表重点研究频度较低的编码区域变异的一篇文章,报道了83个与身高相关的编码位点。其中,IHH,STC2,AR和CRISPLD2 4个基因上的位点对身高有较大的作用[13]。最近一项待发表的研究,在以前工作的基础上加上了45万个英国生物样本库(UK Biobank)的样本,把总样本量增加到70万人,同时把与身高有关的位点增加到3200多个。然而,这些研究都是在欧洲人群中进行的,目前基于亚洲人的研究尚少。许多复杂性疾病的遗传易感位点都表现出了明显的种族差异,对于身高在亚洲人的研究是否会有不同的发现,我们拭目以待。
4 小结与展望
综上所述,人类疾病发生、人类的性状是极端复杂的。既有单一位点造成的遗传性疾病,也有成百上千的多态性位点相关的复杂性性状和疾病。目前的方法是对比较严重和/或伴有其他表现的患者进行针对单基因的检查,如染色体微阵列和全外显子测序,或者针对一些常见致病基因的全面测序。对于身高介于-2.5SD 和-2SD之间的且不伴有其他表现的矮小,和群体的身高分布,我们可以考虑用SNP全基因组分析的方法进行研究。鲁西南地区是孔孟之乡,历史悠久,人口流动性不高,是理想的群体遗传学研究对象。我们近年来在临床诊断和治疗方面已经取得了一些进展,但如何把临床实践和分子水平的研究结合起来,是我们需要进一步探索的问题。目前我们对基因的功能和遗传突变对基因组的影响所知不多。未来的发展,一方面依赖于我们对基因生物学的深入理解,另一方面依赖于我们对基因型和表型之间关系的深入分析。要实现这一点,我们需要有人群的遗传学大样本和大数据。我们需要充分利用国内、国际的广泛合作,并鼓励患者积极参与。群体遗传数据的积累无论对我们诊断单基因突变导致的矮小,还是理解对身高有关联的常见多态性位点和机制,都会起到重要的作用。
参考文献:
[1] Seaver LH,Irons M;American College of Medical Genetics(ACMG) Professional Practice and Guidelines Committee.ACMG practice guideline:genetic evaluation of short stature[J].Genet Med,2009,11(6):465-470.DOI:10.1097/GIM.0b013e3181a7 e8f8.
[2] Wit JM,Oostdijk W,Losekoot M,et al.MECHANISMS IN ENDOCRINOLOGY:Novel genetic causes of short stature[J].Eur J Endocrinol,2016,174(4):R145-R173.DOI:10.1530/EJE-15-0937.
[3] Dauber A,Rosenfeld RG,Hirschhorn JN.Genetic evaluation of short stature[J].J Clin Endocrinol Metab,2014,99(9):3080-3092.DOI:10.1210/jc.2014-1506.
[4] Hattori A,Katoh-Fukui Y,Nakamura A,et al.Next generation sequencing-based mutation screening of 86 patients with idiopathic short stature[J].Endocr J,2017,64(10):947-954.DOI:10.1507/endocrj.EJ17-0150.
[5] Sandoval GT,Jaimes GC,Barrios MC,et al.SHOX gene and conserved noncoding element deletions/duplications in Colombian patients with idiopathic short stature[J].Mol Genet Genomic Med,2014,2(2):95-102.DOI:10.1002/mgg3.39.
[6] Dávid A,Butz H,Halász Z,et al.The prevalence of SHOX gene deletion in children with idiopathic short stature.A multicentric study[J].Orv Hetil,2017,158(34):1351-1356.DOI:10.1556/650.2017.30829.
[7] Batey L,Moon JE,Yu Y,et al.A novel deletion of IGF1 in a patient with idiopathic short stature provides insight Into IGF1 haploinsufficiency[J].J Clin Endocrinol Metab,2014,99(1):E153-E159.DOI:10.1210/jc.2013-3106.
[8] Quintos JB,Guo MH,Dauber A.Idiopathic short stature due to novel heterozygous mutation of the aggrecan gene[J].J Pediatr Endocrinol Metab,2015,28(7-8):927-932.DOI:10.1515/jpem-2014-0450.
[9] Hauer NN,Sticht H,Boppudi S,et al.Genetic screening confirms heterozygous mutations in ACAN as a major cause of idiopathic short stature[J].Sci Rep,2017,7(1):12225.DOI:10.1038/s41598-017-12465-6.
[10] Miller DT,Adam MP,Aradhya S,et al.Consensus statement:chromosomal microarray is a first-tier clinical diagnostic test for individuals with developmental disabilities or congenital anomalies[J].Am J Hum Genet,2010,86(5):749-764.DOI:10.1016/j.ajhg.2010.04.006.
[11] Lango Allen H,Estrada K,Lettre G,et al.Hundreds of variants clustered in genomic loci and biological pathways affect human height[J].Nature,2010,467(7317):832-838.DOI:10.1038/nature09410.
[12] Wood AR,Esko T,Yang J,et al.Defining the role of common variation in the genomic and biological architecture of adult human height[J].Nat Genet,2014,46(11):1173-1186.DOI:10.1038/ng.3097.
[13] Marouli E,Graff M,Medina-Gomez C,et al.Rare and low-frequency coding variants alter human adult height[J].Nature,2017,542(7640):186-190.DOI:10.1038/nature21039.
