液相色谱-串联质谱法测定果蔬中6种酰胺类农药的残留量
2018-04-28高海荣
高海荣
酰胺类农药是目前市场上应用最为广泛的农药,主要是通过抑制琥珀酸脱氢酶的活性,使病菌失去活性,而达到灭菌的目的[1-2]。现多用于对瓜果蔬菜耕种期的杀菌和储藏期的防霉[3],相对于酰胺类的除草剂和杀虫剂,酰胺类的杀菌剂毒性低、药量小,在生活中应用更为普遍。但随着普及,酰胺类杀菌剂的代谢残留问题引起了人们的关注,目前市场上最常见的酰胺类药物有16个品种[4-5],环丙酰胺、萎锈灵、腈菌胺、氟酰胺、噻唑菌胺、氧化萎锈灵、灭锈胺、硅噻菌胺、噻酰菌胺、噻呋酰胺、环酰菌胺、氟吡菌胺、双氯腈菌胺、环氟菌胺、氟酰菌胺、环啶菌胺。不同的国家对酰胺类杀菌剂在瓜果蔬菜中的最大残余量均有着严格的规定,以甲霜灵为例,欧盟规定甲霜灵最大残余量在0.05~2.00 mg/kg[6],日本则将其定义在0.05~4.00 mg/kg[7],而美国则规定应在0.10~15 mg/kg[8],中国香港则认为应在0.05~10.00 mg/kg[9],我国大陆地区则规定在0.05~5.00 mg/kg[10-12]。
目前,对酰胺类农药的监测多采用气相色谱法、气相色谱-质谱法、液相色谱法、液相色谱-质谱法等,通过监测一种或一种以上的酰胺类农药的残余量,来进行综合判断,多瓜果蔬菜中的多种酰胺类农药进行监测的报道较为少见,本文通过使用液相色谱串联质谱对啶酰菌胺、环氟菌胺、氟啶酰菌胺、嘧菌胺、双炔酰菌胺、硅噻菌胺的农药残留余量进行测定,以了解其灵敏度情况和抗干扰情况。
1 方法
1.1 使用仪器
仪器设备:液相色谱-串联四极杆质谱仪,配电喷雾电离源(ESI)(Waters公司)/液相色谱系统(Waters公司);低速台式离心机和微量离心机(Sigma公司);固相萃取装置(Agela公司);涡旋混匀器(IKA公司);超纯水净化系统(Pall公司);电子天平(Mettler公司)。
材料试剂:甲醇、乙腈、甲苯、乙酸铵、甲酸、Florisil固相萃取柱、95%二氯甲烷-5%甲醇溶液、乙二胺-N-丙基甲硅烷(PSA)填料、C18-H(17%)填料、NaCl、0.22微米滤膜(Pall公司)。
啶酰菌胺、环氟菌胺、氟啶酰菌胺、嘧菌胺、双炔酰菌胺、硅噻菌胺标准物质(Sigma公司)。
1.2 实验方法
标准溶液的配制:称量0.01 g标准物质,加入10 ml乙腈进行溶解,配制为1 mg/ml浓度的储备液,再用移液管吸取适量的储备液,加入乙腈,配制为10 mg/L的中间溶液,可再根据需要配备其他浓度的标准溶液。
色谱条件:色谱柱:C18=200 mm×4.6 mm,粒径3.0 μm;流动相:纯水(A相)及乙腈(B相),柱温:30℃,流速200 μl/min;进样量:1.0 μl。进行梯度脱洗:0~ 4 min,B相20% ~ 50%,5~ 13 min,B相 50% ~ 70%。14~ 16 min,80%,15~ 15.05 min,B相 80% ~ 20%,15.05 min,B相20%。
质谱条件:电离+6种酰胺类农药,离子源:可加热的ESI源,扫描方式,正离子扫描,检测方式:MRM,喷雾电压:3 000 V,辅助气(N2)压力:55.0 MPa;毛细管温度:300℃,离子源温度:300℃,其他质谱条件见表1。
样品的提取与净化:使用准确精度为0.001 g的电子天平,称量20 g已均质样品,放入250 ml的离心管中,加入20 ml乙腈和3~5 g NaCl,涡旋混匀,进行离心。在室温下静置1 h,取10 ml离心后的上清液,用氮气吹干,残余物用95%二氯甲烷-5%甲醇溶液进行溶解,完成提取过程。接着将样品转移至Florisil固相萃取柱(用95%二氯甲烷-5%甲醇活化Florisil固相萃取柱,并分三次清洗样品瓶),将清洗后的液体均转移至固相萃取柱,接收所有的流出液,用氮气吹干,再用5 ml甲醇复溶,过0.22 μm有机相滤膜,用以液相色谱-串联质谱的测定。

表1 化合物质谱采集离子信息

表2 6种农药相关系数、检出限和定量限
1.3 测定基质效应
样品完成提取和净化后,配制纯溶剂检测液和空白基质检测液,在同一色谱条件下测定基质效应,应用响应值计算公式:Mi=(Ami-Asi)/Asi×100。
2 结果
2.1 优化质谱调节
对1.0 mg/L待测化合物的单标准溶液以流动注射的方式进行母离子全扫描,结果显示在正离子化模式下6种杀菌剂均可形成稳定的[M+H]+,经过一级质谱优化,确定喷雾电压等质谱参数,通过二级扫描,优化子离子等参数,选取1个母离子及其对应的4个子离子,在含基质的条件下扫描,最终选择两个灵敏度高且受到干扰影响小的离子,以强度较高的为定量离子,见表1。
2.2 优化色谱条件
目标化合物与样品杂质有效分离是降低基质效应的有效手段,本次采用C18色谱柱,相同条件下与超高压色谱柱相比,该色谱柱的柱压下降40%~45%,本研究采用两次梯度进行脱洗,使得基质效应明显降低,6种酰胺类药物均得到了基线分离,见图1。
2.3 净化方法的选择
目前对于瓜果蔬菜中酰胺类农药残留,常用的是QuEChERS法,但是其净化效果差,可能会产生较强的基质效应,本次实验选取葡萄、黄瓜、白菜等10种基质,分别采用改进QuEChERS法和Florisil固相萃取法进行比较,评价净化效果。见图2和图3,可知经过Florisil净化后,目标物的基质效应降低,回收率在86%~106%。
2.4 线性范围与检出限
将6种杀菌剂混合标准溶液进行稀释,质量浓度为0.5 μg/L、5 μg/L、20 μg/L、50 μg/L、100 μg/L,以定量离子对的峰面积为纵坐标、各酰胺类杀菌剂组分浓度为横坐标绘制标准曲线,结果表明,目标物质量浓度在0.5~100 μg/L的范围内有较好的线性关系,见表2。
2.5 方法回收率及精密度
根据前文建立的方法,以葡萄、黄瓜、白菜等10种基质种分别添加5 μg/L混合标准溶液0.5 ml、1.0 ml,进行回收率试验,结果可知评价回收率在65%~125%,见表3。
3 结论
本次通过乙腈提取,Florisil固相萃取柱净化,建立了采用液相色谱-串联质谱方法对瓜果蔬菜中啶酰菌胺、环氟菌胺、氟啶酰菌胺、嘧菌胺、双炔酰菌胺、硅噻菌胺标准物质,共6种酰胺类农药的残余量的测定,其可靠性高、灵敏度强、测量准确,平均回收率在平均回收率在65%~125%,满足了欧盟、日本等国家对于6种酰胺类农药在瓜果蔬菜中的残余量的要求(0.01 mg/kg),对于我国瓜果蔬菜的顺利出口有了定量测量的标准,为农产品的残留监测技术提供了参考和依据。
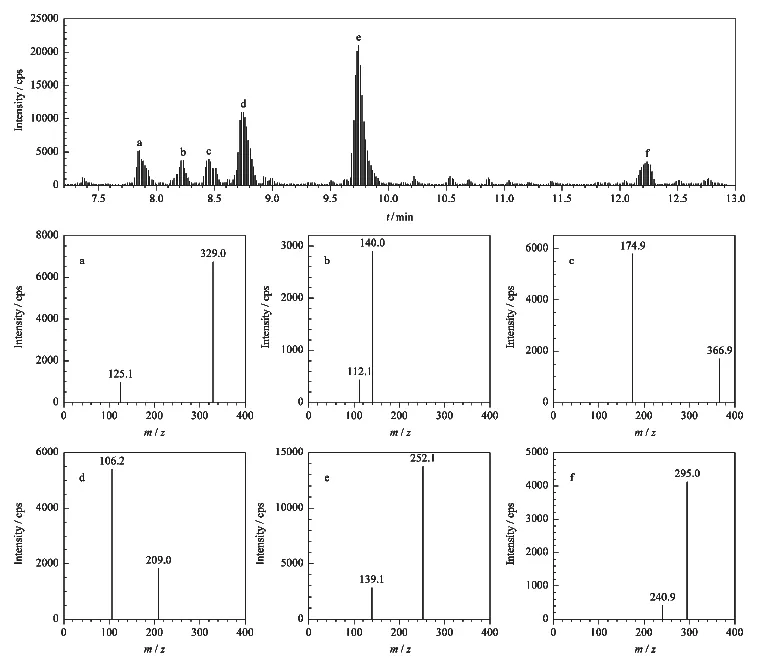
图1 目标物的总离子流图及各化合物的质谱图
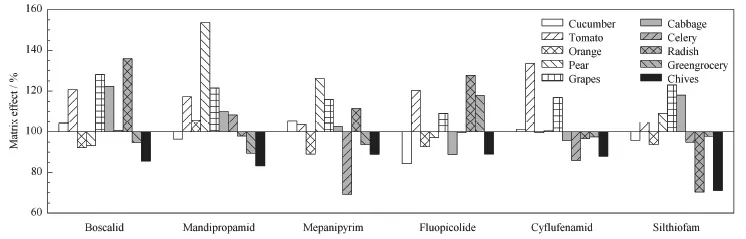
图2 改良QuEChERS法净化后的基质效应

图3 Florisil固相萃取法净化后的基质效应

表3 10种样品中酰胺类杀菌剂的加标回收率和相对标准偏差
[1] 马琳,陈建波,赵莉,等. 固相萃取-超高效液相色谱-串联质谱法同时测定果蔬中6种酰胺类农药残留量[J]. 色谱,2015,32(10):1019-1025.
[2] 刘旭凌,李壹,熊晓辉. 高效液相色谱-串联质谱法检测橘子中10种氨基甲酸酯类农药残留[J]. 科学技术与工程,2015,15(9):10-14.
[3] 王军,代艳娜,黄利英,等. 液相色谱-串联质谱法快速测定蔬菜中10种保鲜剂残留量[J]. 食品安全质量检测学报,2015,7(6):2379-2385.
[4] 吴岩,姜冰,徐义刚,等. QuEChERS-液相色谱-串联质谱法同时测定果蔬中16种农药残留[J]. 色谱,2015,32(3):228-234.
[5] 张建莹,邓慧芬,李月梅,等. QuEChERS/超高效液相色谱-串联质谱法测定果蔬中122种香港规例农药残留[J]. 分析测试学报,2017,36(7):849-857.
[6] 储大可,李蓉,张朋杰,等. 分散固相萃取-液相色谱-串联质谱法同时测定果蔬中21种氨基甲酸酯类农药残留[J]. 中国卫生检验杂志,2015,25(22):3820-3824.
[7] 宋鑫,王芹,杭学宇. 凝胶渗透色谱净化-固相萃取-超高效液相色谱-串联质谱法检测蔬菜中氨基甲酸酯类农药残留[J]. 色谱,2015,32(22):1019-1025.
[8] 张云,黄传辉,陈泽宇. 超高效液相色谱-串联质谱法测定植物油中邻氨基苯甲二酰胺类农药[J]. 食品安全质量检测学报,2016,8(7):2860-2866
[9] 吴春英,白鹭,谷风,等. 固相萃取-超高效液相色谱-串联质谱法同时测定地表水中的18种酰胺类除草剂[J]. 理化检验(化学分册),2016,54(5):602-606.
[10] 许文娟,王振刚,丁葵英,等. QuEChERS/液相色谱-串联质谱法测定5种蔬菜中17种氨基甲酸酯类农药的基质效应研究[J].分析测试学报,2017,36(1):54-60.
[11] 张岩岩,尚岩岩,赵杰,等. 固相萃取高效液相色谱-串联质谱联用法测定蔬菜及其制品中苯甲酰脲类农药残留的不确定度评估[J]. 食品安全质量检测学报,2016,8(1):362-366.
[12] 黄超群,谢文,于卓然,等. 液相色谱-串联质谱法测定果蔬中10种酰胺类农药的残留量[J]. 食品安全质量检测学报,2015,7(3): 886-892.
