氧化应激体外模型的构建及沙利度胺保护作用的研究
2018-04-27高红亮
高红亮,吴 超,王 超,程 倩,李 曙
(皖南医学院 病理生理学教研室,安徽 芜湖 241002 )
氧化应激是指机体在遭受到有害刺激后,机体细胞内活性氧(reactive oxygen species,ROS)产生过多,导致组织和细胞的损伤[1]。由于氧化应激的增强,组织细胞内ROS水平急剧上升,而抗氧化酶如超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(Catalase,CAT)等活性降低,使得ROS大量生成积聚,损伤核酸、蛋白质及脂质,导致炎症因子表达,并触发包括平滑肌细胞增殖和迁移在内的多种病理反应,甚至引起细胞凋亡或坏死[2-5]。氧化应激与临床上多种疾病的发生发展有着极大的联系,如动脉粥样硬化发生发展、肺纤维化、癫痫、高血压等[6]。沙利度胺(反应停又名酞胺哌啶酮,Thalidomide)最初作为镇静剂治疗妊娠呕吐,因有致畸作用(婴儿海豹肢)而被禁用。随着近年来的研究,沙利度胺作为抗血管生成剂和免疫调节剂被用于多种疾病的治疗[7],但是在对抗炎症引起的氧化应激损伤中的研究较少,本实验旨在通过体外炎症氧化应激模型的构建,观察沙利度胺对其的影响。
1 材料与方法
1.1 药品与试剂 沙利度胺购于常州制药厂,为纯品原料药,将其溶解于二甲基亚砜(DMSO)后得终浓度为50 g/L的母液。四甲基偶氮唑蓝(MTT)试剂盒购于碧云天生物有限公司,脂多糖(Lipopolysaccharides,LPS)(货号L2880,Sigma公司),凋亡试剂盒(Sigma公司)。
1.2 方法
1.2.1 细胞培养 人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVEC)获于弋矶山医院中心实验室。用DMEM培养基加10%胎牛血清于37℃、含5%CO2的培养箱中培养,同时在培养基中加入双抗(1%青霉素和链霉素)共同培养。
1.2.2 MTT实验 MTT法检测沙利度胺对于HUVEC的无毒性浓度范围。消化培养处于对数生长期的HUVEC,接种在96孔培养板中,保证细胞密度为1×104/孔,次日待贴壁后,换液,加入沙利度胺终浓度分别为1000、500、250、62、31 mg/L的无血清培养基,每个浓度设3个副孔,继续培养24 h后加入MTT( 5g/L) 各20 μL,继续在培养箱培养4 h后,吸出培养液,将DMSO 150 μL分别加入每孔,摇床上避光轻微振荡5 min使结晶紫充分溶解,在酶标仪570 nm 波长下测吸光度(C)值。
1.2.3 流式细胞术检测最佳造模浓度及时间 LPS浓度设为4组(0.125、0.25、0.5、1 mg/L),分别处理HUVEC 6、12、24 h后PBS洗2遍,收集细胞上清液离心,接着采用0.25%不含EDTA的胰酶消化,制备浓度为1×106个细胞 /mL的单细胞悬液,2000 r/min离心5 min,PBS洗涤2次,收集细胞,用200 μL缓冲液重悬,分别加入5 μL FITC和10 μL PI,4℃避光孵育15 min。用PBS将悬液补充至700 μL,上机检测。采用流式细胞术检测LPS不同浓度及时间点的凋亡率。
1.2.4 流式细胞术检测沙利度胺最佳预处理时间 分别用沙利度胺无细胞毒性的最大浓度预处理HUVEC 6、12、24 h后直接加入LPS处理,采用流式细胞术检测沙利度胺不同预处理时间的凋亡率。

2 结果
2.1 LPS最佳作用时间及浓度的确定 通过流式细胞术测定LPS最佳作用时间及浓度,结果显示,较低浓度的LPS(0.25 mg/L,图1A)即可引起HUVEC的凋亡,且随着时间的延长,凋亡率逐渐增加(图1B、C、D)。处理6 h后我们发现不同浓度组凋亡率差异有统计学意义(F=24.12,P=0.00),通过两两比较,1 mg/L和2 mg/L LPS组与0.25 mg/L、0.5 mg/L LPS组相比,凋亡率升高(P<0.05),而1 mg/L和2 mg/L LPS组凋亡率差异无统计学意义。在处理12 h时,单因素方差分析不同浓度组凋亡率差异有统计学意义(F=56.34,P=0.00),SNK法两两比较我们发现2 mg/L LPS的凋亡率最高(P<0.05),可以达到80%,但还是不能达到模型的要求。通过对处理24 h后不同浓度组凋亡率的方差分析(F=42.18,P=0.00),差异有统计学意义后进行两两比较,1 mg/L LPS处理后24 h的凋亡率和2 mg/L LPS处理24 h后的凋亡率都可以达到92%左右(图1E),差异无统计学意义(P>0.05)。故最终我们选取造模条件为1 mg/L LPS处理24 h。
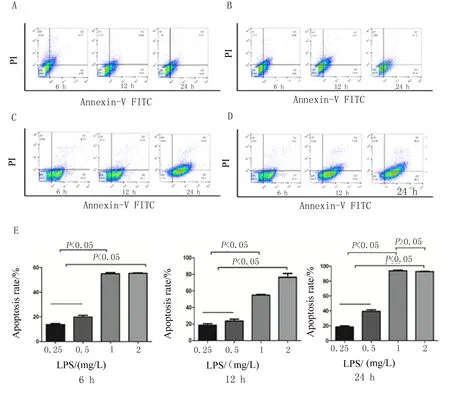
A~D:0.25、0.5、1、2 mg/L LPS分别作用6、12、24 h;E:不同浓度沙利度胺分别处理6、12、24 h的调亡率比较。
图1 流式细胞术测定LPS最佳作用时间及浓度
3.2 沙利度胺无细胞毒性浓度范围的确定 通过MTT法测定沙利度胺的无细胞毒性范围,结果显示,当沙利度胺浓度为31、62、125 mg/L时对细胞基本是无毒性作用的(P>0.05,vs. Control),故最终确定沙利度胺无细胞毒性浓度范围为0~100 mg/L。见图2。

图2 不同浓度沙利度胺对HUVEC活力的影响
3.3 沙利度胺最佳干预时间的确定 通过流式细胞术测定100 mg/L沙利度胺最佳预处理时间,方差分析不同干预组凋亡率差异有统计学意义(F=13.12,P=0.00),两两比较结果显示,与模型组凋亡率(91.6%)相比,沙利度胺预处理6 h(43.26%)、12 h(44.29%)、24 h(43.71%)的凋亡率均明显下降,差异有统计学意义(P<0.05),但是沙利度胺预处理组各之间凋亡率差异无统计学意义(P>0.05)。故确定用沙利度胺预处理6 h。见图3。
3.4 不同浓度沙利度胺保护作用的比较 通过流式细胞术测定不同浓度沙利度胺对氧化应激的保护作用。方差分析不同浓度组凋亡率差异有统计学意义(F=52.12,P=0.00),两两比较结果显示,与模型组凋亡率(75.74%)相比,沙利度胺1 mg/L(68.62%),10 mg/L(52.66%),100 mg/L(23.04%)预处理组均表现出了不同程度的保护作用,其中100 mg/L沙利度胺预处理组凋亡率与1 mg/L,10 mg/L预处理组相比,凋亡率下降,差异有统计学意义(P<0.05)。见图4。
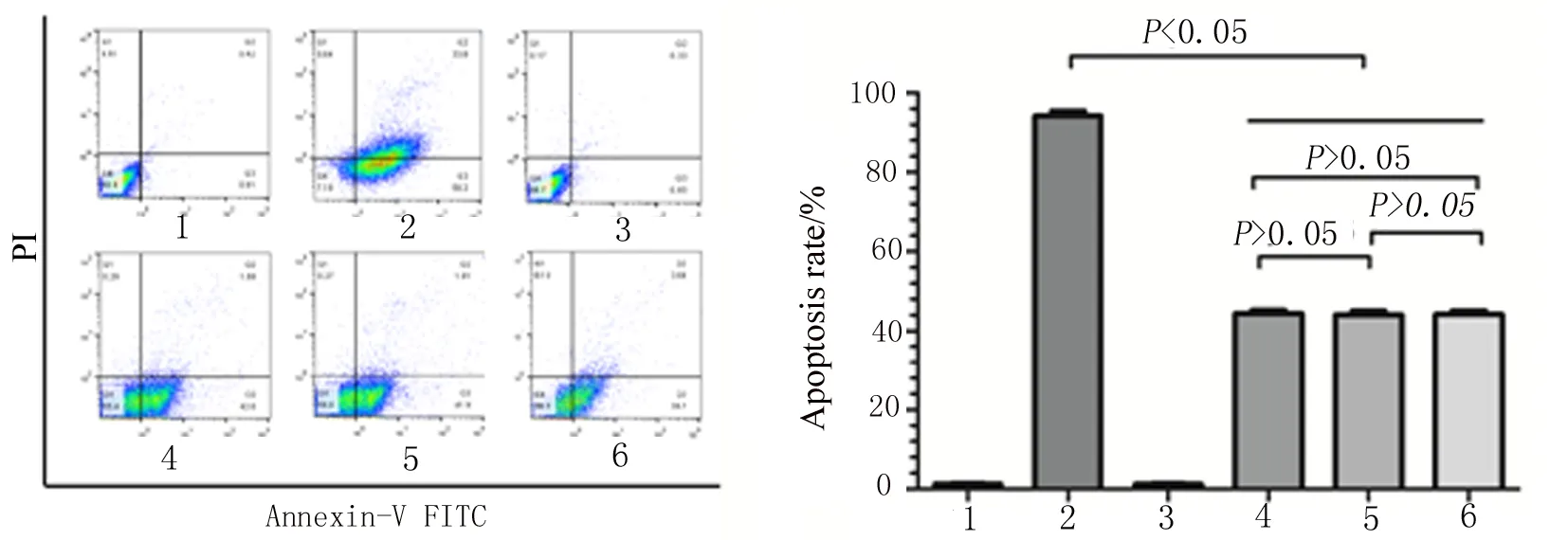
1:空白对照组;2:模型组;3:沙利度胺单独作用组;4~6:100 mg/L沙利度胺预处理6、12、24 h后LPS作用24 h。
图3 沙利度胺预处理不同时间点对HUVEC凋亡率的影响
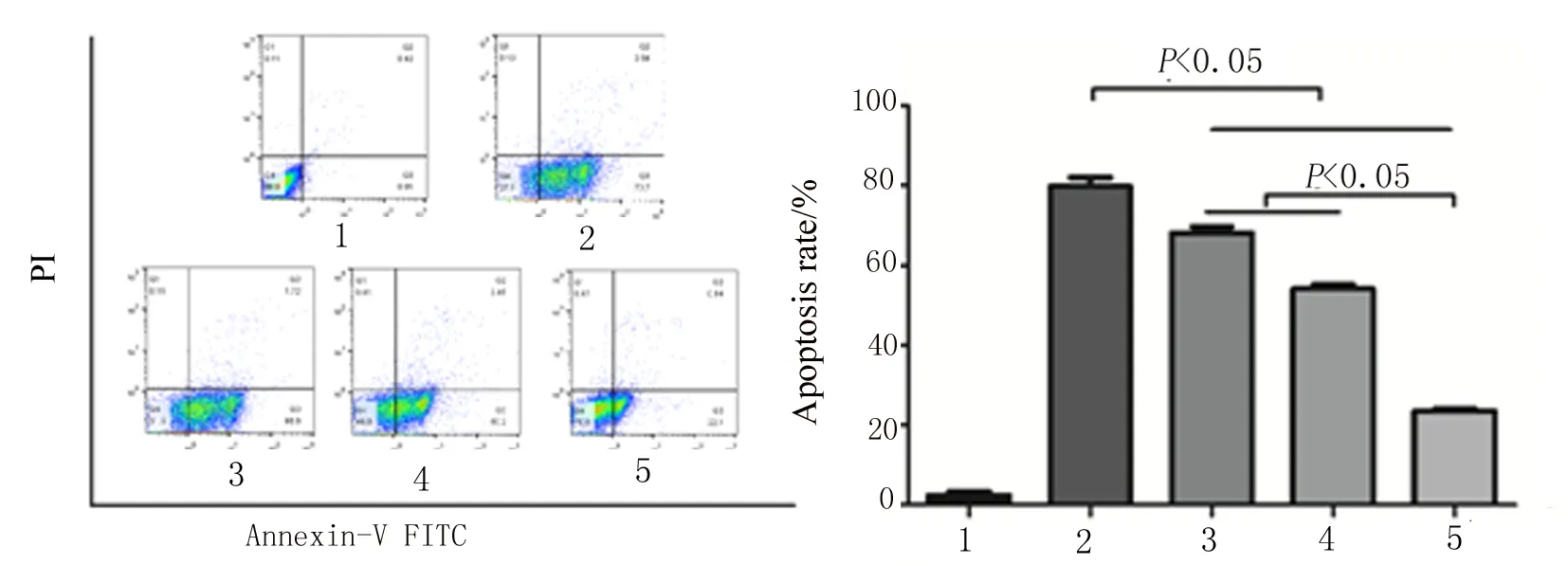
1:空白对照组;2:模型组;3~5:1、10、100 mg/L沙利度胺预处理6 h后LPS作用24 h。
图4 不同浓度沙利度胺保护作用的比较
4 讨论
在很多种疾病的发生发展过程中,氧化应激损伤都参与了其中的反应。血管内皮细胞在维持血管内环境稳定中起到重要的屏障作用,但是由于氧化应激反应的发生,首先受到损伤的便是内皮细胞,而氧化应激反应所产生的ROS是导致血管内皮细胞凋亡的主要因素[8-11]。而心血管疾病发生与发展的最主要原因便是炎症。有研究表明,动脉粥样硬化斑块的形成与凋亡的内皮细胞存在着很大的联系。故通过体外构建炎症模型来探讨炎症发生时内皮细胞的保护方法显得尤为重要。LPS是革兰阴性细菌外璧层中特有的一种化学成分,能够刺激体内多种细胞合成和释放众多内源性生物活性因子,导致全身性炎症反应发生,由此引起中毒性休克、全身炎症反应综合征和多器官功能障碍综合征[12-13],用于多种体外炎症模型的构建。而由于近年来沙利度胺在临床上的广泛应用,大家也把目光聚集在沙利度胺是否能够通过抑制炎症反应来减少氧化应激损伤时内皮细胞的损伤。故本研究希望用LPS构建体外炎症的模型来探讨沙利度胺的抗氧化应激的效果,但是由于各个实验室的药品、细胞培养条件等的差异,我们需要筛选出适合本实验室研究的模型条件。通过流式细胞术的结果显示,低浓度的LPS即可引起HUVEC的凋亡,但是并不能达到炎症模型的要求,最后发现在相同时间点0.25、0.5 mg/L LPS处理后的凋亡率基本没有改变,但是1 mg/L LPS在处理24 h后的凋亡率可以达到92%,另外在各个时间点2 mg/L LPS与1 mg/L LPS处理后的凋亡率基本相同。故最终确定LPS造模浓度为1 mg/L,时间为24 h。此外为了确定沙利度胺在发生炎症和氧化应激损伤时的保护作用,我们首先筛选了沙利度胺的无细胞毒性的浓度范围,确定其无细胞毒性浓度范围
为0~125 mg/L。此外我们还测定了沙利度胺的最佳预处理时间,100 mg/L沙利度胺分别预处理6、12、24 h后,再加入1 mg/L LPS处理24 h后测定其凋亡率,结果显示,预处理6、12、24 h之间的凋亡率没有明显变化,但是与模型组相比,凋亡率降低。之后我们又测定了不同浓度的沙利度胺对于LPS引起的氧化应激损伤的保护作用,发现随着沙利度胺浓度的提高,凋亡率下降,说明沙利度胺在氧化应激反应损伤中起到了保护作用,且与浓度呈正相关。
综上,我们确定了LPS体外炎症模型的建立和沙利度胺的预处理时间和浓度,为在炎症发生时寻求更好的保护方式提供了更好的思路,同时也为沙利度胺更好地服务于临床打下了理论基础。但是沙利度胺具体的保护机制还有待进一步的研究。
【参考文献】
[1] MITTLER R.Oxidative stress,antioxidants and stress tolerance[J].Trends in plant science,2002,7(9):405-410.
[2] OLINSKI R,GACKOWSKI D,FOKSINSKI M,etal.Oxidative DNA damage:Assessment of the role in carcinogenesis,atherosclerosis,and acquired imrnunodeficiency syndrome[J].Free Radical Biology and Medicine,2002,33(2):192-200.
[3] LI H,HORKE S,FORSTERMANN U.Vascular oxidative stress,nitric oxide and atherosclerosis[J].Atherosclerosis,2014,237(1):208-219.
[4] KATTOOR AJ,POTHINENI NVK,PALAGIR D,etal.Oxidative Stress in Atherosclerosis[J].Current atherosclerosis reports,2017,19(11):42.
[5] KIKUCHI K,TANCHAROEN S,TAKESHIGE N,etal.The efficacy of edaravone (radicut),a free radical scavenger,for cardiovascular disease[J].International journal of molecular sciences,2013,14(7):13909-13930.
[6] DING Z,LIU S,WANG X,etal.Hemodynamic shear stress via ROS modulates PCSK9 expression in human vascular endothelial and smooth muscle cells and along the mouse aorta[J].Antioxidants & redox signaling,2015,22(9):760-771.
[7] MERCURIO A,ADRIANI G,CATALANO A,etal.A mini-review on thalidomide:chemistry,mechanisms of action,therapeutic potential and anti-angiogenic properties in multiple myeloma[J].Current medicinal chemistry,2017,24(25):2736-2744.
[8] FU Y,HU X,CAO Y,etal.Saikosaponin a inhibits lipopolysaccharide-oxidative stress and inflammation in Human umbilical vein endothelial cells via preventing TLR4 translocation into lipid rafts[J].Free Radical Biology and Medicine,2015,89:777-785.
[9] MKKELSEN L,JENSEN KA,KOPONEN IK,etal.Cytotoxicity,oxidative stress and expression of adhesion molecules in human umbilical vein endothelial cells exposed to dust from paints with or without nanoparticles[J].Nanotoxicology,2013,7(2):117-134.
[10] PARK MH,HEO SJ,PARK PJ,etal.6,6′-bieckol isolated from Ecklonia cava protects oxidative stress through inhibiting expression of ROS and proinflammatory enzymes in high-glucose-induced human umbilical vein endothelial cells[J].Applied biochemistry and biotechnology,2014,174(2):632-643.
[11] FUREKAWA S,FUJITA T,SHIMABUKURO M,etal.Increased oxidative stress in obesity and its impact on metabolic syndrome[J].The Journal of clinical investigation,2017,114(12):1752-1761.
[12] KEAMEY CJ,CULLEN SP,TYNAN GA,etal.Necroptosis suppresses inflammation via termination of TNF-or LPS-induced cytokine and chemokine production[J].Cell Death & Differentiation,2015,22(8):1313-1327.
[13] JIANG W,LUO F,LU Q,etal.The protective effect of Trillin LPS-induced acute lung injury by the regulations of inflammation and oxidative state[J].Chemico-biological interactions,2016,243:127-134.
