临床分离铜绿假单胞菌耐药机制研究
2018-04-27邹自英
邹自英,刘 霞,刘 媛
铜绿假单胞菌是医院感染性疾病中最常见的非发酵型细菌之一,碳青酶烯类耐药的铜绿假单胞菌具有多种耐药机制[1-6],其中产生金属酶和形成被膜结构是其主要的两种耐药机制。为探讨医院铜绿假单胞菌临床菌株的耐药机制,本研究对医院临床分离的89株铜绿假单胞菌进行金属酶基因检测和生物被膜形成能力研究。
1 材料与方法
1.1 实验材料
1.1.1 菌株来源 89株铜绿假单胞菌均为2016年5~11月从医院临床送检标本中分离得到,其中来自痰液41株,伤口12株,血液9株,尿液7株,脓液6株,胸水5株,胆汁3株,腹水2株,玻璃体液1株,关节液1株,引流液1株,支气管灌洗液1株。标准菌株ATCC27853购自中国工业菌种保藏所,采用贝索公司的菌种冻存管-80℃留存。
1.1.2 仪器及试剂 法国梅里埃公司的VITEK2 COMPACT仪器、GN鉴定卡、AST-GN13药敏卡,美国伯乐公司的PCR仪,上海天呈公司的TOCAN凝胶成像系统。
1.2 方法
1.2.1 抗菌药物敏感性试验 采用AST-GN13卡检测各抗菌药物的敏感性,结果评价按2017年CLSIM100-S27 判断[7]。
1.2.2 基因检测 采用PCR方法检测各种金属酶基因,基因引物由北京六合华大基因科技有限公司合成,序列见表1。基因提取方法及PCR反应条件参照文献[1]。
1.2.3 细菌生物膜半定量检测 采用半定量结晶紫染色法,参照文献[5-6]的方法。对数期菌液用M-H培养液调节浓度为1×109CFU/ml,200μl/孔接种96孔板,每株菌设3复孔,37℃培养32 h。200μl/孔PBS 清洗 4 次,50 μl/孔 Bouin’S 固定液固定 1 h;200μl/孔 PBS再清洗 4次,50μl/孔结晶紫染色2min;自来水轻柔冲洗,自然晾干,200μl/孔95%乙醇脱色,检测OD550。生物膜产生量评价标准:M-H培养液孔的平均OD550加标准差定义为ODc,待测菌株的OD与ODc比较,将生物膜产生量分为4个等级:阴性(-):OD<0Dc;少量(+):0Dc<OD≤20Dc;中量(++):20Dc<OD≤40Dc;大量:OD>40Dc。
1.3 统计学方法 应用WHONET5.6软件进行统计学分析。
2 结果
2.1 抗菌药物敏感性试验结果 铜绿假单胞菌对各种抗菌药物的敏感性见表2,其中对碳青酶烯类抗菌药物亚胺培南的敏感率为73.03%,耐药率和中介率分别为17.98%和8.99%。
2.2 金属酶基因检测结果 89株铜绿假单胞菌均未检出 NDM-1、IMP、VIM、SPM、GIM、SIM、DIM、TMB、KHM、AIM金属酶基因。
2.3 产生物被膜菌株分布 92.13%的铜绿假单胞产生物被膜,大部分菌株产生中量或大量生物被膜,见表3。
3 讨论
碳青酶烯类耐药的铜绿假单胞菌治疗是目前临床感染性疾病治疗的难点之一,具有治疗周期长、不易根除、易反复等特点。既往研究提示,产金属酶是铜绿假单胞菌对碳青酶烯类抗菌药物耐药的重要因素[8-9]。编码金属酶的基因位于质粒或染色体上,使得金属酶基因容易在同种属及不同种属细菌间发生大范围扩散和传播,如金属酶基因中的NDM-1基因,在多种不同种属的细菌中都能检测到[8-10]。本组89株铜绿假单胞菌耐药率和中介率分别为17.98%和8.99%,但均未检出NDM-1、IMP、VIM、SPM、GIM、SIM、DIM、TMB、KHM、AIM 金属酶基因,提示携带金属酶基因不是本组铜绿假单胞菌对碳青酶烯类抗菌药物耐药的主要原因。

表1 靶基因引物序列
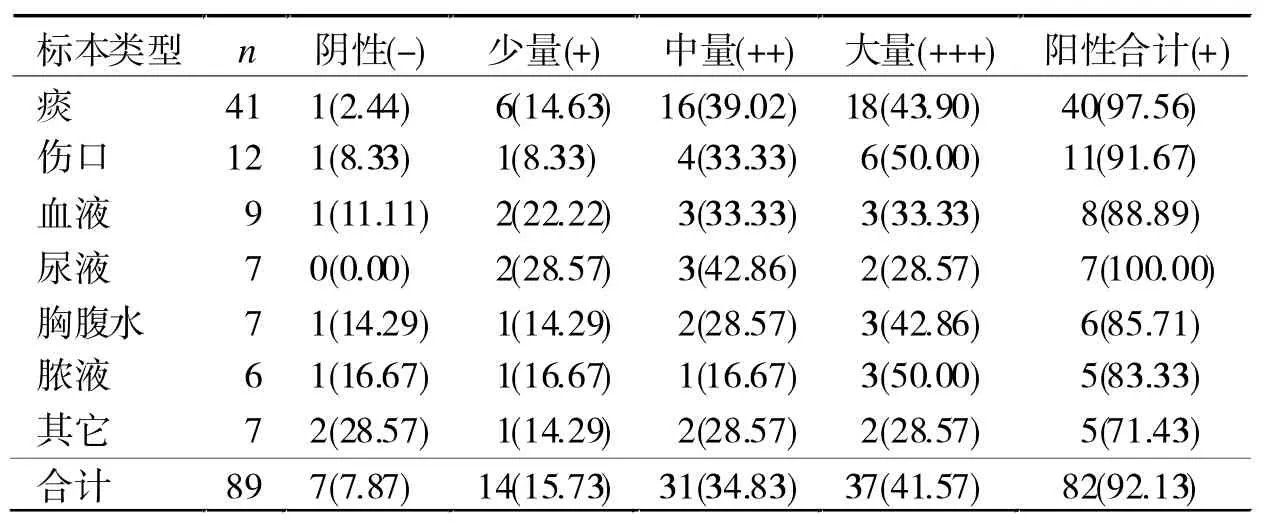
表3 铜绿假单胞菌产生物被膜能力[n(%)]
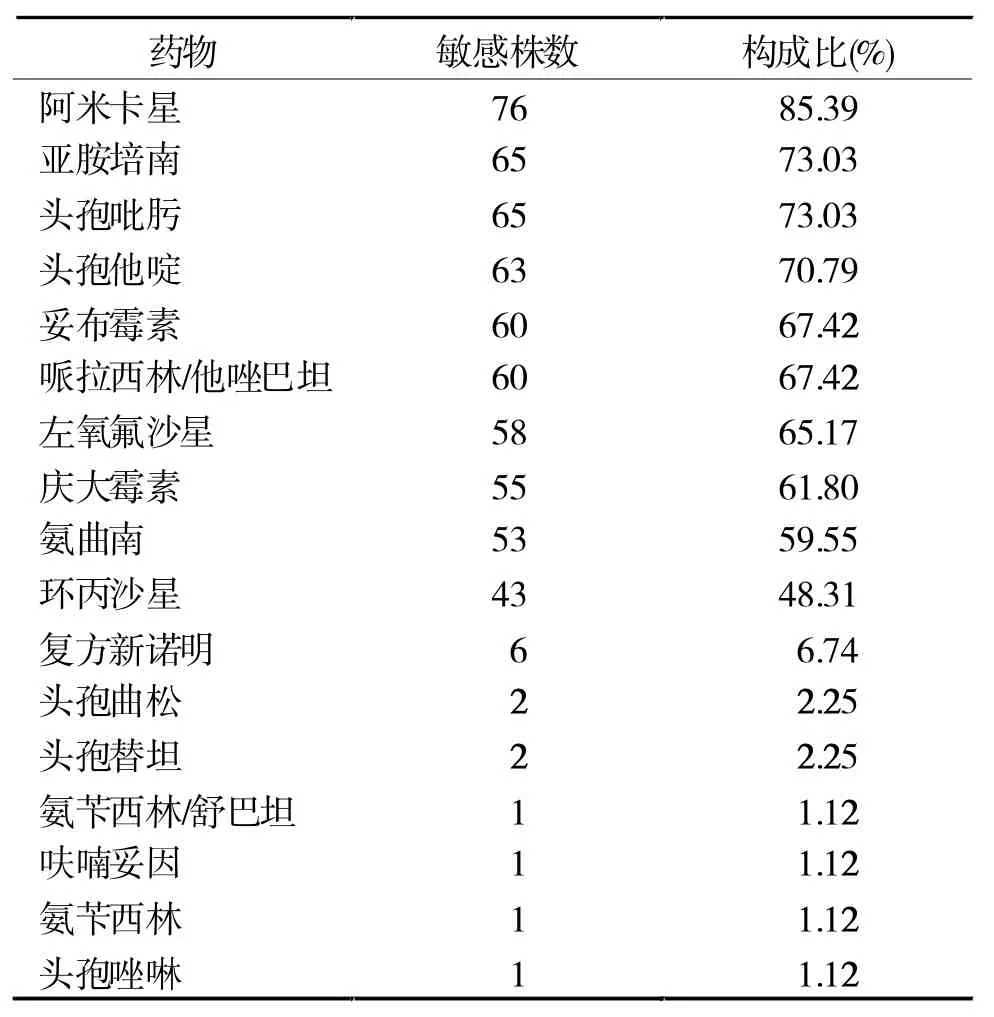
表2 铜绿假单胞菌对抗菌药物的敏感性构成比(n=89)
被膜铜绿假单胞菌的最小抑菌浓度(MIC)显著升高,文献报道甚至可以高于浮游菌MIC值的1000倍[5-6]。铜绿假单胞菌被膜菌持久存活于气道、皮肤、植入体表面等部位,常规抗感染治疗可以消灭浮游菌及表层细菌,却对深部被膜菌疗效欠佳。而被膜结构可释放其深层细菌,造成感染迁延反复,只有清除掉深部被膜菌,才能彻底治愈感染。本研究89株铜绿假单胞菌中,92.13%具有产生被膜结构能力,与文献报道近似[6],说明铜绿假单胞菌临床菌株普遍产生物被膜能力强,在条件合适的情况下大部分菌株均可在体内形成被膜结构,使得抗感染治疗难度增加,这可能是该菌耐药的主要机制。因此,在治疗铜绿假单胞菌感染性疾病过程中,可以选择敏感抗菌药物与阿奇霉素等具有穿透生物被膜及抑制被膜菌形成功能的抗菌药物联用,进而取得较好的临床疗效[11-12]。
铜绿假单胞菌的耐药原因复杂,而本组菌株的主要耐药原因之一是在体内形成被膜结构。为使得检测结果更具针对性,应在报告检测结果时,对临床提示是否为黏液型菌株生长;在临床治疗有需求时,配合检测细菌的生物被膜产生能力,便于临床有针对性地选择抗菌药物联合使用。
【参考文献】
[1]邹自英,陈勇,张孟强,等.临床分离病原菌NDM-1基因的筛查[J].中国卫生检验杂志,2015,25(17):2940-2942.
[2]李代昆,李具琼,余雪梅,等.黏液型铜绿假单胞菌临床分布与耐药性分析[J].中华医院感染学杂志,2017,27(12):2645-2648.
[3]杨德青,倪文涛,江学维,等.联合用药治疗耐碳青酶烯铜绿假单胞菌的研究进展[J].中国药学杂志.2017,52(14):1208-1211.
[4]王詝,孙珊.某大型教学医院2013-2015年铜绿假单胞菌的耐药性监测[J].中国抗生素杂志, 2017,42(7):586-591.
[5]Zhang L,Fritsch M,Hammond L,et al.Identification of genes involved in Pseudomonas aeruginosa biofilm-specific resistance to antibiotics[J].PLos One,2013,8(4):e61625.
[6]Taylor PK,Van Kessel ATM,Colavita A,et al.A novel small RNA is important for biofilm formation and pathogenicity in Pseudomonas aeruginosa[J].PLos One,2017,12(8):e0182582
[7]Performance standards for antimicrobial susceptibility testing.Twenty-seventh informational supplement[S].CLSI documents M100-S27,CLSI,2017.
[8]Fallah F,Borhan RS,Hashemi A.Detection of bla (IMP)and bla(VIM) metallo-β-lactamases genes among Pseudomonas aeruginosa strains[J].Int JBurns Trauma,2013,3(2):122-124.
[9]陈华彬,王冬国,王红戟,等.多药耐药铜绿假单胞菌耐药基因的研究[J].中华医院感染学杂志,2013,23(3):488-491.
[10]Yang JY,Chen Y,Jia X,et al.Dissemination and characterization of NDM-1 producing Acinetobacter pittii in an intensive careunit in China[J].Epidemiol,2012,18(12):506-513.
[11]李琬琛,魏殿军,李立艳,等.铜绿假单胞菌lasI/lasR群体感应系统与生物膜形成相关基因表达调控的研究[J].中华医院感染学杂志,2012,22(17):3685-3687.
[12]李俊娟,王强,孙开宇,等.铜绿假单胞菌生物膜与亚抑菌浓度抗菌药物的相关研究[J].中华医院感染学杂志,2012,22(24):5437-5440.
