慢性肾脏病患者维持性血液透析前后凝血功能变化及其临床意义
2018-04-27赵赟杨向东
赵赟 杨向东
1.山东大学医学院,济南 250000;2.山东大学齐鲁医院肾内科,济南 250000
慢性肾脏病(Chronic kidney disease,CKD)伴发心血管病患病率高[1]。作为一种肾脏替代治疗方式,维持性血液透析可通过体外循减轻肾脏负担,避免病情进展与肾功能持续性恶化,而在血液透析期间,为维持良好的循环状态、预防血栓性疾病、减少炎症反应,绝大多数情况下需应用抗凝剂,但抗凝剂用量不足或超量可能引发患者血栓形成或出血风险上升[2]。因此,了解CKD患者维持性血液透析前后凝血功能变化特点,对于指导抗凝剂的精确调整有着重要意义。为此,本研究选取83例CKD患者及60名健康体检者进行了前瞻性分析。
1 对象与方法
1.1 研究对象
选取我院2016年2月至2017年2月83例接受维持性血液透析CKD患者,纳入观察组,患者均经临床及病理检查,参照2006年美国CKD及透析临床实践指南明确诊断[3],排除合并肝脏疾病者以及血液系统疾病者。CKD患者每次透析时间4 h,每周透析3次,透析参数:血流量180~300 mL/min,透析流量500 mL/min。每次透析前静脉推注3000 IU低分子肝素,透析期间以1000 IU/h持续泵入低分子肝素,透析结束前2 h停止泵入[4]。同时选取60名健康体检者,纳入对照组。观察组男47例,女36例,年龄28~71岁,平均(45.58±9.62)岁;对照组男35名,女25名,年龄26~73岁,平均(46.05±9.71)岁。两组受试者年龄、性别比例比较,差异无统计学意义(P>0.05),具有可比性。本研究已征得我院医学伦理委员会批准,受试者均知情同意并签署同意书。
1.2 检查指标
分别于观察组患者透析前、透析后,以及对照组受试者入组次日,抽取其晨起空腹肘静脉血5 mL,置于枸橼酸钠抗凝管中,以3000 r/min离心,留取血浆,使用ACL-9000全自动血凝分析仪(美国Beckman Coulter公司)以及7150型全自动生化分析仪(日本日立公司)对其常规凝血指标、凝血因子进行检测[5]。其中,常规凝血指标包括凝血酶原时间(PT)、活化部分凝血酶原时间(APTT)、凝血酶时间(TT)、纤维蛋白原(FIB)、D-二聚体(DD)及血小板计数(PLT);凝血因子包括FV:C、FⅦ:C、FⅧ:C、FX:C 及 FⅪ :C。
1.3 统计学方法
对本临床研究的所有数据采用SPSS 22.0进行分析,性别以(n)表示,采用χ2检验,年龄、常规凝血指标、凝血因子等计量资料以(x±s)表示,组间比较及组内比较均采用t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 常规凝血指标
观察组透析前后PT、FIB均高于对照组,其PLT均低于后者(P<0.05);与透析前相比,观察组透析后PT、DD下降,TT上升,差异有统计学意义(P<0.05)。见表1。
2.2 凝血因子
观察组透析前后 FⅦ :C、FⅧ :C、FX:C、FⅪ :C 均高于对照组(P<0.05);与透析前相比,观察组透析后FⅦ :C、FⅧ :C、FX:C 上升,差异有统计学意义(P < 0.05)。见表2。
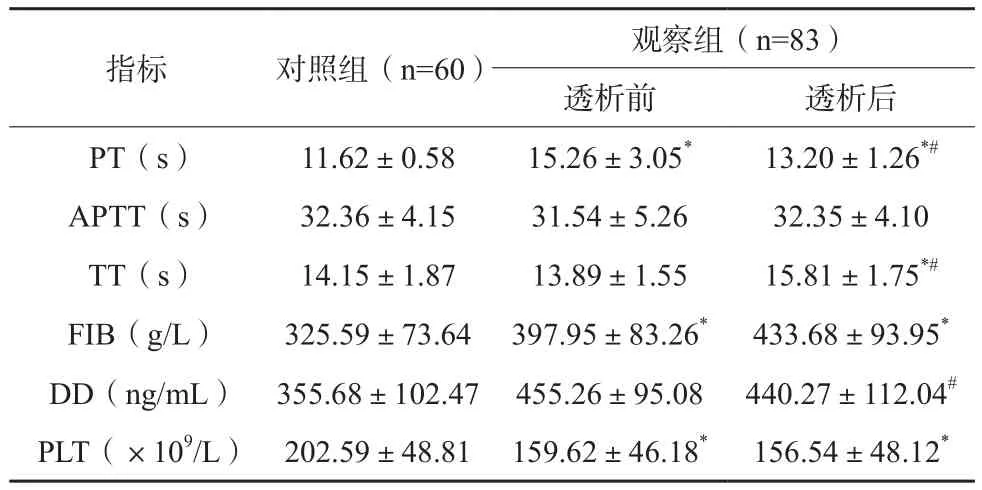
表1 两组受试者常规凝血指标比较(x±s)
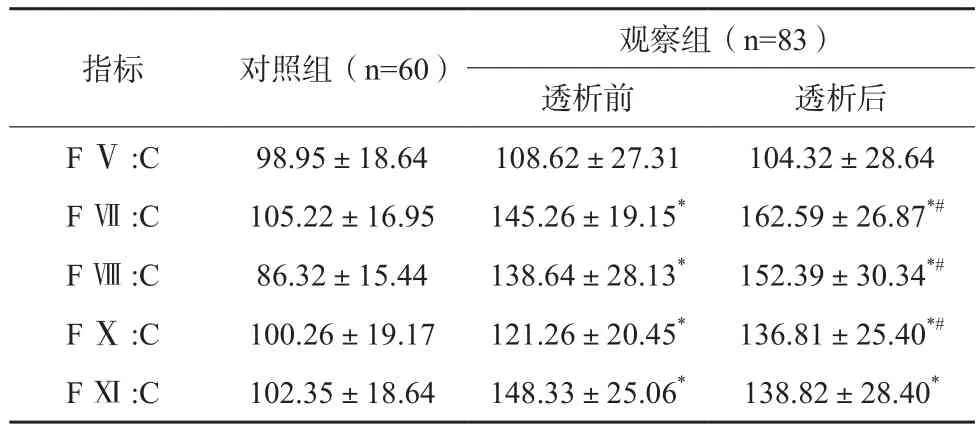
表2 两组受试者凝血因子比较(x±s)
3 讨论
血液净化技术的持续发展使CKD患者生存时间得以明显延长,但维持性血液透析患者并发症发生率以及死亡率仍处于较高水平,多数学者认为,这一现状的产生原因与CKD患者的高凝状态有关[6-7]。肾脏血流量减少、血液瘀滞、组织缺血缺氧、血小板激活、血管内皮损伤等病理因素均被认为是引发CKD患者高凝状态的主要原因[8]。
此次研究就CKD患者维持性血液透析前后凝血功能的变化进行了检测,结果显示,患者透析前循环中血液即处于高凝状态,并表现为PT延长、FIB升高与PLT下降,其机制可能为:1)机体内抗凝物质伴随着大量蛋白尿流失,此时低蛋白血症刺激肝脏代偿性合成凝血因子,从而引发凝血、纤溶系统及血小板功能紊乱,导致循环及肾脏局部血液高凝[9];2)血液循环高凝状态往往伴随着肾小球内凝血亢进,这一病理生理改变一方面可造成毛细血管内血栓形成、肾组织缺血,另一方面也可促使肾组织固有细胞增殖、炎症细胞浸润及细胞外基质积聚,进而引发并加剧蛋白尿、肾功能减退、肾小球硬化,形成恶性循环[10-11]。有学者对不同临床分期CKD患者凝血功能进行了检测,结果显示,早期CKD患者已存在明显凝血功能异常,随着CKD分期增加,患者促凝物质水平逐渐升高,且抗凝血因子减少程度与肾功能恶化程度具有正相关性,说明CKD患者的潜在血流动力学紊乱状态,以及较高的静脉血栓、高凝甚至心血管疾病发生风险[12]。
通过透析前后凝血功能的检测,可以发现,虽然CKD患者血液透析治疗后PT有所下降,但仍高于对照组,且其DD明显下降、TT显著延长,说明维持性血液透析不仅未能纠正患者凝血、纤溶紊乱状态,还造成继发性纤溶风险上升甚至出现血栓前凝血状态[13],原因与透析过程中血液与透析膜的直接接触所引发的内源性及外源性凝血途径同时激活有关[14],因此本研究观察组透析后FⅦ:C、FⅧ:C、FX:C上升。此外,上述凝血因子激活至FIB被凝血酶酶解为纤维蛋白单体的过程亦可反映内源、外源凝血的共同途径激活,此时与凝血酶有高亲和力的纤维蛋白可诱导局部血凝块形成,甚至因血凝块形成过度引发广泛性血栓栓塞[15-16]。因此,可以认为,维持性血液透析可造成CKD患者血栓形成倾向加剧,使患者同时面临出血性疾病与血栓性疾病的双重威胁。
近年来,临床愈发注重CKD患者维持性血液透析期间凝血功能的监测,且有研究指出,抗凝方案不当、肝素用量不足、血液高凝状态、高脂饮食等因素均可增加患者透析后凝血发生风险[17-18]。首先应注重CKD患者维持性血液透析期间凝血功能的监测,针对其凝血功能变化调整抗凝与透析方案,其次,需早期评估患者出血、血栓风险因素,识别高危患者并予以预防性干预,以期尽可能减少血液透析期间并发症发生风险,在保证血液透析效果的同时,提高治疗安全性。
[1] ZHANG Y, MEI C L, RONG S, et al. Effect of the combination of hemodialysis and hemoperfusion on clearing advanced glycation end products: a prospective, randomized, two-stage crossover trial in patients under maintenance hemodialysis[J].Blood Purif, 2015, 40(2): 127-132.
[2] YE M, LIU Y, ZHOU L, et al. Spontaneous Left Renal Subcapsular Hematoma and Right Hip Hematoma in a Hemodialysis Patient: A Case Report and Review of the Literature[J]. Blood Purif, 2016, 42(2): 100-103.
[3] CHEN Y, ABBATE M, TANG L, et al. L-Carnitine supplementation for adults with end-stage kidney disease requiring maintenance hemodialysis: a systematic review and meta-analysis[J]. Am J Clin Nutr, 2014, 99(2): 408-422.
[4] 陈江华, 何强, 徐莹. 维持性血液透析患者微炎症状态的认识与防治[J]. 中华肾脏病杂志, 2005, 21(2):117-118.
[5] NWEKE C, MARTIN E, GEHR T, et al. Differences in coagulation in clotting of vascular access in hemodialysis patients[J]. Hemodial Int, 2015, 19(2): 323-329.
[6] ZAGHLOUL A, BUKHARI T, BAJUAIFER N, et al.Thrombosis in Hemodialysis Patients; Their Association with Tissue Factor and Tissue Factor Pathway Inhibitor[J]. Intern Med, 2015, 5(183): 2.
[7] 郭晓青.维持性血液透析患者透析期间心律失常的临床分析[J].中华保健医学杂志,2009,11(3):219-221.
[8] WAGNER S, APETRII M, MASSY Z A, et al. Oxidized LDL, statin use, morbidity, and mortality in patients receiving maintenance hemodialysis[J]. Free Radic Res, 2017, 51(1): 14-23.
[9] FADEL F I, ELSHAMAA M F, ABDEL-RAHMAN S M, et al.Coagulation, thrombophilia and patency of arteriovenous fi stula in children undergoing haemodialysis compared with healthy volunteers: a prospective analysis[J]. Blood Coagul Fibrinolysis,2016, 27(2): 190-198.
[10] 孙雪峰. 血液透析过程中抗凝治疗的并发症[J]. 中国血液净化,2007, 6(8):444-445.
[11] YUZHE H, KAMIJO Y, HASHIMOTO K, et al. Serum sulfatide abnormality is associated with increased oxidative stress in hemodialysis patients[J]. Hemodial Int, 2015, 19(3):429-438.
[12] MA L, XIA C, SUN X, et al. The effects of oral acetylsalicylic acid on blood fl uidity and infusion speed in the cancer patients with PICC[J]. Clin Hemorheol Microcirc, 2017, 65(1): 11-22.
[13] MARSEN T A, BEER J, MANN H, et al. Intradialytic parenteral nutrition in maintenance hemodialysis patients suffering from protein-energy wasting. Results of a multicenter,open, prospective, randomized trial[J]. Clin Nutr, 2017, 36(1):107-117.
[14] 李克鹏. 重症合并急性肾损伤患者血液透析早期滤器凝血相关因素的研究[J]. 中国急救医学, 2016, 36(5):434-438.
[15] GUBENSEK J, LOLIC M, PONIKVAR R, et al. D-dimer levels in maintenance hemodialysis patients: High prevalence of positive values also in the group without predisposing diseases[J]. Hemodial Int, 2016, 20(2): 198-203.
[16] LI L, CUI T L, LI X, et al. Transjugular Intrahepatic Portosystemic Shunt Combined with Haemoperfusion in an End-stage Renal Disease Patient with Liver Cirrhosis-related Refractory Portal Hypertensive Variceal Bleeding: A Case Report[J]. West Indian Med J, 2015, 64(4): 452.
[17] BROPHY D F, CARL D E, MOHAMMED B M, et al.Differences in coagulation between hemodialysis and peritoneal dialysis[J]. Perit Dial Int, 2014, 34(1): 33-40.
[18] PASCH A, BLOCK G A, BACHTLER M, et al. Blood calcif i cation propensity, cardiovascular events, and survival in patients receiving hemodialysis in the EVOLVE Trial[J]. Clin J Am Soc Nephrol, 2017, 12(2): 315-322.
