山奈酚-铜配合物的合成、表征及其抗氧化活性的研究
2018-04-25臧永军陈乃富陈存武陈乃东韩邦兴
臧永军,陈乃富,陈存武,陈乃东,韩邦兴
(1.皖西学院,生物与制药工程学院,安徽六安 237012;2.皖西学院,中药研究与开发工程技术研究中心,安徽六安 237012)
黄酮类化合物因具有较强的抗氧化活性而备受关注,它能够直接清除体内自由基、抑制产生自由基的酶、螯合金属离子、促进抗氧化因子再生和抗氧化酶的水平,是一种良好的天然抗氧化剂[1]。山奈酚作为一种常见的黄酮类化合物,广泛存在于水果、蔬菜及中药材中[2],近些年来研究表明,山奈酚具有抗氧化、抗癌、抗炎等多种的生物活性[3-4],在食品及医药保健方面具有较大的开发价值[5]。
山奈酚分子中具有超离域度和大π键共轭体系,分子中的羰基氧和羟基可与多种金属离子发生强烈的配位作用[6]。通过制备金属离子配合物以期提高其生物活性,改善其理化性质,增加其在体内的生物利用度是近些年研究的热点[7]。大量研究表明将黄酮类化合物与人体必需金属元素做成配合物,具有增加其抗活性氧自由基的协同作用[8],如槲皮素分别与锌、铜、镁等金属离子形成的配合物在抗氧化活性上均优于槲皮素[9-11],芦丁与桑色素分别与铬配合后,配合物清除自由基的能力均强于其配体[12-13],而目前关于山奈酚金属配合物的活性研究的报道还很匮乏。
鉴于山奈酚的相关药理活性,为进一步研究其的生物活性、探索其在功能性食品及药品研发方面的应用,本文利用山奈酚与人体必需的微量元素铜进行配合,制得山奈酚-铜(Ⅱ)配合物,并研究其在体外清除自由基的活性,为山奈酚的金属配合物研究提供参考。
1 材料与方法
1.1 材料与仪器
山奈酚 99%,批号:Lot #H1519037,上海阿拉丁生化科技股份有限公司;二苯基苦基肼(DPPH·) 96%,批号:Lot#K1629061,上海阿拉丁生化科技股份有限公司;二水合氯化铜、氢氧化钠、乙醇 均为分析纯。
TU-1901型紫外可见光分光光度计 北京普析通用仪器设备有限公司;iS50 FT-IR傅里叶变换红外光谱仪 美国尼高力公司;DF-19s集热式磁力加热搅拌器 金坛市岸头国瑞实验仪器厂;PHS-3S型酸度计 萧山市分析仪器厂;FA1004A电子天平 上海精天电子仪器有限公司;Q2000 DSC 差示扫描量热仪 美国TA公司;AVANCEII超导核磁共振仪(400 MHz) 德国Bruker公司。
1.2 实验方法
1.2.1 配合物的合成 参考文献[6,14]方法,取0.28 g(1.0 mmol)山奈酚加入50 mL圆底烧瓶中,加10 mL的无水乙醇搅拌至溶解,再加适量氢氧化钠,调反应液的pH为8~10。另称取0.17 g(1.0 mmol)二水合氯化铜溶解在5 mL乙醇溶液中,将氯化铜溶液慢慢滴加到山奈酚溶液中,溶液逐渐浑浊,室温搅拌5 h,过滤,滤饼分别用无水乙醇和水洗涤两次。45 ℃真空干燥12 h,得到浅绿色固体粉末,置于干燥器中储藏备用。
1.2.2 紫外光谱分析 称取山奈酚3.6 mg,配合物4.7 mg,分别用无水乙醇溶解并定容到50 mL容量瓶中,检测之前再稀释20倍,用无水乙醇溶液作参比,在200~500 nm范围扫描样品溶液的紫外可见吸收光谱。
1.2.3 红外光谱分析 分别取山奈酚和配合物少许,加入100倍的干燥溴化钾,在玛瑙乳钵研磨均匀,将混合粉末转移到模具中,在压片机中压成薄片后放入样品室,用傅里叶变换红外光谱仪在4000~500 cm-1区间范围内扫描。
1.2.4 核磁共振分析 溶剂DMSO-d6,四甲基硅烷(TMS)为内标,测定温度303 K,测定频率为400 MHz,对样品进行氢谱扫描。
1.2.5 差热-热重分析 在静态空气气氛中,升温速度为10 ℃/min,测定范围为50~800 ℃条件下,对配合物进行差热-热重分析。
1.2.6 DPPH法抗氧化活性测试 准确称取1 mg DPPH,用适量无水乙醇溶解后,转入25 mL容量瓶中,用无水乙醇定容至刻度,轻摇混匀,配制成1×10-4mol/L DPPH溶液,低温避光保存备用。以无水乙醇为溶剂,分别配制浓度为1.0×10-4、1.5×10-4、2.0×10-4、2.5×10-4、3.0×10-4、3.5×10-4mol/L的待测样品溶液。参照文献[9]方法,稍有改进,量取2 mL DPPH溶液,分别与2 mL不同浓度的样品溶液混合,避光37 ℃放置30 min,在519 nm处测吸光度As。DPPH自由基清除率P计算如下:
P(%)=[1-(As-Ay)/A0]×100
式中,Ay为2 mL样品溶液与2 mL乙醇混匀后的吸光度;A0为2 mL乙醇溶液与2 mL DPPH溶液混匀后的吸光度;As为2 mL不同浓度样品溶液与2 mL DPPH溶液混匀后的吸光度。
1.3 数据统计分析
以上实验均平行3次,采用Origin 8.0、SPSS 20分析软件对实验数据进行分析、处理,采用Chemdraw 12.0软件绘制化学结构。
2 结果与讨论
2.1 山奈酚-铜金属化合物的表征
2.1.1 紫外吸收光谱 山奈酚及配合物的紫外光谱如图1所示,山奈酚和配合物均有2个强吸收带,其中山奈酚的长波区带Ⅱ373 nm,为肉桂酰基产生,属于π→π*电子跃迁;短波区带Ⅰ272 nm,由苯甲酰基产生,属于n→π*电子跃迁。而山奈酚-铜配合物的2个主要吸收带分别是带Ⅰ280 nm,带Ⅱ423 nm。对比配体和配合物的2个吸收带来看,配合物吸收带均发生红移,且吸收强度随之下降。这是因为Cu2+与配体中3-OH和4-C=O形成新环,整个分子的共轭体系增长,电子的离域程度增加,致使电子跃迁时所需的能量降低,故吸收峰红移[15]。
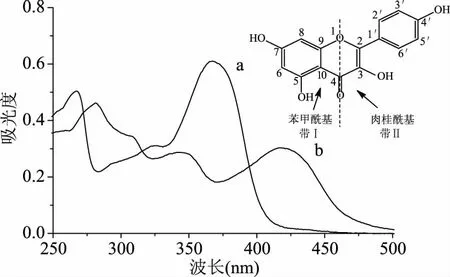
图1 山奈酚(a)和山奈酚-铜配合物(b)的UV-Vis 光谱Fig.1 The UV-Vis spectroscopy of kaempferol(a)and its complex(b)
2.1.2 红外光谱 山奈酚及配合物的红外光谱扫描结果如图2所示,其代表性基团迁移见表1。结果显示山奈酚-铜配合物和山奈酚红外图谱相似,但吸收频率均发生红移。其中山奈酚的羰基(C=O)频率1657 cm-1,形成铜配合物后红移至1625 cm-1,这是由于山奈酚的C=O与Cu2+发生了配位,电子向氧原子移动,C=O电子云密度降低,故C=O伸缩振动向低频移动[16]。
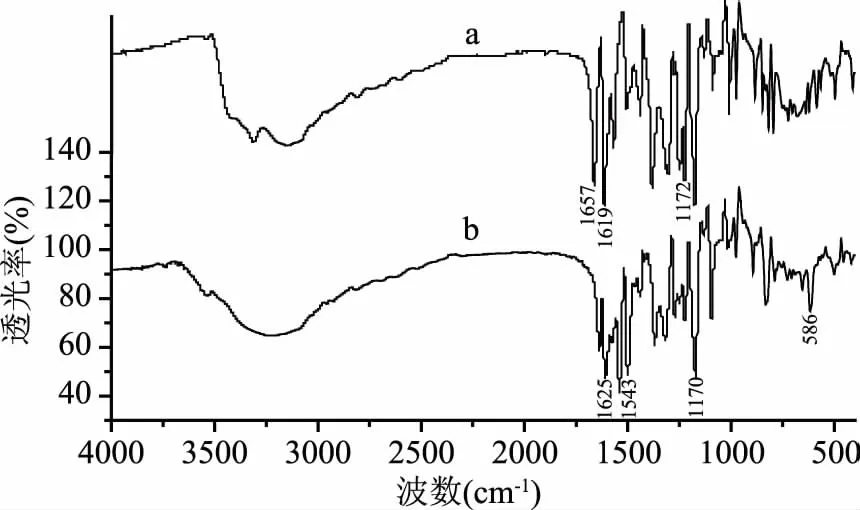
图2 山奈酚(a)和山奈酚-铜配合物(b)的红外光谱Fig.2 IR spectrum of kaempferol(a)and its complex(b)

基团C=OC=CC-O-CO-M山奈酚165716191172-配合物162515431170586
由于配合物形成了新环,增加了共轭效应,因此苯环π键(C=C)由1619 cm-1下降到配合物的1543 cm-1,红移了76 cm-1;配体中的 C-O-C 形成配合物前后位置变化不大,表明它并未与金属离子发生作用[6]。配合物在586 cm-1出现振动,为O-Cu键的特征峰,而该吸收峰在山奈酚的红外波谱图中没有出现,再次证明Cu2+与配体发生了螯合[17]。
2.1.3 核磁共振氢谱分析 分别测得山奈酚和配合物的核磁共振氢谱,参考文献[18],进行归位,如表2。对比山奈酚及其配合物的核磁共振氢谱数据可得,配合物的化学位移均向高场移动,这是因为配合物的形成增加了整个分子的平面性和分子的共轭效果,且配合物中3-OH信号消失,说明此处H被Cu取代。结果与上述紫外及红外光谱一致,进一步说明Cu2+是通过与山奈酚3-OH和4-C=O的氧原子行成配合物的。

表2 山奈酚和山奈酚-铜核磁共振氢谱数据Table 2 1H NMR data of kaempferol and kaempferol-Cu
2.1.4 差热-热重分析 绘制其热重-差热-微商热重分析(TG-DTA-DTG)曲线图,见图3。由TG-DTA-DTG曲线可见,在55~242 ℃,TG曲线有个失重台阶,失重率为12.02%,对应于DTA上112 ℃出现一个小的吸热峰,是由于配合物失去结晶水所致,推测结晶水分子数为3(理论失重率为12.28%);从300 ℃开始,配合物的分子结构逐渐被破坏而引起分解,500 ℃以后,曲线趋于平稳,推测山奈酚-铜分解完全,最后剩余19.98%(CuO理论值为18.07%)为少量C和CuO的质量,推断配体和铜的分子数均为1。

图3 山奈酚铜配合物的TG-DTA-DTG 曲线Fig.3 The TG-DTA-DTG curves of kaempferol-Cu
结合以上紫外光谱、红外光谱、核磁共振氢谱及差热-热重的分析的数据,可以推测出合成的山奈酚铜配合物结构为:

图4 山奈酚-铜的结构Fig.4 The chemical structure of kaempferol-Cu
2.2 山奈酚及山奈酚-铜配合物对 DPPH自由基的作用
实验结果见图5,分别为山奈酚和配合物在6种梯度浓度下对DPPH·的清除作用的分布图。由图5可见山奈酚和配合物在浓度2.0×10-4mol/L前,均是随着浓度的增大,对DPPH·的清除率呈明显上升趋势,且配合物对DPPH·的清除能力显著高于山奈酚(p<0.05),清除DPPH·半抑制浓度(IC50)分别为1.63×10-4、1.51×10-4mol/L。当被测样品浓度超过2.0×10-4mol/L后,二者清除率逐渐相近,无显著差异(p>0.05),且曲线趋于平缓,说明对DPPH·的清除已达到饱和。总体来看,形成配合物后对DPPH自由基的清除能力较配体有所提高。

图5 山奈酚及山奈酚配合物对DPPH·的消除率Fig.5 Scavenging activities of kaempferol and kaempferol -Cu complex on DPPH radical注:不同小写字母表示相同浓度下,不同样品间差异显著(p<0.05)。
这可能是因为山奈酚的多酚结构特性决定的,其抗氧化作用中是通过酚羟基与自由基反应[19]。酚羟基捕获DPPH·的电子,并提供H原子给DPPH,使其生成稳定的DPPHH,而自身产生一种新的酚基自由基,此基团通过芳香核的自旋作用以及形成分子内氢键被稳定下来,使自由基氧化链式传播过程被中断,起到了清除外在自由基的作用。因此,山奈酚清除自由基活性的高低与酚基自由基的稳定性密切相关[11,20]。如图6,形成配合物后,金属离子能提高酚基自由基稳定性,从而增强了山奈酚的抗氧化活性。此外,山奈酚中4位C=O与Cu形成配合物后,分子的电子云分布离域,也同样使配合物形成的酚基自由基更加稳定,因而配合物抗DPPH·的作用高于配体[21]。
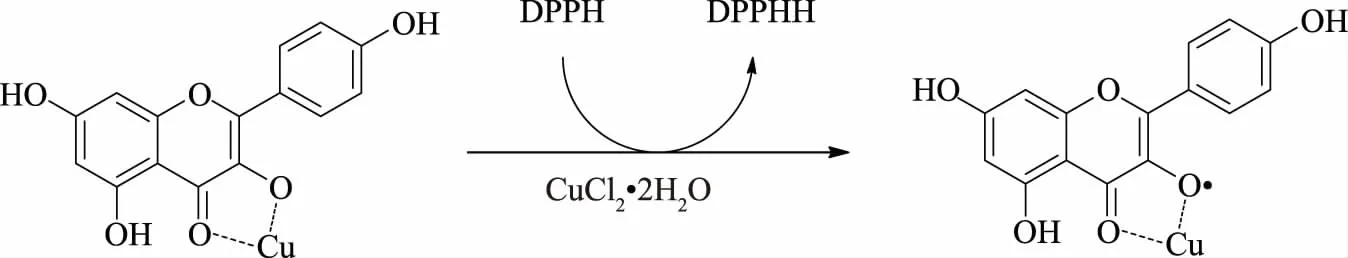
图6 山奈酚铜配合物清除DPPH自由基的机制Fig.6 The mechanism of kaempferol-Cu complex for scavenging DPPH radical
3 结论
本文合成了山奈酚-铜配合物,通过紫外、红外、核磁共振氢谱等分析手段,对其结构进行了表征。结果表明,山奈酚是通过分子中羰基(4位)和羟基(3位)与Cu2+发生螯合。体外清除自由基实验表明,山奈酚和山奈酚-铜配合物都具有清除自由基的能力,并且都具有一定的剂量依赖性,且山奈酚-铜配合物清除自由基的能力强于山奈酚。目前关于山奈酚金属配合物抗氧化性的报道还比较少,本文为山奈酚金属配合物的开发研究提供参考。
[1]任红,郑少杰,张小利,等. 基于不同抗氧化机制的黄酮类化合物构效关系研究进展[J]. 食品工业科技,2016,2:384-388.
[2]Calderon-Montano J M,Burgos-Moron E,Perez-Guerrero C,et al. A review on the dietary flavonoid kaempferol[J]. Mini Rev Med Chem,2011,11:298-344.
[3]张雅雯,邵东燕,师俊玲,等. 山奈酚生物功能研究进展[J]. 生命科学,2017,19(4):400-405.
[5]Park J S,Rho H S,Kim D H,et al. Enzymatic preparation of kaempferol from green tea seed and its antioxidant activity[J]. J Agric Food Chem,2006,54:2951.
[6]Tua L Y,Pi J,Jin H,et al. Synthesis,characterization and anticancer activity of kaempferol-zinc(II)complex[J]. Bioorg Med Chem L,2016,26:2730-2734.
[7]周发阳,徐翊雯,孙宇,等. 中药配位化学研究进展[J]. 中国现代中药,2015,17(5):502.
[8]李海霞,郭芳. 黄酮类化合物金属配合物研究进展[J]. 中国药房,2016,27(34):4872-4876.
[9]Ghosh N,Chakraborty T,Mallick S. Synthesis,characterization and study of antioxidant activity of quercetin-magnesium complex[J]. Spectrochim Acta A,2015,151:807-813.
[10]吴春,黄梅桂,车春波.槲皮素-锌(Ⅱ)配合物清除自由基的活性研究[J]. 食品工业科技,2010,1(31):128-129,247.
[11]Bukhari S B,Memonb S,Tahir M M,et al. Synthesis,characterisation and antioxidant activity copper -Quer-cetin complex[J]. Spectrochim Acta A,2009,71:1901-1906.
[12]Panhwar Q K,Memon S. Synthesis,characterisation,and antioxidant study of Cr(Ⅲ)-rutin complex[J]. Chem pap,2014,68(5):614.
[13]Panhwar Q K,Memon S. Synthesis of Cr(Ⅲ)-morin complex:characterization and antioxidant study[J]. Sci World J,2014(2):845-208.
[14]夏小明,张杰,刘绣华. 木犀草素-锡(Ⅱ)配合物合成的工艺研究[J]. 食品工业科技,2013,34(9):246-249.
[15]Cornard J P,Merlin J C. Spectroscopic and structural study of complexes of quercetin with Al(III)[J]. J Biol Inorg Chem,2002,92(1):19-27.
[16]Dehghan G,Khoshkam Z. Tin(Ⅱ)-quercetin complex:synthesis,spectral characterisation and antioxidant activity[J]. Food Chem,2012,131:422-426.
[17]Panhwar Q K,Memon S. Synthesis and evaluation of antioxidant and antibacterial properties of morin compl-exes[J]. J Coord Chem,2011,64(12):2117-2129.
[18]Exarchou V,Troganis A,Gerothanassis I P. et al. "Do strong intramolecular hydrogen bonds persist in aqueous solution? Variable temperature gradient1H,1H-13C GE-HSQC and GE- HMBC NMR studies of flavonols and flavones in organic and aqueous mixtures[J].Tetrahedron,2002,58(37):7423-7429.
[19]祝亚军,潘良军,赵良荣,等. 山奈酚与水的氢键作用对其抗氧化活性影响的理论研究[J]. 天然产物研究与开发,2013,25:792-795.
[20]翟广玉,渠文涛,朱玮,等. 芦丁锗的合成、表征及生物活性研究[J]. 天然产物研究与开发,2013,25:166-169,176.
[21]谢伟玲,杨培慧,蔡继业. 锗(IV)-槲皮素配合物的制备、表征及其抗氧化活性测定[J]. 分析化学,2010,12(38):1809-1812.
