吸附分离天然气中二氧化碳的分子筛研究进展
2018-04-25马宇彤胡云峰刘宏鹏
马宇彤,胡云峰,刘宏鹏
(1.东北石油大学,黑龙江 大庆163000; 2.哈尔滨石油学院,黑龙江 哈尔滨150000)
天然气主要由甲烷组成,含有少量的氮和二氧化碳。天然气中脱除二氧化碳的技术多样,主要有吸收法,吸附法和膜分离法[1]。其中,吸附法的能耗低、稳定性强、再生性能好、操作弹性大、无腐蚀,而且不产生二次污染[2],越来越受到国内外研究人员的重视。
1 用于分离CH4/CO2的吸附材料
1.1 活性炭
活性炭主要由范德华力主导在微孔内进行吸附,其丰富的孔结构和巨大的比表面积决定了它具有很强的吸附性能且性质稳定,是常用的物理吸附剂。
张建等[3]通过考察不同金属离子改性对煤基活性炭和果壳活性炭吸附性能的影响,得出Cu2+改性的果壳基活性炭对二氧化碳有较好的吸附性能。发现其吸附量受压力变化影响较大,易解吸。活性炭的表面是非极性的,对有机化合物、非极性或弱极性物质的吸附作用强。活性炭优先吸附水分子,原料需要预处理。
1.2 硅 胶
硅胶用途广泛,基本结构是由原硅酸H4SiO4的聚合体以链和网的形式构成,每个微粒通过相邻两微粒之间的烃基消去1个水而毗连最终形成物理结构很强的多孔物质[4]。
硅胶且有化学稳定性好、表面积大、孔隙率高、吸附能力强等优点。同时,硅胶容易再生,在控制条件下,可以选择性吸附混合组中的特定组分。在循环工作条件下,可快速吸附和解吸。
1.3 MOFs
金属有机骨架材料(MOFs)是一种由含氧、氮等的多齿有机配体(大多是芳香多酸和多碱)与过渡金属离子或者团簇通过配位自组装所形成的具有周期性网络结构的新型多孔材料,是具有周期性网络结构的配位聚合物[5]。MOFs的比表面积很大,其孔道内外有很大空间,可吸附大量的CO2,因此其吸附能力大大超过很多多孔性材料。MOFs的种类繁多,选择不同的配体和金属就制备不同的MOFs。
Miguel Palomin[6]发现在高压下,MOFs的吸附性能比A型分子筛好,这也是由于其存在大量的微孔和介孔,单位质量的MOFs有很大的吸附量,吸附容量会随比表面积的增大而增大。Furukaw等[7]制备了MOF-210,具有很高的孔隙率,CO2的吸附量能达到54.5 mmol/g。
但是,MOFs存在一些缺点。它对于混合气体中其他杂质的选择性低,不易选择配体,并且化学性质非常不稳定、水热稳定性差,还不能完全应用到实际的生产中去。
1.4 介孔材料
介孔材料是指孔径介于2~50 nm的一类多孔材料[8],特点为比表面积高、孔道结构规则、孔径分布小,可调节结构和表面性质。目前,用于吸附CO2的介孔硅材料有M41S系列和SBA-x系列。
Xu[9]考察了MCM-41的制备方法、溶剂的比值、硅铝比,以及吸附气是否含水对吸附性能的影响。发现增大硅铝比、加入添加剂和水的存在都能增大CO2的吸附量,最高可达5.59 mmol/g。
Rajesh等[10]采用红外和质谱连用的方法对用二元胺修饰的SBA-15吸附CO2进行了探究,吸附物为CO2、He、Ar的混合气。在30 ℃,吸附剂对CO2的吸附量为3.5 mmol/g。
1.5 沸石分子筛
沸石分子筛是天然或人工合成的含碱金属或碱土金属氧化物的结晶硅铝酸盐[11]。具有一定骨架结构和较强的吸附能力的微孔晶体材料,可把比自身孔径小的分子捕捉在孔道内部。
沸石分子筛结构的多样性,特别是结构和性质的可调变性大大扩展了沸石分子筛的应用范围[12]。沸石分子筛作为催化剂、吸附剂在化学工业中应用广泛。分子筛的吸附机理主要是动力学选择性分子筛容易吸附极性较强或易被极化的分子,是因为分子筛骨架和阳离子本身具有很强极性,可以与极性分子的异电中心相互吸引,使可极化的分子极化可通过静电诱导实现[13]。目前,经常用于分离CH4和CO2的主要有LTA型,CHA型,RHO型,FAU型与EST-4型分子筛。
2 用于分离CH4/CO2的分子筛
2.1 用于分离CH4/CO2的非八元环分子筛
2.1.1八面沸石型(FAU)
图1为FAU分子筛的三维十二元环立方晶系[14],包括低硅(摩尔比2.2~3.0)X型和高硅(摩尔比>3.0)Y型分子筛。
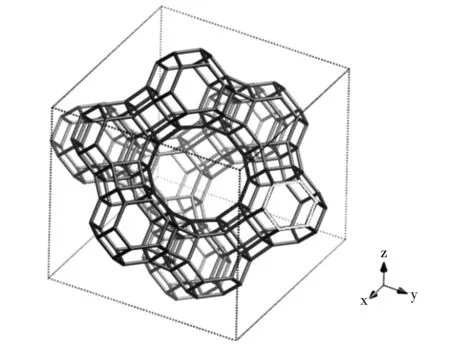
图1 FAU型分子筛的结构
Grande等[15]分别考察了孔道尺寸为1 nm的13X分子筛,孔径为0.4 nm的4A型分子筛以及活性炭3种吸附剂的CH4/CO2吸附特性。由于直径为0.38 nm的CO2与4A型分子筛的孔径大小接近,4A型分子筛吸附CO2的能力要低于13X型分子筛。实验结果表明,低压下,13X分子筛吸附能力较强;在高压区,活性炭吸附量显著提高。
Pour等[16]考察了在277、290和310 K,101 kPa下斜辉石和13X分子筛对CH4/CO2的吸附情况。发现13X分子筛的吸附CO2能力比斜辉石好。在277 K,101 kPa条件下,13X和斜辉石的选择性分别为8.47和5.63。再生实验前13X吸附CO2的穿透时间长,表明其吸附容量大。
2.1.2钛硅酸盐EST-4
钛硅酸盐ETS-4是以共价键连接的Ti和Si的氧化物。它与矿物合金的结构类似,有三维框架结构。它有一个12元环通道沿晶体的Z轴运行和8环通道沿Y轴运行。
Kuznicki等[17]用Sr2+交换的ETS-4可用于从CH4中分离CO2,Sr-ETS-4上CO2的吸收量会根据脱水温度的变化而变化。研究发现,在373K时Ca-ETS-4脱水8 h,会在298 K,101 kPa条件下Ba-ETS-4和Sr-ETS-4有更高的吸附量,为2.2 mmol/g。
通过对非八元环分子筛的综述可得:1)13X比表面积和孔容量大,所以相对于4A型分子筛有高的吸附能力。2)用二价阳离子交换的ETS-4型分子筛,稳定性强。在常温常压下,Ca-ETS-4较Ba-ETS-4和Sr-ETS-4吸附CO2的能力越强。
2.2 用于分离CH4/CO2的八元环分子筛
2.2.1LTA型沸石
A型沸石由钠盐的形式合成,Ⅰ型中的8个空位和Ⅱ型的3个空位由8个氧原子环组成,即八元环结构,是带有大笼和多个电荷平衡阳离子窄小微孔的结晶硅铝酸盐[18],如图2所示。

图2 LTA型分子筛的结构
Amber等[19]发现Na+与K+在孔口的位置不同,K+在八元环中心位置,而更小直径的Na+在偏离中心0.13 nm的位置。这个位置会使Na+在八元环平面上出现4种作用力,同时也产生了几何等效作用。4A分子筛可以在吸附CO2的同时有效排除甲烷。然而K+离子尺寸较大,会堵塞孔口,从而3A分子筛几乎不吸附CO2。
Bae等[20]用不同的阳离子交换的分子筛对CO2/N2进行分离,发现在一定的压力范围内,298 K条件下,Ca2+交换的沸石对CO2的吸收量为5 mmol/g。而后,他们用Mg-MOF-74进行比较,结果发现在150 kPa,313 K条件下,CaA有更高的CO2吸附能力。这是因为Ca2+不是全部分布在八元环的孔口,不会阻碍CO2的吸附。
2.2.2RHO型沸石
RHO是一种合成沸石,也是八元环立方结构,如图3所示。硅铝比通常为4或5,对CO2展现了高吸附能力。Palomino[21]表明由Na+和Cs+离子交换得到的RHO型沸石,在高压850 kPa,303 K下,吸附量会大于6 mmol/g。在标准大气压下,303 K条件下,吸附量仍大于3 mmol/g,选择性为75。他们认为,RHO的高选择性是因为它的孔径小,表面极性高。吸附的CO2会引起骨架的扩张,与非扩张的骨架相比能吸附更多的CO2。

图3 RHO型分子筛结构
Lozinska等[22]合成了H-RHO。在80 kPa,298 K条件下,CO2的吸附量为3.3 mmol/g。对于这种形式的RHO,CO2与骨架的相互作用可以“移动”阻碍CO2进入的阳离子,让CO2能够进入并吸附在阳离子修饰的RHO分子筛上。
2.2.3CHA型沸石(菱沸石)
菱沸石具有阳离子交换的性能,所以很多分子筛以菱沸石的形式出现,例如SAPO-34和SSZ-13。它是由AlO4和SiO4四面体通过氧原子连接而成,八元环结构的椭球形晶体结构,如图4所示。
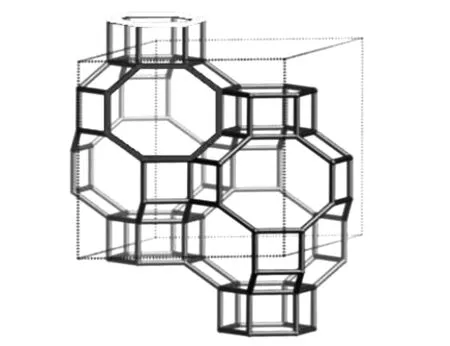
图4 CHA型分子筛的结构
Watson等[23]发现在高压3 MPa,305 K条件下,CHA的CO2的吸附量可达到5 mmol/g。Na-CHA和Li-CHA在120 kPa,273 K条件下,吸附量分别为4.4 mmol/g和4.5 mmol/g。在相同条件下,Mg-CHA和Ca-CHA吸附量为4 mmol/g,Ba-CHA的吸附量稍低,为3.5 mmol/g。但是在更低压(接近0 kPa)条件下,Ba-CHA吸附的CO2比Li-CHA吸附的CO2高。在低压下的高吸收量,可能与Ba2+与CO2的强阳离子四极作用有关[24]。这种趋势表明,阳离子电荷密度、吸附剂的电场梯度和与O2的四极化作用是至关重要的。
Webley等[25]解释了经过离子交换后CHA选择性增强的原因。他们认为是“分子陷门”机制导致的,对大分子N2和CH4的吸附量很低的原因不完全是由于尺寸效应。相反,他们也提出是CO2会与阳离子相互作用,以至于这些离子偏离正常的位置,能留出足够的空间让CO2进入微孔[26]。而CH4是非极性分子,它没有双极分子和四极现象,不能和阳离子相互作用,诱导阳离子运动。他们得出的结论是1.5∶1的低硅铝比会增加CO2的选择性。在这个比例下,所有的孔道都会被阳离子所占据,这样就能限制N2和CH4的吸附。
Pham等[27]发现,K-CHA与Na-CHA在吸附CO2上也有很大的差别,这是因为钾离子处于CHA中八元环的位置,钠离子处于六元环上方22°位置。同时CO2会在两个位置发生吸附,一是八元环位置,二是CHA骨架的椭圆形的笼内。所以K-CHA可以吸附更多的CO2。
1) SAPO-34分子筛。Rivera-Ramos等[28]发现,分别用Ce3+Ti3+Mg2+Ca2+Ag+或Na+交换的SAPO-34的吸附性能均不如Sr-SAPO-34。他们认为,Sr2+很容易接近,且不会阻碍CO2的进入。而与Ce3+Ti3+在SAPO-34进行离子交换时需要考虑低稳定性。另外,他们假设,Ce3+Ti3+通过占据S’Ⅲ位堵塞了微孔,会使这些离子交换过的SAPO-34对CO2的吸附量很低。
2) SSZ-13分子筛。SSZ-13分子筛与SAPO-34分子筛具有相同骨架结构,也受到了人们的广泛关注。Hudson等[29]研究了用H+、Cu2+交换的SSZ-13,在低压条件下吸附CO2的过程。在100 kPa,298 K下,H-SSZ-13和Cu-SSZ-13的吸附量分为3.98 mmol/g和3.75 mmol/g。同时,通过改变硅铝比就能改变SSZ-13的Cu2+的含量,也会增大吸附和分离CO2的能力。使用Cu-SSZ-13作为吸附剂的原因是在吸附时水对其影响不大。
2.2.4AlPOs沸石
磷酸铝(AlPOs)是具有八元环的多孔磷酸盐,它的结构和微孔的二氧化硅类似[30]。磷酸铝由共价氧化物Al、P连接在一起。Cheung等[31]表明,在101 kPa,273 K条件下,AlPO-17的吸附量很低,为2.3 mmol/g。他们认为,低吸附量与缺乏阳离子位点有关。同时,在所研究的条件下,CO2与AlPO-17的骨架作用很弱也会导致低吸附量。但是,经过5次吸附循环再生,AlPO-17仍保留大于99%原有吸附容量。
通过对八元环分子筛的介绍可得:1)不同离子在CHA型与A型分子筛的位置不同。如,在CHA型分子筛中,会存在“分子陷门”现象。K+处在八元环的中心位置,CO2会使其短暂偏离原来的位置,有足够的空间让CO2进入,提高CO2的选择性。而对于3A型分子筛,不存在这种机制。K+的动力学半径较大,会堵塞孔口,阻碍了CO2分子的进入。2)CHA型分子筛酸性越强,在CH4中吸附CO2的能力越强。而AlPO-17型分子筛的CO2吸附等温线呈线性,更适合某些PSA分离。在解吸过程中,CO2从AlPO-17上脱附十分有效,在工业上有良好的发展前景。
3 结论与展望
综上所述,在天然气中分离CO2的工业技术中,吸附分离法是目前应用最广泛的方法。
1)EST-4型分子筛孔径可调节,具有很大开发潜力。
2)CHA型分子筛与RHO型分子筛都存在“分子陷门”机制。它们的八元环像一扇门能够容纳一个多余的骨架阳离子。在临界温度下,阳离子能够占据八元环的中心,阻止气体分子的进入。由于温度的震荡,阳离子会短暂的偏离中心位置,让CO2分子进入。与阳离子作用弱的CH4不能够降低阳离子的势能,会被排除在外。这就促使了这2种分子筛的对CH4中CO2的选择性高,而其他的一些分子筛不存在这种机制。
3)SAPOs型分子筛的弱电场梯度和阳离子的数量使其具有高的CO2吸附能力且降低了亲水性。AlPOs型分子筛与SAPOs型分子筛很相似,亲水性更低。但是在相同的温度与压力下对CO2的吸附量与选择性会较低。
虽然很多小孔分子筛在CO2分离上表现良好的潜力,但有一些问题仍待解决。分子筛的制备过程所使用的模板剂成本高,制备方法复杂,使得分子筛的成本增加,如何提高制备经济性和简单性是不容忽视的问题。分子筛吸附法还不能大规模应用,在未来的很长的一段时间内,开发新型高效廉价、物理化学性质稳定、吸附能力强、选择性好的分子筛是研究的主要方向。
[1] 刘露, 段振红, 贺高红, 等. 天然气脱除CO2方法的比较与进展[J]. 化工进展, 2009, 28: 290-291.
[2] 王田军, 李军, 崔凤霞, 等. 二氧化碳捕集低温吸附剂研究进展[J]. 精细石油化工, 2015, 32(4): 70-76.
[3] 唐莉, 王宝林, 陈健, 等. 变压吸附法回收CO2[J]. 应用技术, 1998,02:47-51.
[4] 刘应书, 郑新港, 刘文海, 等. 烟道气低浓度二氧化碳的变压吸附法[J]. 现代化工, 2009, 29(7): 76-79.
[5] 钟旭峰. 金属有机骨架化合物MOF-5吸水稳定性及骨架改性储性能的模拟研究[D]. 北京:北京化工大学,2010.
[6] Miguel Palomino, Velino Corma A. New Insights on CO2Met-hane seperation using LTA zeolites with different Si/Al ratio anda first comparison with MOFs[J]. Langmuir Article, 2010, 26(3): 1910-1917.
[7] Furukawa H, Go Y B. Ultrahigh porosity in metal organic fra-meworks[J]. Science, 2010, 329: 424-428.
[8] 唐嘉伟. 新型介孔材料的合成及其功能研究[D]. 上海:复旦大学,2008.
[9] 杨海燕. 分离CO2/CH4的吸附剂研究[D]. 哈尔滨:东北农业大学,2013.
[10] 厉向杰, 张禹秋, 张宝亮, 等. 固体吸附剂吸附二氧化碳的研究进展[J]. 现代化工, 2012, 32(2): 24-27.
[11] 李莉,袁文辉, 韦朝海. 二氧化碳的高温吸附剂及其吸附过程[J].化工进展, 2006, 25(8): 918-922.
[12] 王绪绪, 陈旬, 徐海兵, 等. 沸石分子筛的表面改性技术进展[J].无机化学学报, 2002, 18(6): 541-548.
[13] 顾嘉嘉, 谷宏专. 分子筛在气体分离与净化中的应用[J]. 能源环境保护, 2005, 19(1): 15-18.
[14] 侯新刚, 薛彩红, 赵毅霞. 粉煤灰合成13X型沸石的实验研究[J].化工矿物与加工, 2007, 36(4): 24-26.
[15] Arefi Pour A, Sharifnia S, Neishaborisaleh R, et al. Performance evaluation of clintilolite and 13X zeolites in CO2seperation from CO2/CH4mixture[J]. Journal of Natural Gas Science and Engineering, 2015, 26: 1246-1253.
[16] Philippou A, Anderson M W. Structural investigation of EST-4[J]. Zeolites, 1996, 16: 98-107.
[17] Kuznicki M, Bell V A, Nair S, et al. A titanosilicate molecular sieve with tunable pores and its use in gas separations[J]. Nature, 2001, 412: 720-724.
[18] Harper R J, Stifel G. R. Adsorption of gas on 4A synthetic zeolite[J]. Canadian Journal of Chemistry. 1969, 47(24): 4661-4670.
[19] Pham T D, Hudson M, et al. Molecular Basis for the high CO2Adsorption capacity of chabazite zeolites[J]. Chem Sus Chem, 2014, 7, 3031-3038
[20] Bae T H, Hudson M R, Mason J A, et al. Solid sorbents for carbon capture[J]. Engry Enviorment, 2013, 6: 128-138.
[21] Palomino M, Corma A, Rey F, et al. New insights on CO2methane separation using LTA zeolites with different Si/Al ratio and a first comparison with MOFs[J]. Langmuir, 2010, 26: 1910-1917.
[22] Araki S, Kiyohara Y, Tanaka S, et al. Adsorption of carbon dioxide and nitrogen on zeolite rho prepared by hydrothermal synthesis using 18-crown-6 ether[J]. Journal of Colloid and Interface Science, 2012, 388: 185-190.
[23] Barrer R M. Syntheses and reactions of mordenite[J]. Journal of The Chemical Society, 1948, 24(6): 2158-2163.
[24] Zhang J, Singh J, Webley P A, et al. Carbon dioxide separationfrom flue gases: A technological review emphasizing reduction in greenhouse gas emissions[J]. Microporous and Mesoporous Materials. 2008, 111: 478-487.
[25] Ridha F N, Webley P A. Anomalous Henry’s law behavior of nitrogen and carbon dioxide adsorption on alkali-exchanged chabazite zeolites[J]. Seperation and Purification Technolgy, 2009, 67: 336-343.
[26] Jin Shang, Gang Li, Ranject Singh, et al. Discriminative separ-ation of gas by a “molecular trapdoor” mechanism in chabazitezeolites[J]. Journal of the American Society. 2012, 10: 19246-19253.
[27] Pham Trong D, Hudson Mattew R, BrownCraig M, et al. Molecular basis for the high CO2adsorption capacity of chabazite zeolites[J]. Chem Sus Chem, 2014, 7: 3031-3038.
[28] 刘立恒, 辜敏, 鲜学福,等. 孔结构和表面化学性质对活性炭吸附性能的影响[J]. 环境工程学报, 2012, 4: 1299-1303.
[29] Li Zhang, Riqiang Fu. Strontium chabazite-type silicoaluminophosphate prepared via microwave synthesis and partial detemplation: a superior CO2adsorbent[J]. Microporous and Mesoporous Materials, 2012, 147: 274-280.
[30] Jin shang, Gang Li, Qinfen Gu, et al. Temperature controlled invertiable selectivity for adsorption of N2and CH4by molecular trapdoor chabazites[J]. Chem Commun, 2014, 50: 4544-4546.
[31] Ocean Cheung, Nilas Hedin. Zeolites and related sorbents with narrow pores for CO2separation from flue gas[J]. RSC Advances, 2014, 4: 14480-14494.
