一氧化氮对低温贮藏桃果实线粒体氧化损伤的影响
2018-04-25胡珊叶志恒冯建荣朱树华
胡珊,叶志恒,冯建荣,朱树华
(1.石河子大学农学院园艺系/特色果树栽培生理与种质资源利用兵团重点实验室,新疆石河子 832003;2.山东农业大学化学与材料科学学院, 山东泰安 271018)
0 引 言
【研究意义】桃(Prunuspersica)属于温敏性水果,低温贮藏下易发生冷害[1]。冷害会使果实发生生理症状的改变,比如增加果实重量的损失以及膜完整性的丧失[2]。冷害会使果实产生明显病变症状,比如果肉褐变、不能正常后熟以及腐烂加快等[2, 3]。线粒体是细胞中供应能量的主要场所。线粒体参与细胞分化、信息传递及细胞凋亡等过程,且具有调控细胞生长及细胞周期的能力[4]。线粒体数量和形态反映了细胞类型的能量需求。活性氧(reactive oxygen species, ROS)是线粒体大量呼吸产生的[5]。不同的ROS含量在细胞内有着不同的作用,线粒体内膜脂过氧化程度的增加是由于线粒体ROS含量高会产生过多的氧化脂质[6]。线粒体内存在很多抗氧化酶,可以分解线粒体内的ROS,维持线粒体内的氧化还原平衡,减轻线粒体内氧化损伤[7]。超氧化物歧化酶(superoxide dismutase, SOD)转性催化O2-,将其转化成H2O和O2,是线粒体内抵抗ROS的第一道防线[8]。过氧化氢酶(catalase, CAT)将线粒体内的H2O2转化为H2O 。过氧化物酶(peroxidase, POD)可以催化H2O2及过氧化脂类的分解[11, 12]。 线粒体抗氧化酶彼此间的协同作用可以清除线粒体内多余的ROS,维持线粒体内氧化还原的平衡[13],而保证线粒体正常生理活动。一氧化氮(nitric oxide, NO)是一种脂溶性气体分子且具有生物活性。【前人研究进展】NO可以介导植物多种生理生化和免疫防御反应[14, 6]。NO在调节植物代谢和调控植物线粒体功能方面有着重要的作用。NO在线粒体中通过抑制细胞色素C的释放量间接调节线粒体功能[17]。NO可以参与线粒体呼吸过程,调节线粒体内ROS的生成[18]。【本研究切入点】外源NO处理可以增强植物线粒体的抗氧化性[19,20]。研究桃果实在冷藏期间NO对线粒体膜及线粒体抗氧化系统。【拟解决的关键问题】以新泰红桃为试材,用15 μmol/L NO、5 μmol/L c-PTIO (2-(4-carboxyphenyl)-4,4,5,5-tetramethylimidazoline-1-oxyl- 3-oxide)浸泡处理桃果实,测定桃果实冷藏期间NO对其品质影响,NO对冷藏期间桃果实线粒体完整性、线粒体活性氧及抗氧化酶活性的影响,为NO在桃果实贮藏保鲜应用提供依据。
1 材料与方法
1.1 材 料
桃品种为新泰红 (Prunspersica[L.] Batsch, cv. Xintaihong), 2017年7月18日采摘于山东省泰安市新泰市桃基地。选取无病虫害、无机械损伤以及果个均匀的七成熟果实,0℃下过夜预冷后,样品分为三组,每组100枚桃果实,分别用15 μmol/L NO、5 μmol/L c-PTIO 和对照 (去离子水)浸泡30 min。将处理后的桃果实放置于0℃恒温培养箱内,每一周取一次样用于品质相关指标测定,桃果实切成小块后冷冻于-80℃保存用于线粒体提取。
1.2 方 法
1.2.1 硬度测定
采用艾德堡GY-4果实硬度计测定,探头直径为11 mm,测试结果取下压峰值,每个处理取9个果实,每个桃果实取3个测量点测试,单位为N/cm2。
1.2.2 可溶性固形物含量
1.2.3 色差
利用色差计测定桃果实表面部分的颜色。以标准白度(L=97.06,a=0.04,b=2.01)来校准测定所使用的色差计。测定系统显示(L*,a*,b*)
1.2.4 失重
用电子天平测定各组桃果实的鲜重,贮藏期间每隔一周用电子天平称取每组桃果实的重量。失重率计算公式如下:

1.2.5 线粒体提取及纯化
参照Jing的方法提取桃果实线粒体[21]。利用蔗糖密度梯度离心法纯化线粒体,并用3 mL Tris-HCl缓冲液(pH 8.5 100 mmol/L)重悬浮。
1.2.6 线粒体耗氧量
线粒体耗氧量的测定参照潘俨的方法[22],线粒体耗氧量表示为nmol min/ mg/protein。
1.2.7 线粒体呼吸控制率(RCR)
参照倪海霞[23]的方法用Hansatech液相氧电极测量线粒体呼吸控制率。RCR即加入ADP时(Ⅲ态)的呼吸速率与ADP耗尽后(Ⅳ态)的呼吸速率比值。
1.2.8 线粒体膜电势
参考Baracca[24]方法来测定线粒体膜电势。线粒体的膜电势表示为[(ΔF/Fi)s/ mg/protein]。
1.2.9 线粒体细胞色素C含量
线粒体细胞色素C含量测定参照Balaban等[25]方法,根据标准曲线计算每克线粒体蛋白对应细胞色素C含量(μmol)。
1.2.10 线粒体活性氧(ROS)含量
线粒体中ROS含量的测定参考Jambunathan[26]方法。桃果实中ROS的含量表示为a.u.mg/protein。
1.2.11 线粒体过氧化氢酶(CAT)活性
线粒体中CAT的活性测定参考 Zhong[27]方法,检测液中由于CAT催化引起的240 nm下的吸光度每降低0.001个单位被定义为一个CAT酶活性(U)。线粒体中CAT的单位酶活性表示U mg/protein/sec。
1.2.12 线粒体过氧化物酶(POD)含量
桃果实线粒体内POD含量测定参考Rahnama[28]方法。POD的单位酶活性定义由POD的催化作用引起的580 nm下每秒内增加0.001个单位的吸光度定义为一个酶活性单位(U)。线粒体POD的活性表示为U mg/protein/sec。
1.2.13 线粒体超氧化物歧化酶(SOD)含量
桃果实线粒体SOD含量测定采用NBT光还原法[29]。线粒体SOD的活性以SOD抑制NBT的光还原率50%为酶活单位(U)。线粒体SOD的活性表示为 U mg/protein。
2 结果与分析
2.1 NO对冷藏桃果实品质影响
研究表明,桃果实在冷藏过程中硬度呈下降趋势,0 d时桃果实硬度为53 N/cm2,第5周时分别为32.2 (对照)、30.1 (c-PTIO)、38.8 N/cm2(NO)。贮藏期间,NO处理桃果实硬度均高于对照和c-PTIO处理,第3周,NO处理桃果实硬度是对照的1.23倍,是c-PTIO处理的1.33倍(图1A)。0 d桃果实色差L*值为76.4,在桃果实冷藏贮藏期间一直下降,且在第5周达到最低值,NO处理桃果实色差L*值是对照处理的1.07倍,是c-PTIO处理的1.13倍(图1B)。桃果实冷藏贮藏期间可溶性固形物含量处于下降趋势,失重率处于上升趋势,0 d时桃果实的可溶性固形物含量为14.55,失重率为0(图1CD)。NO处理,可溶性固形物含量均高于对照和c-PTIO处理,贮藏期间,NO处理桃果实失重率低于对照和c-PTIO处理。第4周,NO处理,SSC是对照的1.09倍,c-PTIO的1.14倍。图1
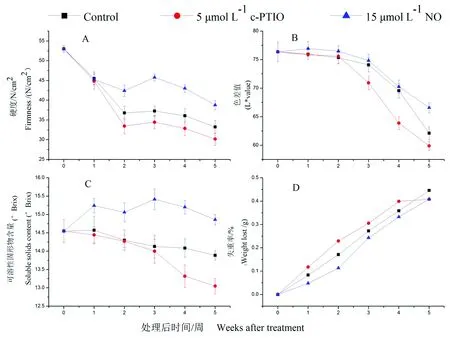
注:每组数据平均值±SE(n = 3)
图1 桃果实在低温贮藏期间不同NO溶液下硬度(A)、色差L值(B)可溶性固形物含量(C)和失重率(D)变化
Fig.1 Effects of NO solution on firmness (A), color difference L*value (B) soluble solid content (C) and weight loss rate (D) during low temperature storage of peach fruit
2.2 NO对冷藏桃果实线粒体影响
研究表明,桃果实线粒体呼吸耗氧量在0 d时是41.0 nmol min/mg/protein,冷藏桃果实线粒体呼吸在第3周达到峰值,之后开始下降,且在贮藏期间c-PTIO和对照处理桃果实耗氧量均高于NO处理。第5周,NO处理桃果实线粒体耗氧量是对照处理的71.9%,是c-PTIO处理的40.0%(图2A)。线粒体RCR在第0 d时为2.9,低温冷藏过程中线粒体RCR在第2周出现峰值后逐渐下降,且在整个贮藏期间NO处理桃果实线粒体RCR均高于对照和c-PTIO处理,第2周,NO处理桃果实线粒体RCR是对照的1.30倍;第4周,NO处理桃果实线粒体RCR是c-PTIO处理的1.57倍(图2B),NO处理可以维持线粒体完整性,减少线粒体耗氧量,延长桃果实贮藏期。冷藏期间,线粒体膜电势随着贮藏时间的增加而降低,0 d时线粒体膜电势为20.4 s/g/protein,贮藏期间,NO处理桃果实线粒体膜电势始终高于对照和c-PTIO处理。第2周,NO处理是对照的1.68倍,c-PTIO的2.39倍,在冷藏期间,NO处理可以有效的维持线粒体内外离子和线粒体膜电势平衡(图2C)。桃果实在冷藏期间,线粒体细胞色素C含量随着贮藏时间的增加而减少,0 d时,线粒体细胞色素C含量为24.8 μmol g/protein, NO处理低于对照和c-PTIO处理, 3周时,NO处理是对照的54.7%,是c-PTIO的50.1%(图2D)。图2
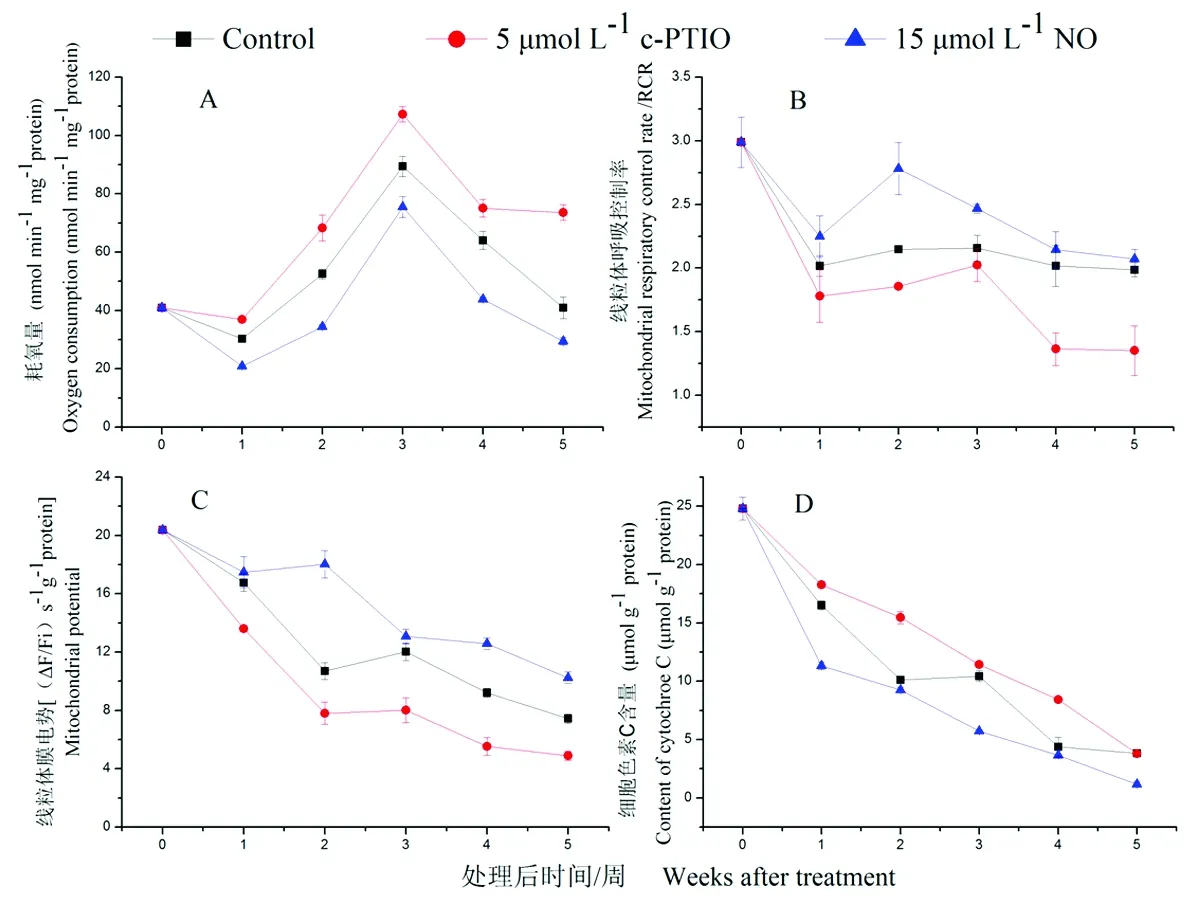
注:每组数据平均值±SE(n = 3)
图2 桃果实在低温贮藏期间不同NO浓度下线粒体耗氧量(A)、线粒体呼吸控制率(B)、线粒体膜电势(C)以及线粒体细胞色素C含量(D)变化
Fig.2 Effects of NO on mitochondrial oxygen consumption (A), mitochondrial respiratory control rate (B), mitochondrial membrane potential (C) and mitochondrial cytochrome C content (D) during low temperature storage
2.3 NO对冷藏桃果实线粒体ROS含量的影响
研究表明,低温贮藏过程中,线粒体ROS含量在第3周出现峰值后开始下降,c-PTIO处理明显高于对照和NO处理。0 d时线粒体ROS含量为119.5 a.u mg/protein,第1周,NO处理是对照的50.4%,是c-PTIO处理的43.2%。清除NO后,线粒体完整性遭到破坏,线粒体ROS含量及膜脂过氧化损伤程度增加。图3

注:每组数据平均值±SE(n = 3)
图3 桃果实在低温贮藏期间不同NO浓度下线粒体活性氧含量变化
Fig.3 Effects of NO on mitochondrial reactive oxygen species in peach fruit during low temperature storage
2.4 NO对冷藏桃果实线粒体抗氧化酶活性的影响
研究表明,低温贮藏过程中,NO处理线粒体CAT活性均高于对照和c-PTIO处理,0 d时线粒体CAT活性为16.6 U min/mg/protein, 第2周,NO处理是对照的1.59倍,是c-PTIO的3.42倍(图4A)。贮藏期间,线粒体POD呈下降趋势,NO处理线粒体POD活性最高。0 d时,线粒体POD活性为128.2 U min/mg/protein,第3周,NO处理是对照的1.41倍。第4周,NO处理POD活性是c-PTIO处理的1.91倍(图4B)。桃果实SOD活性受多种因素影响。NO处理桃果实线粒体SOD活性在整个贮藏期间活性最高,第1周,NO处理是对照的1.78倍。第4周,NO处理是c-PTIO处理的1.81倍,NO处理桃果实线粒体抗氧化酶活性均高于对照和c-PTIO处理。图4
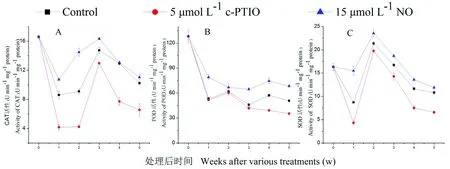
注:每组数据平均值±SE(n = 3)
图4 桃果实在低温贮藏期间不同NO浓度下线粒体抗氧化酶活性、过氧化氢酶(A)、过氧化物酶(B)、超氧化物歧化酶(C)变化
Fig.4 Effects of NO on mitochondrial antioxidant enzyme activity during peach storage during low temperature storage. CAT (A), POD (B), SOD (C)
3 讨 论
硬度、SSC、水分含量及褐变是衡量果实商品价值的重要指标。常温下,采后果蔬随着贮藏时间的增加会出现硬度下降,失水、可溶性固形物含量及色差L*值下降等生理症状[30]。通过低温冷藏可以减弱果蔬的呼吸强度从而达到保鲜的效果[31]。桃果实在冷藏过程中,硬度有短暂的增大趋势,可能是桃果实在贮藏过程中随着呼吸作用,酶活变化以及果胶变化等原因,大量失水,出现果皮皱缩的现象[32]。NO处理可以显著维持桃果实的硬度,这与NO在桃果实贮藏期间抑制了纤维素和半纤维素的分解,减少果胶酸和可溶性果胶的含量有关[33,34]。
余克威等[35]发现NO不仅可以促进线粒体内物质的合成而且在调节线粒体介导细胞凋亡上有着重要的作用。研究发现,低温贮藏过程中,经NO处理的桃果实可以保持线粒体的完整性,维持线粒体内环境稳定,这与吕小华[36]的研究相似。ROS被认为是有害的分子,越来越受到广泛关注,线粒体是细胞内ROS的主要来源场所[37]。在正常的情况下,生物体内的ROS是处于一种平衡的状态,可以增强生物免疫功能,但是,采摘后,离开母体的营养供应,桃果实的生理功能遭到破坏,ROS大量增加,破坏线粒体膜的完整性,释放细胞色素C,从而引发线粒体膜电位变化,导致细胞凋亡[38]。已有研究表明,线粒体内抗氧化酶可以有效地清除线粒体内ROS含[39,40]量(研究发现在低温冷藏过程,NO处理可以维持桃果实内线粒体抗氧化酶活性,减少ROS的积累,在维持膜电势的同时降低了细胞色素C含量,达到保鲜的效果)。在冷藏过程中,NO处理可以减缓线粒体的氧化损伤程度。
低温冷藏期间,15 μmol/L NO处理可以维持桃果实品质,保持线粒体完整性,延缓线粒体ROS含量增加,并提高线粒体抗氧化酶活性,从而维持线粒体抗氧化系统的稳定,减弱线粒体的氧化损伤。
4 结 论
4.1 冷藏贮藏期间NO可以维持桃果实硬度,延缓色差L*值的下降,提高SSC并降低桃果实的失重率。NO处理可以维持桃果实的品质,起到贮藏保鲜的效果。NO可以维持线粒体膜完整性,降低细胞色素C的含量,从而维持细胞的活性。NO处理桃果实线粒体抗氧化酶有效的清除了线粒体内过多的ROS,维持了线粒体内的动态平衡。
4.2 在第5周时,桃果实品质指标分别为0 d的73.2%(硬度),87.2%(色差L值),1.02倍(SSC),NO处理延长桃果实贮藏时间;NO可以维持桃果实低温贮藏过程线粒体膜电势,在第5周时为0 d的50%,NO处理维持线粒体完整性及线粒体生理功能。NO通过维持线粒体内抗氧化酶活性降低线粒体内ROS含量,第5周时NO处理桃果实ROS含量为对照处理的89.8%,c-PTIO处理的82.9%,在桃果实低温冷藏过程中,NO处理通过降低线粒体中ROS含量来提高线粒体抗氧化系统的稳定性。
