海蜇胶原蛋白的制备及理化性质研究
2018-04-24李玉芬郑明星
李玉芬, 郑明星, 朱 凡, 林 娟
(福州大学生物科学与工程学院, 福建省海洋酶工程重点实验室, 福建 福州 350116)
0 引言
胶原蛋白是生物体内含量最丰富的结构蛋白, 胶原蛋白含有由3条α-肽链组成的三螺旋结构, 分子量较大, 难溶于水和稀碱, 部分可溶于稀酸或中性盐溶液, 具有可成膜性、 低免疫原性等优良特性, 在食品、 医药、 生物材料等领域具有重要地位[1-4]. 随着人工海蜇养殖技术的重大突破, 海蜇的高值化利用也日益受到人们的关注[5]. 研究表明[6], 海蜇皮的干基组分中含有84.33%胶原蛋白. 因此, 海蜇可以作为一种新型的胶原蛋白制备来源, 极具发展前景. 目前, 胶原蛋白的提取方法可以归类为3种: 利用高压辅助提取的物理方法[7]; 在低温或者热水条件下利用溶剂辅助提取的方法, 根据溶剂的类型可分为酸法[8]、 碱法[9]和盐法[10]; 利用蛋白酶在一定的温度和pH值条件下进行酶解提取的酶法. 一般来说, 高压、 高温条件下提取的胶原蛋白都已经变性成明胶, 只有在低温环境下提取的胶原才有可能保持胶原蛋白本身的三螺旋结构. 本研究以海蜇加工下脚料为原料, 建立在中低温条件下以柠檬酸为提取剂的胶原蛋白提取工艺, 并对海蜇胶原蛋白的理化性质进行分析, 为海蜇高值化利用提供理论基础, 为胶原蛋白的制备提供新途径, 为基于海洋来源胶原材料的构建及其应用提供科学依据.
1 材料与方法
1.1 材料与试剂
海蜇加工下脚料由福建亿达食品有限公司提供.
L-羟脯氨酸购自上海Aladdin公司; 牛皮I型胶原蛋白购自美国Sigma公司; 胃蛋白酶(1.58 U·mg-1)和胰蛋白酶(4.40 U·mg-1)购自中国国药集团; 风味蛋白酶(7.62 U·mg-1)、 木瓜蛋白酶(13.73 U·mg-1)、 中性蛋白酶(9.02 U·mg-1)和碱性蛋白酶(84.63 U·mg-1)购自北京Solarbio公司.
1.2 实验方法
1) 海蜇基本成分测定. 水分含量采用恒重法测定, 参照《粮食、 油料检测 水分测定法(GB/T 5497—1985)》[11]; 灰分采用灰化法测定, 参照《粮食、 油料检测 灰分测定法(GB/T 5505—1985)》[12]; 脂肪采用索氏抽提法测定, 参照《粮食、 油料检验 粗脂肪测定法(GB/T 5512—1985)》[13]; 蛋白质采用凯氏定氮法, 参照《食品中蛋白质的测定(GB/T 5009.5—2003)》[14]; 总糖采用斐林试剂滴定法测定[15]. 采用Woessner体系[16]检测羟脯氨酸的含量, 间接计算出海蜇样品的胶原蛋白百分比, 并通过SDS-PAGE分析胶原蛋白的结构完整性.
2) 原料预处理. 将海蜇加工下脚料用清水冲洗, 将充分除盐的海蜇用搅拌机搅碎至无明显颗粒, 过滤沥干; 添加丙酮溶液, 静置1 d, 蒸馏水清洗至无异味, 过滤沥干; 置于0.1 mol·L-1磷酸氢二钠溶液中浸泡, 定期更换溶液, 蒸馏水清洗至中性, 过滤沥干, 低温存放备用.
3) 不同提取方法的比较. 比较热水浸提法、 高温酸法、 低温酸法和酶法对胶原蛋白提取率的影响. 准确称取2.5 g海蜇匀浆于50 mL离心管, 加入5.0 mL提取剂, 于适当温度下提取12 h, 期间每隔2 h搅拌一次; 待反应结束, 于4 ℃下以13 795 r·min-1离心15 min, 收集上清液用于胶原蛋白含量的测定及SDS-PAGE分析.
4) 不同蛋白酶种类的比较. 以胶原蛋白提取率为指标, 在4 ℃、 蛋白酶添加量1.0%(质量分数, 以下同)、 料液比1∶2.0(w∶V, 以下均同)和提取时间24 h条件下, 比较6种不同蛋白酶在其最适pH值条件下对海蜇胶原蛋白的提取效果.
5) 不同酸种类的比较. 在4 ℃、 胃蛋白酶添加量1.0%、 酸浓度0.05 mol·L-1、 料液比1∶2.0和提取时间24 h条件下, 比较冰乙酸、 盐酸、 柠檬酸和乳酸溶液对胶原蛋白提取效果的影响.
6) 不同提取温度的比较. 选取上述最优酸种类, 在胃蛋白酶添加量1.0%、 酸浓度0.05 mol·L-1、 料液比1∶2.0和提取时间12 h条件下, 比较不同温度(4、 10、 15、 20、 25和30 ℃)对胶原蛋白提取效果的影响.
7) 酶法制备胶原蛋白的单因素实验. 通过对酸浓度(胃蛋白酶添加量1.0%、 料液比1∶2.0和提取时间6 h条件下)、 提取时间(胃蛋白酶添加量1.0%、 柠檬酸浓度0.05 mol·L-1和料液比1∶2.0条件下)、 胃蛋白酶添加量(柠檬酸浓度0.05 mol·L-1、 料液比1∶2.0和提取时间8 h条件下)、 料液比(胃蛋白酶添加量1.0%、 柠檬酸浓度0.05 mol·L-1和提取时间8 h条件下)等5个因素进行单因素实验, 研究各因素对胶原蛋白提取率的影响.
8) 正交实验设计. 以柠檬酸浓度(因素A)、 提取时间(因素B)、 料液比(因素C)和加酶量(因素D)为考察因素, 选取合适的3个水平, 以胶原蛋白提取率为目标函数, 选用正交表L9(34)进行正交实验, 确定海蜇胶原蛋白酶法最优提取工艺.
9) 海蜇胶原蛋白的分离纯化. 向上述胶原蛋白粗提液中添加NaCl至终浓度为2.0 mol·L-1, 搅拌过夜; 离心取沉淀重溶于0.01 mol·L-1柠檬酸溶液中, 转入40 ku的透析袋, 置于0.02 mol·L-1磷酸氢二钠溶液中透析完全; 离心取沉淀重溶于0.01 mol·L-1柠檬酸溶液, 再用蒸馏水透析完全; 离心取沉淀冷冻干燥后即为胶原蛋白海绵状干品.
10) 海蜇胶原蛋白的理化性质分析. 采用SDS-PAGE分析胶原蛋白类型及单链分子量; 采用氨基酸自动分析仪测定胶原蛋白的氨基酸组成; 采用傅里叶红外光谱(扫描波数4 000~400 cm-1)分析胶原蛋白的吸收带特征; 将海蜇胶原蛋白在200~400 nm近紫外光区进行扫描, 分析其对近紫外光的吸收特性; 考察温度、 pH值和浓度对胶原蛋白黏度的影响, 将动力黏度变化50%时所对应的温度定义为胶原蛋白的热变性温度; 考察pH值和NaCl质量浓度对胶原蛋白溶解性的影响.
2 结果与分析
2.1 海蜇基本成分分析
海蜇加工下脚料中水分占68.80%(质量分数, 以下均同), 盐分占24.20%, 干基组分为7.00%. 在海蜇干基中, 蛋白质含量最高, 占总组分的91.40%, 其中胶原蛋白占总干基组分的44.91%, 是海蜇的主要蛋白组成; 海蜇干基的总糖含量相对较高, 占7.48%, 这可能是无脊椎动物中胶原蛋白糖化率较高的缘故[17]; 虽然海蜇干基的脂肪含量相对较少, 仅占1.12%, 但由于脂肪能够交联胶原蛋白纤维, 从而影响胶原蛋白的提取[18], 需要采取丙酮脱脂处理.
2.2 不同提取方法的比较
由于胶原蛋白纤维交联程度的差异, 一般不同方法获得的胶原蛋白提取率差异很大[19]. 目前常用的提取方法有: 热水浸提法、 高温酸法、 低温酸法和酶法(胃蛋白酶), 其中高温酸法和酶法的胶原蛋白提取率较高, 分别为93.52%和49.51%.
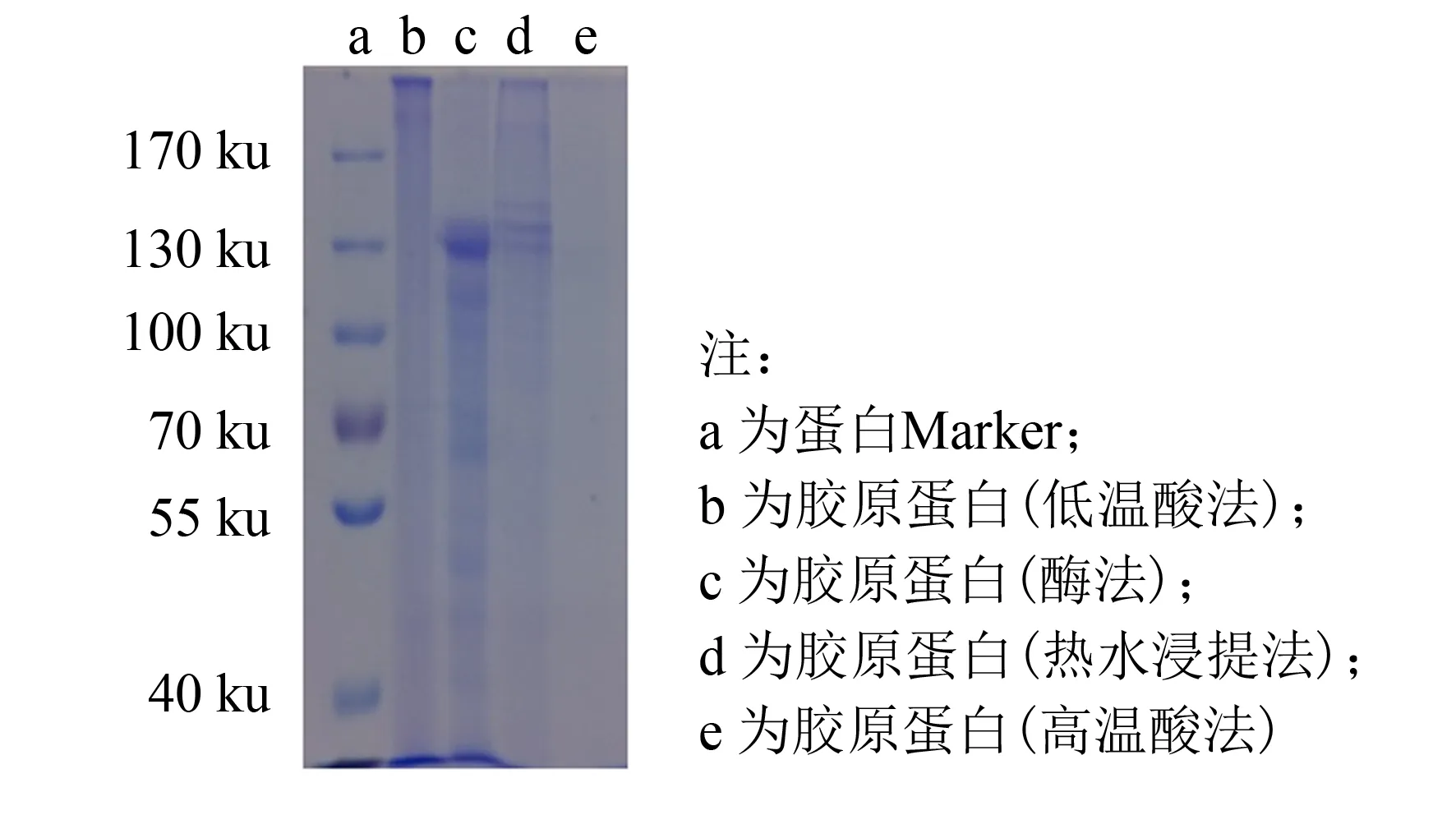
图1 不同方法提取的海蜇胶原蛋白的SDS-PAGE分析Fig.1 SDS-PAGE analysis of collagen prepared from jellyfish by different extraction methods
对不同提取方法获得的胶原蛋白粗提液进行SDS-PAGE分析, 结果见图1. 泳道b的蛋白条带在浓缩胶和分离胶之间, 这是因为酸溶性胶原蛋白拥有完整的结构[20], 不易与SDS结合, 而且其相对分子质量在300 ku以上, 难以穿过凝胶孔隙; 泳道c的条带主要集中在130 ku左右, 这是由于酶促溶性胶原蛋白虽然保留了完整的三螺旋结构, 但其端肽已被切除[21], 在高温及SDS的作用下易发生解旋, 生成相对分子质量约为130 ku的肽链; 泳道d显示出3条明亮条带, 这可能是在高温下胶原蛋白的结构已经被破坏, 3条肽链发生不规则离散, 但其单链保留了较为完好的端肽[22], 故相对分子质量略大于泳道c的主要条带; 泳道e上未有明显蛋白条带, 这是由于在高温和酸的作用下, 胶原蛋白变性为明胶, 并被酸解为多肽片段[23]. 因此酶法是海蜇胶原蛋白的最佳提取方法.
2.3 不同蛋白酶提取效果的比较
在特定蛋白酶作用下, 被切去未交联端肽的胶原蛋白易溶于水或稀酸溶液[24]. 目前较为常用的提取用酶为胃蛋白酶[25]、 中性蛋白酶[26]、 碱性蛋白酶[27]和胰蛋白酶[28]等. 考察不同蛋白酶对胶原蛋白提取率的影响, 结果显示胃蛋白酶促溶性胶原蛋白的含量明显高于其他蛋白酶, 其提取率可达84.55%. 因此确定胃蛋白酶作为海蜇胶原蛋白的酶法提取用酶.
2.4 酶法提取海蜇胶原蛋白工艺优化
2.4.1 最佳酸种类的选择
不同酸种类对胶原蛋白提取效果的促进作用差异很大[29]. 在相同浓度下, 以盐酸为提取剂的胶原蛋白提取率最高, 达93.84%; 柠檬酸次之(91.11%), 乳酸为63.75%, 冰醋酸最低, 为4.40%.
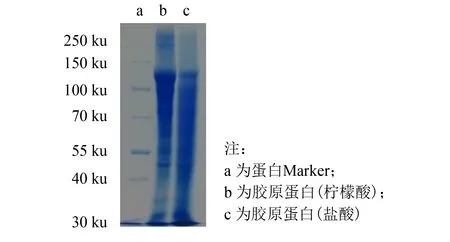
图2 不同酸种类提取的海蜇胶原蛋白的SDS-PAGE分析 Fig.2 SDS-PAGE analysis of collagen prepared from jellyfish by different acids
进一步对盐酸和柠檬酸提取的粗胶原蛋白液进行SDS-PAGE分析, 结果如图2所示. 盐酸提取的粗胶原蛋白在130 ku以下的蛋白条带呈均匀分布, 在200 ku以上没有明显粗条带, 说明盐酸促溶性胶原蛋白的结构已经遭到一定程度的破坏, 相比之下, 同浓度柠檬酸提取得到的胶原蛋白在构象上更为稳定, 因此确定柠檬酸作为下一步实验用酸.
2.4.2 最适提取温度的确定
有研究表明[30], 不同温度下提取的胶原蛋白的成纤维能力和热变性温度具有一定差异. 综合比较不同提取温度对胶原蛋白提取率的影响, 如表1所示, 胶原蛋白提取率随提取温度的升高而升高, 温度大于15 ℃时胶原蛋白提取率相差不大, 均大于90%.

表1 不同提取温度对胶原蛋白提取率的影响
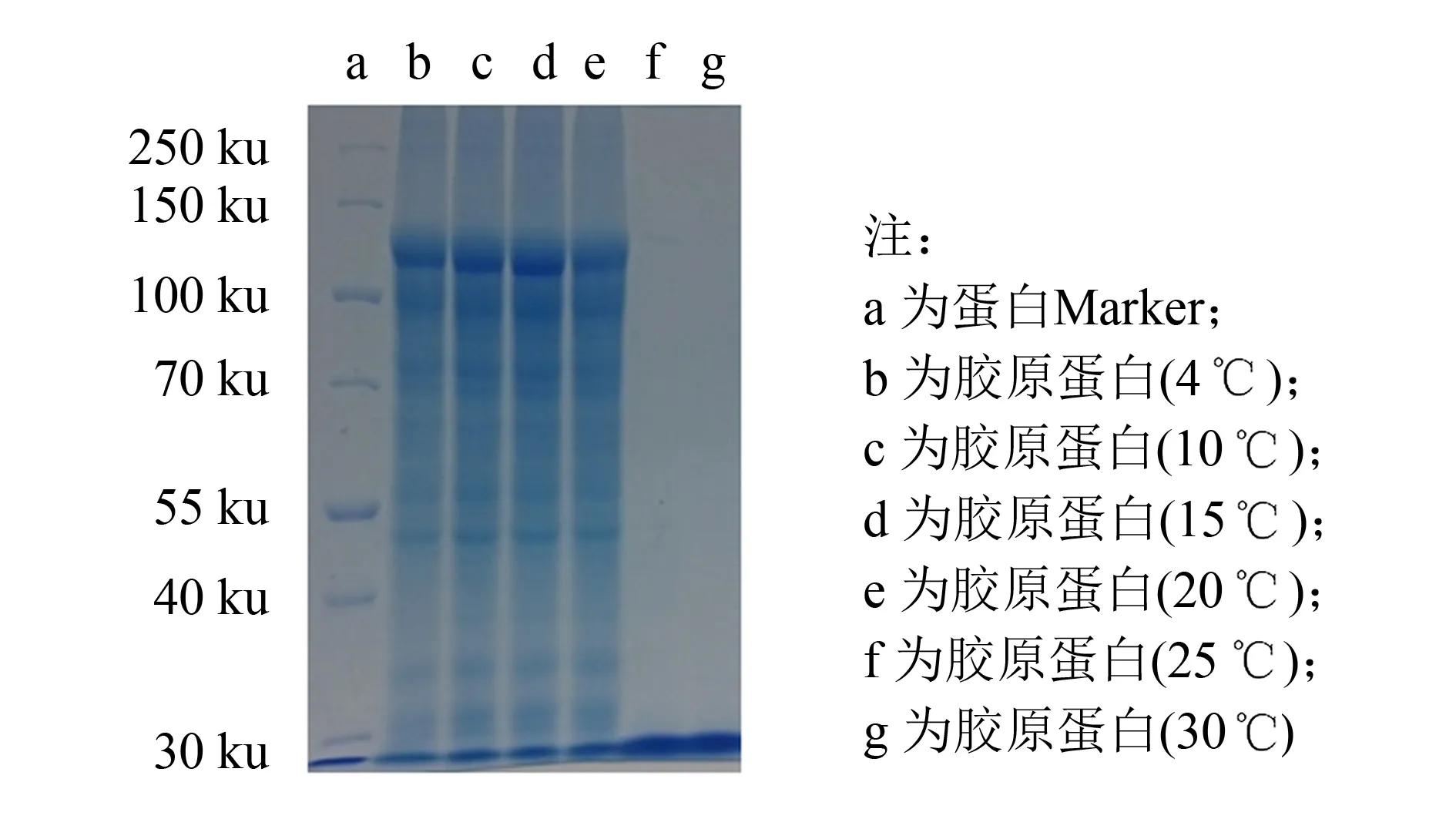
图3 不同温度提取的海蜇胶原蛋白的SDS-PAGE分析Fig.3 SDS-PAGE analysis of collagen prepared from jellyfish at different temperatures
对不同温度下获得的粗胶原蛋白液进行SDS-PAGE分析, 结果如图3所示. 在4~20 ℃下获得的电泳条带无明显差别, 胶原蛋白仍然保留了完整的结构; 在25 ℃及以上温度下提取的胶原蛋白已经变性成明胶, 且被胃蛋白酶进一步水解为多肽.
综上所述, 海蜇胶原蛋白的热变性温度在20~25 ℃之间, 在保证胶原蛋白结构完整性的前提下, 为获得更高的提取率, 最终确定15 ℃作为海蜇胶原蛋白的提取温度.
2.4.3 单因素试验
前期酶解制备胶原蛋白的单因素实验结果为: 柠檬酸浓度为0.05 mol·L-1, 提取时间为8 h, 料液比为1∶2.0, 加酶量为1.50%.
2.4.4 正交试验
根据单因素的试验结果, 设计正交试验L9(34), 考察各个因素的协同作用, 并确定海蜇胶原蛋白的最佳提取工艺条件. 正交试验因素水平见表2, 正交试验结果及方差分析见表3、 4.
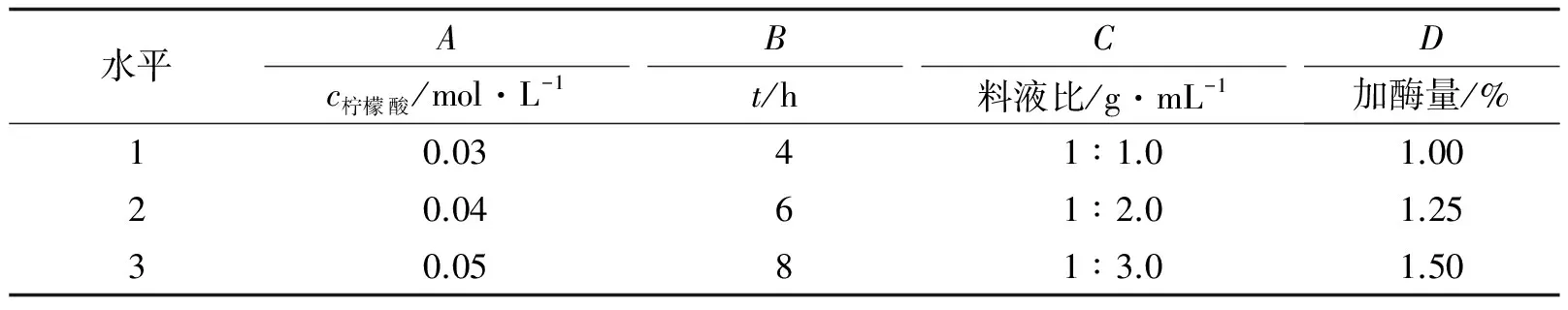
表2 正交实验因素水平表
从极差分析结果可知, 4个因素的最优理论水平组合为A3B3C2D3, 即提取时间8 h、 加酶量1.50%、 柠檬酸浓度0.05 mol·L-1和料液比1∶2.0, 在该条件下, 进行验证实验, 所得胶原蛋白提取率为97.41%.
从极差分析结果可知, 各因素对海蜇胶原蛋白提取率的主次影响为: 提取时间>加酶量>柠檬酸浓度>料液比. 其中, 料液比对海蜇胶原蛋白提取率的影响最小, 因此对柠檬酸浓度、 提取时间、 加酶量进行方差分析, 结果见表4. 从结果可知, 柠檬酸浓度、 提取时间、 加酶量对胶原蛋白的提取率影响不显著.
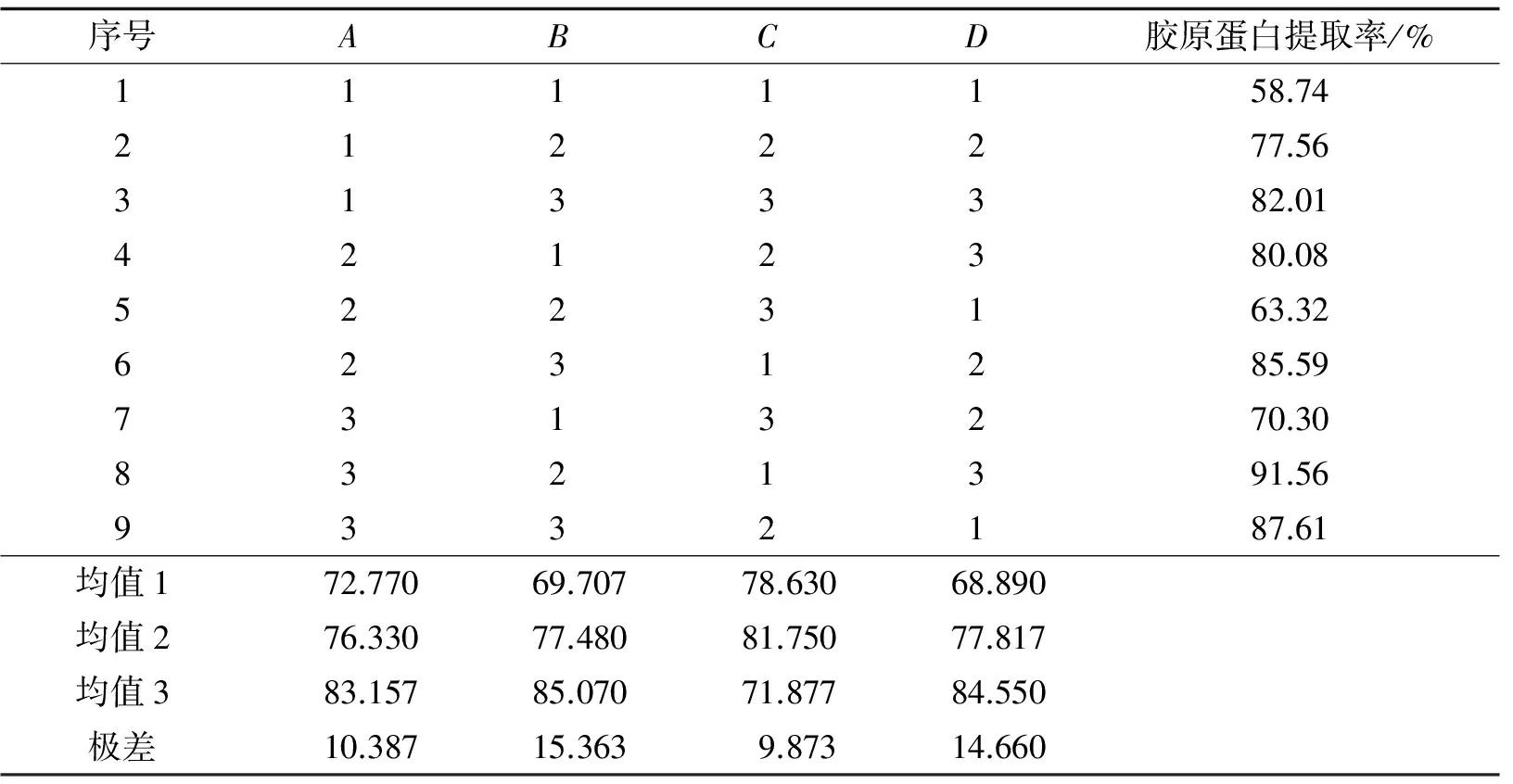
表3 正交实验结果
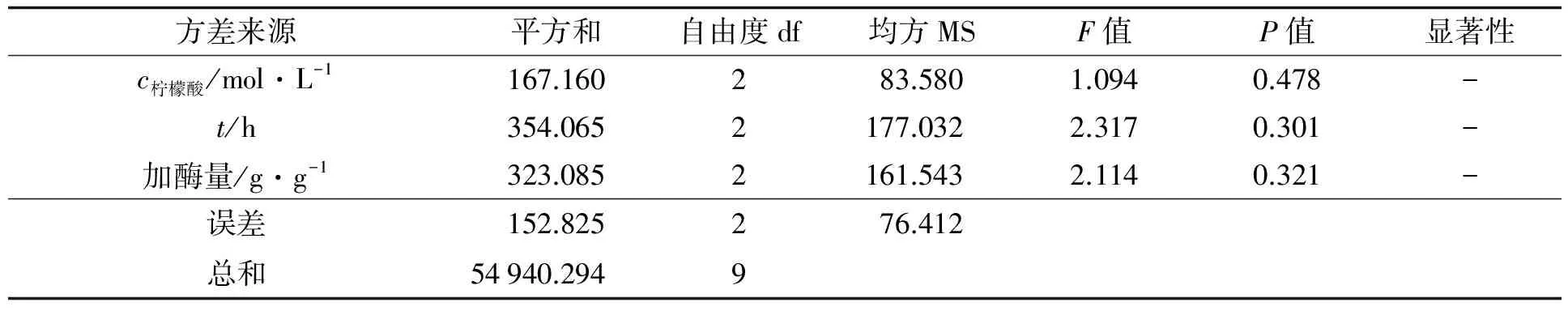
表4 正交试验设计方差分析
注: “-”表示对胶原蛋白提取率影响不显著
2.5 海蜇胶原蛋白的理化性质研究
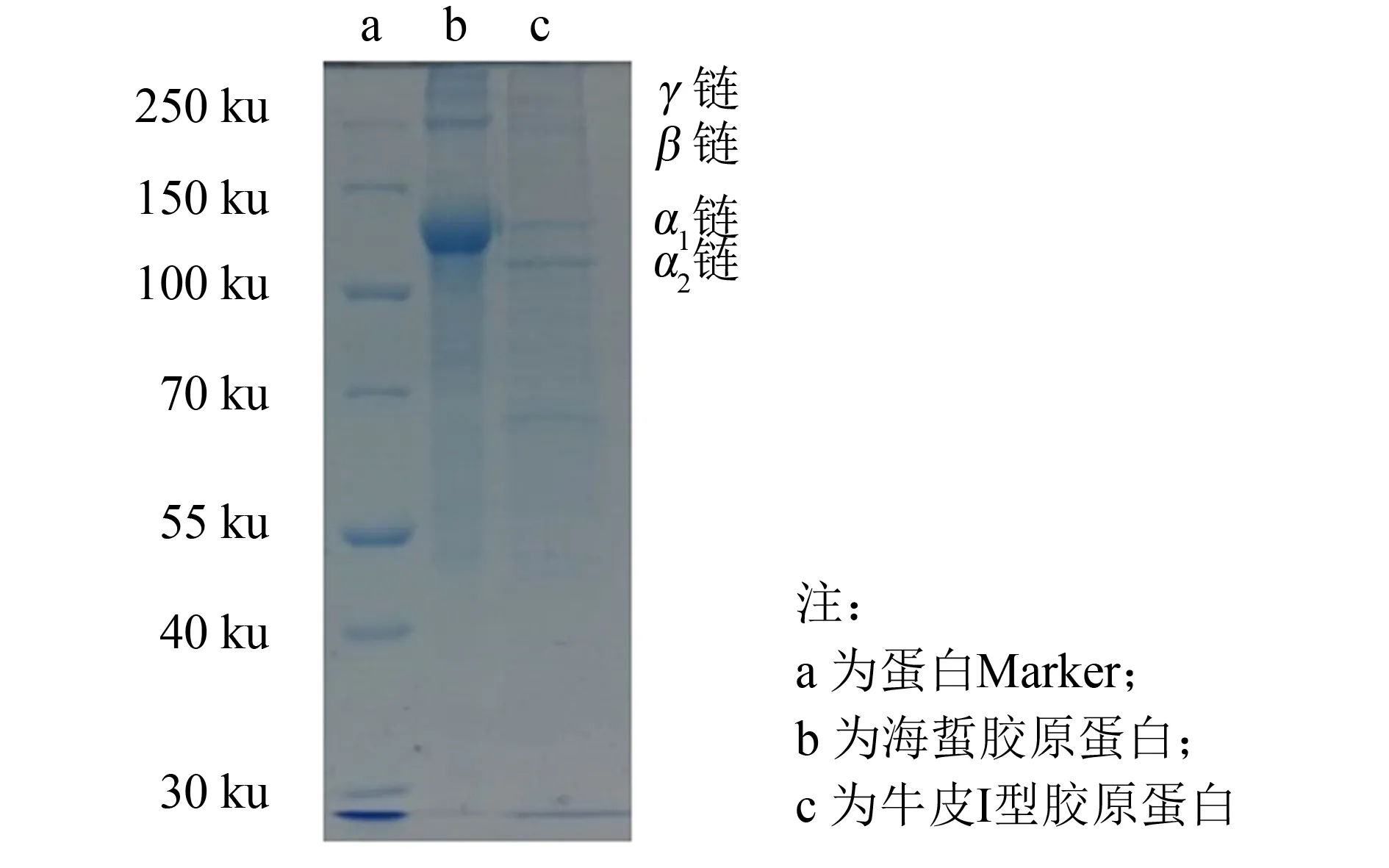
图4 海蜇胶原蛋白与牛皮I型胶原蛋白成分比较(SDS-PAGE)Fig.4 SDS-PAGE analysis of collagen compare the collagen prepared from jellyfish with collagen-I prepared from bovine skin
2.5.1 胶原蛋白类型及其相对分子质量
将纯化获得的海蜇胶原蛋白同牛皮I型胶原蛋白进行SDS-PAGE分析, 结果如图4所示. 从该电泳图谱可以看出, 提取的海蜇胶原蛋白纯度较高, 主要含有α链, 还含有少量的二聚体β链和三聚体γ链, 其单体α链相对分子质量与牛皮I型胶原蛋白的α1链相近, 约为124 ku; 未见α2链, 判断其胶原蛋白的可能结构为[α1]3.
2.5.2 氨基酸组成及质量百分含量
海蜇胶原蛋白的氨基酸组成与牛皮I型胶原蛋白类似(见表5); Gly的质量百分含量最高, 占氨基酸总量的25.16%(质量分数, 以下同); 所含氨基酸种类齐全, 人体必需的多种氨基酸占总氨基酸的21.46%; 未检测到Try和Cys的存在; 海蜇胶原蛋白的Hyp和Pro占总量的16.93%, 低于牛皮I型胶原蛋白, 与其他水产来源胶原蛋白的特征类似[18].
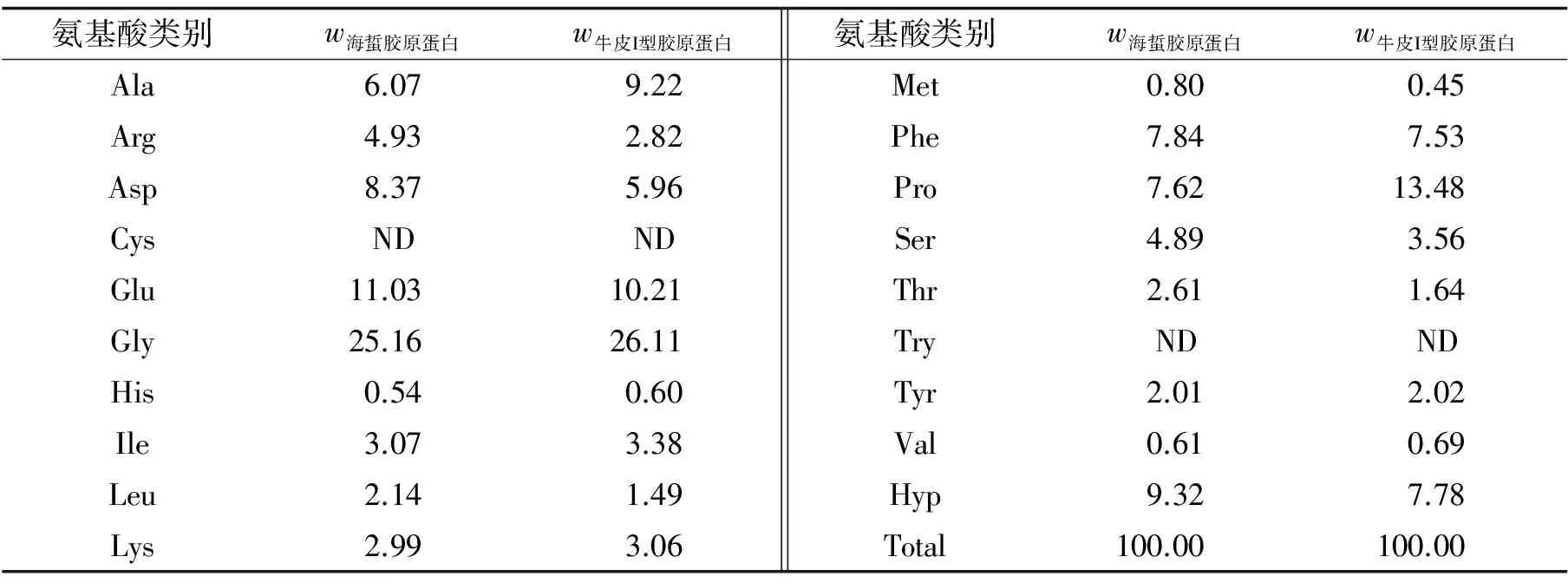
表5 海蜇胶原蛋白的氨基酸组成
注:“ND"表示未检测到
2.5.3 傅里叶红外光谱分析
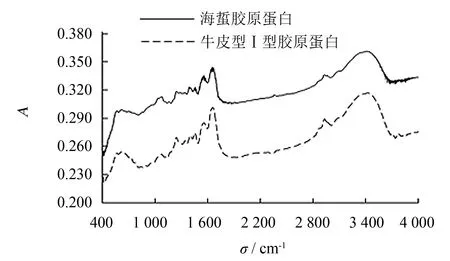
图5 海蜇胶原蛋白红外扫描图谱Fig.5 FTIR spectrogram of collagen from jellyfish
天然胶原蛋白含有独特的右手三螺旋构型, 在红外光谱的酰胺A带、 酰胺I带和酰胺III带具有明显吸收特征[31]. 图5为海蜇胶原蛋白和牛皮I型胶原蛋白的傅里叶红外扫描图谱, 其对应谱峰指认见表6. 海蜇胶原蛋白在3 416 cm-1处强且宽的吸收峰是酰胺A带的N—H伸缩振动, 与牛皮I型胶原蛋白类似, 具有明显的结构特征. 酰胺I带通常不受肽链侧基影响, 其振动频率取决于肽链构型, 与胶原蛋白的有序程度有关, 对三螺旋结构的变化非常敏感. 酰胺II带一般由异相N—H内弯曲振动和C—N伸缩振动引起, 与酰胺I带一样也是蛋白质二级结构的吸收区域, 对三螺旋结构的变化不敏感. 胶原蛋白在酰胺III带的吸收与脯氨酸侧链和特征羟脯氨酸环状C—C的伸缩振动有关, 变性胶原蛋白在酰胺III带的吸收峰会发生偏移现象; 海蜇胶原蛋白与牛皮I型胶原蛋白都在615 cm-1处出现了Hyp的特征峰.

表6 海蜇胶原蛋白的红外光谱带指认
注: “+”表示敏感, “-”表示不敏感
2.5.4 近紫外扫描光谱分析
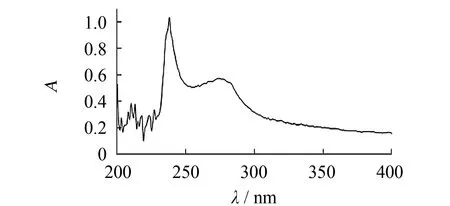
图6 海蜇胶原蛋白的近紫外吸收光谱 Fig.6 Ultraviolet absorption of collagen from jellyfish
在200~400 nm的近紫外光区对海蜇胶原蛋白进行扫描, 其光谱图如图6所示. 结果显示, 海蜇胶原蛋白含酪氨酸残基, 其分子内部存在着共轭双键, 在275 nm处有吸收峰; 海蜇胶原蛋白的最大吸收峰在238 nm处, 这主要是蛋白质肽链弯曲作用导致由肽键C=O引起的吸收峰发生红移的缘故, 与其他来源的水产胶原蛋白的近紫外吸收特征一致.
2.5.5 黏度特性及热变性温度
不同温度下胶原蛋白的黏度随时间变化情况如图7所示. 当温度在15 ℃及以下时, 胶原蛋白溶液的黏度随时间变化不明显, 说明海蜇胶原蛋白在不超过15 ℃的温度条件下结构相对稳定; 当温度超过24 ℃时, 胶原蛋白的黏度在10 min内迅速下降, 这是由于胶原蛋白在达到或超过其热变性温度时, 胶原蛋白主链开始解旋变性生成明胶, 导致黏度下降.
热变性温度是表征胶原蛋白三螺旋结构被破坏的重要温度节点. 将30 min内黏度变化50%时所对应的温度定义为热变性温度, 如图8所示, 海蜇胶原蛋白的热变性温度为22.7 ℃, 低于陆生胶原蛋白.
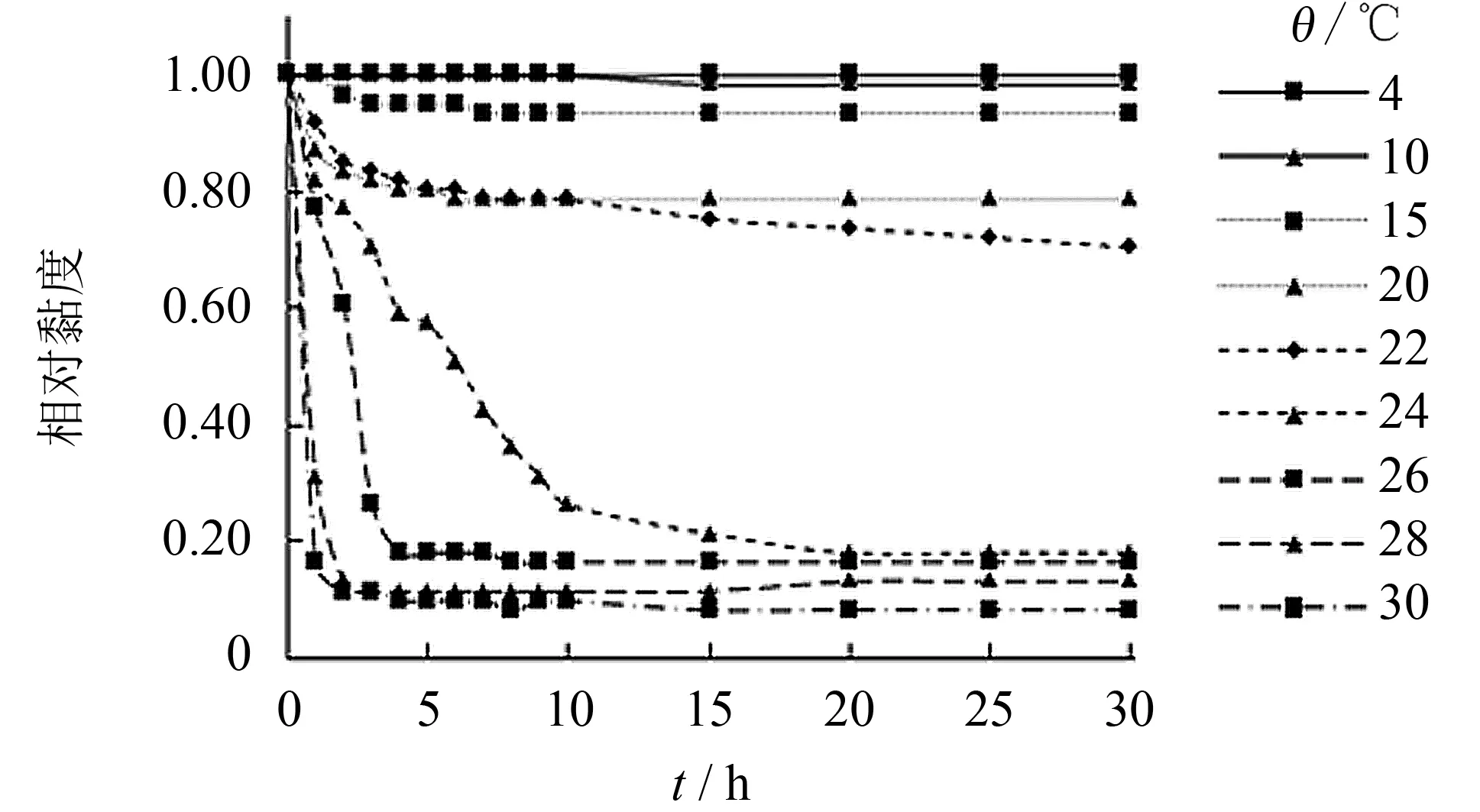
图7 不同温度下海蜇胶原蛋白黏度变化曲线Fig.7 Changes of viscosity of collagen from jellyfishat different temperatures

图8 海蜇胶原蛋白热变性温度测定Fig.8 Thermal denaturation temperature of collagen from jellyfish
在15 ℃条件下测定不同pH值对胶原蛋白黏度的影响, 结果如图9所示. 海蜇胶原蛋白黏度随pH值的升高呈先上升后下降的趋势, 当 pH值在6~9之间, 溶液黏度无明显变化, 表明海蜇胶原蛋白的等电点pI值在6~9之间, 在该pH值范围内胶原蛋白分子呈中性, 整个分子趋于卷曲状态, 因此表现出较低的黏度值.
图10为海蜇胶原蛋白质量浓度对其黏度的影响曲线, 当质量浓度为6 mg·mL-1时, 溶液的黏度达到最大值, 之后随浓度的继续升高再无明显变化, 这是由于胶原蛋白作为聚电解质, 相对分子质量较大, 溶液中含有大量多聚体, 分子链之间的缔合作用和水合作用较大, 造成了低浓度时较小浓度的增大引起黏度较大的变化.
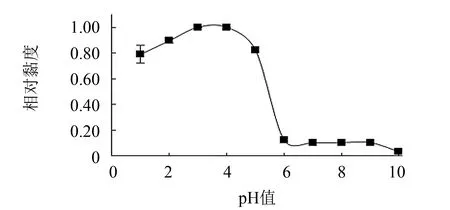
图9 pH值对胶原蛋白黏度的影响Fig.9 Effect of pH value on viscosity of collagenfrom jellyfish
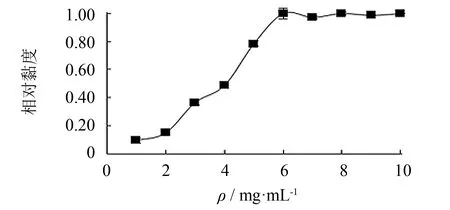
图10 质量浓度对胶原蛋白黏度的影响Fig.10 Effect of mass concentration on viscosity of collagen from jellyfish
2.5.6 溶解性特征
图11为NaCl质量浓度对胶原蛋白溶解性的影响, 由图11可知, 在NaCl质量浓度低于0.7 mg·mL-1时, 海蜇胶原蛋白的溶解度较为稳定; 当NaCl质量浓度大于0.8 mg·mL-1时, 溶解度随NaCl质量浓度的升高急剧下降, 在NaCl质量浓度为1.0 mg·mL-1时基本析出. 这是由于在低质量浓度下, Na+与胶原蛋白缔合, 使胶原蛋白所带正电荷数增加, 分子间斥力增大, 从而具有较大的溶解度; 当NaCl质量浓度较高时, 盐离子又破坏了胶原蛋白周围的水化层, 使之发生盐析现象.
图12 为pH值对胶原蛋白溶解度的影响, 从图12可知, 在pH值为3~4时, 海蜇胶原蛋白的溶解度最高; 当pH值大于5时, 其溶解度随pH值升高急剧下降, 在pH值为6~9范围内, 胶原蛋白的溶解度最低; 当pH值为10时, 溶解度又有明显的上升趋势. 这可能是高浓度的碱对胶原蛋白的结构产生了一定程度破坏, 使得部分胶原蛋白变性形成明胶溶于溶剂中, 从而表现出溶解度上升的假象.
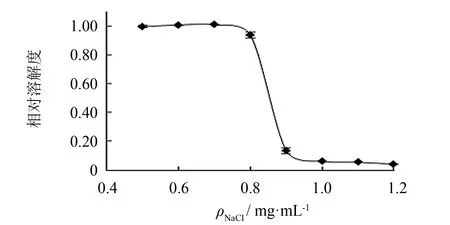
图11 NaCl质量浓度对胶原蛋白溶解性的影响Fig.11 Effect of NaCl mass concentration on solubility of collagen from jellyfish
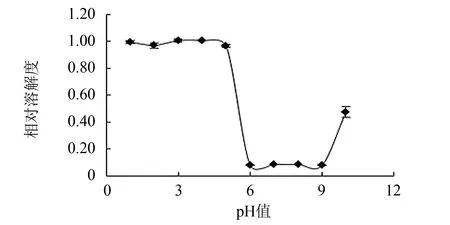
图12 pH值对胶原蛋白溶解度的影响Fig.12 Effect of pH value on solubility of collagen from jellyfish
3 结语
研究利用海蜇加工下脚料制备胶原蛋白, 建立海蜇胶原蛋白的提取工艺, 并对获得的海蜇胶原蛋白理化性质进行分析, 得到以下结果.
1) 通过单因素试验和正交试验确定海蜇胶原蛋白的提取工艺参数为: 提取温度15 ℃、 柠檬酸浓度0.05 mol·L-1、 胃蛋白酶添加量1.5%、 料液比1∶2.0和提取时间8 h, 胶原蛋白提取率可达97.41%. SDS-PAGE电泳图谱显示: 海蜇胶原蛋白主要含相对分子质量约为124 ku的α1链, 还有少量二聚体β链和三聚体γ链, 初步判断其结构为[α1]3.
2) 海蜇胶原蛋白的氨基酸组成分析表明, 其Gly质量百分含量最高, 占氨基酸总量的25.16%, Pro和Hyp的质量百分含量分别为7.62%和9.32%, 人体必须氨基酸总量占总氨基酸的21.46%, 未检测到Cys和Try; 傅里叶红外光谱及近紫外光区扫描结果表明: 提取的海蜇胶原蛋白保留了较为完整的三螺旋结构.
3)海蜇胶原蛋白的黏度及溶解性特征显示: 在pH≤1和pH≥10的范围内, 其结构开始趋于不稳定, 表观黏度下降, 表观溶解度上升; 在pH值3~4范围内, 黏度和溶解度最大, 在pH值6~9范围内, 黏度和溶解度最小, 表明其等电点pI值在6~9之间; 黏度随温度的升高而下降, 其热变性温度为22.7 ℃; 黏度还随其质量浓度的增加而升高, 在6 mg·mL-1时达到最大并趋于稳定; 在大于1.0 mg·mL-1的NaCl溶液中海蜇胶原蛋白基本析出.
参考文献:
[1] 蒋挺大. 胶原与胶原蛋白[M]. 北京: 化学工业出版社, 2006: 5-10.
[2] SHANMUGAM G, REDDY S M M, MADHAN B,etal. Method of addition of acetonitrile influences the structure and stability of collagen[J]. Process Biochemistry, 2014, 49(2): 210-216.
[3] HULMES D J. Building collagen molecules, fibrils and suprafibrillar structures[J]. Journal of Structural Biology, 2002, 137(1/2): 2-10.
[4] 何静. 胶原蛋白在生物医药工程中的应用研究进展[J]. 河南科技, 2015, 10(5): 104-105.
[5] SINGH P, BENJAKUL S, MAQSOOD S,etal. Isolation and characterisation of collagen extracted from the skin of striped catfish(Pangasianodonhypophthalmus)[J]. Food Chemistry, 2011, 124(1): 97-105.
[6] 刘磊. 海蜇胶原蛋白的提取、 纯化及理化性质研究[D]. 无锡: 江南大学, 2009: 11-14.
[7] 陈丽清. 超高压技术制备高品质明胶及其机理研究[D]. 重庆: 西南大学, 2013: 2-20.
[8] OKAZAKI E, OSAKO K. Isolation and characterization of acid-soluble collagen from the scales of marine fishes from Japan and Vietnam[J]. Food Chemistry, 2014, 149(3): 264-270.
[9] 常桂英. 榆耳胶原蛋白提取工艺研究[J]. 江苏农业科学, 2012, 40(4): 269-271.
[10] 刘克海, 秦玉青, 徐海波, 等. 鱿鱼皮胶原蛋白的提取及在化妆品中的应用[J]. 水产科学, 2008, 27(8): 411-413.
[11] 中华人民共和国商业部粮食储运局. 粮食、 油料检测 水分测定法: GB/T 5497—1985[S]. 北京: 中国标准出版社, 1985.
[12] 中华人民共和国商业部粮食储运局. 粮食、 油料检测 灰分测定法: GB/T 5505—1985[S]. 北京: 中国标准出版社, 1985.
[13] 中华人民共和国商业部粮食储运局. 粮食、 油料检验 粗脂肪测定法: GB/T 5512—1985[S]. 北京: 中国标准出版社, 1985.
[14] 中华人民共和国商业部粮食储运局. 食品中蛋白质的测定: GB/T 5009.5—2003[S]. 北京: 中国标准出版社, 2003.
[15] MICHEL D, GILLES K A, HAMILTON J K. Colorimetric method for determination of sugars and related substances[J]. Analytical Chemistry, 1956, 28(3): 250-356.
[16] 周新. 罗非鱼皮明胶优化提取及其物化特性研究[D]. 长沙: 湖南农业大学, 2012: 18-30.
[17] 毕琳. 刺参(Stichopusjaponicus)体壁胶原蛋白理化性质和生物活性研究[D]. 青岛: 中国海洋大学, 2006: 25-40.
[18] 李国英. 胶原化学[M]. 北京: 中国轻工业出版社, 2013: 5-12.
[19] ZhANG J, DUAN R, HUANG L,etal. Characterisation of acid-soluble and pepsin-solubilised collagen from jellyfish (CyaneanozakiiKishinouye)[J]. Food Chemistry, 2014, 150(2): 22-26.
[20] 李八方, 郭鸣, 侯虎, 等. 胡子鲶鱼皮酸溶性胶原蛋白的理化性质研究[J]. 现代食品科技, 2013(11): 2580-2585.
[21] 肖枫, 朱文学, 康怀彬, 等. 正交试验优化黄河鲤鱼鳞酶促溶性胶原蛋白提取工艺[J]. 食品科学, 2015, 36(12): 60-64.
[22] 贾雪婷, 孙佳明, 张辉. 从生物体中获得胶原蛋白的研究进展[J]. 吉林中医药, 2013, 33(10): 1034-1035; 1048.
[23] 周梦柔. 猪皮胶原蛋白明胶化过程中的微观结构变化研究及明胶提取率预测模型的构建[D]. 重庆: 西南大学, 2014.
[24] MCCLAIN P E, WILEY E R, REYNOLDS P R,etal. Isolation and characterization of papain solubilized collagen from bovine spinous process cartilage[J]. International Journal of Biochemistry, 1977, 8(5): 381-387.
[25] ADIBZADEH N, AMINZADEH S, JAMILI S,etal. Purification and characterization of pepsin-solubilized collagen from skin of sea cucumberHolothuriaparva[J]. Applied Biochemistry and Biotechnology, 2014, 173(1): 143-154.
[26] 王燕, 付万冬, 郑斌. 酶法提取鱿鱼皮胶原蛋白[J]. 食品科技, 2011, 36(6): 150-155.
[27] 张根生, 范爱月, 韩冰, 等. 响应曲面法优化碱性蛋白酶提取林蛙残体胶原蛋白[J]. 食品科学, 2011, 32(2): 93-97.
[28] 汪海波, 梁艳萍, 汪海婴, 等. 草鱼鱼鳞胶原蛋白的提取及其部分生物学性能[J]. 水产学报, 2012, 36(4): 553-561.
[29] YAMAMOTO T, UEMURA K, SAWASHI Y,etal. Optimization of method to extract collagen from “Emperor” tissue of soft-shelled turtles[J]. Journal of Oleo Science, 2016, 65(2): 169-175. DOI: 10.5650/jos.ess15220.
[30] LIN Y K, DENG C L. Effects of pepsin digestion at different temperatures and times on properties of telopeptide-poor collagen from bird feet[J]. Food Chemistry, 2006, 94(4): 621-625.
[31] DOYLE B B, BENDIT E G, BLOUT E R. Infrared spectroscopy of collagen and collagen-like polypeptides[J]. Biopolymers, 1975, 14(5): 937-957.
