光质对桔梗根生长及有效成分积累的影响
2018-04-24潘婷婷王新军
吴 珍,潘婷婷,王新军
(商洛学院 生物医药与食品工程学院,陕西 商洛 726000)
桔梗[Platycodongrandiflorus(Jacq).A.DC.]为桔梗科植物,是一种药、食、赏兼用植物[1]。常以根入药,含桔梗皂苷、多糖等多种活性成分,具有多种药理活性[2]。桔梗皂苷中含量较高的是桔梗皂苷D[3],属五环三萜类皂苷[4],萜类化合物的合成是由甲羟戊酸途径或甲基赤藓醇磷酸途径合成[5],三萜皂苷是一类重要的植物次生代谢产物,既可增强植物自身抗病、虫害能力[6],也是很多中药材药用有效成分的重要组分。桔梗含铜、铁、锌、锰等22种微量元素,微量元素的量和比例不仅影响桔梗的药效,也会相互影响或直接参与作用[7], 如Zn、Cu是人体必需的微量元素,是SOD等多种酶的辅基,可通过体内的酶系统间接发挥对机体代谢功能的协调和抑制,提高机体的免疫功能,不同中药材种植在不同环境下其体内Cu/Zn比值不同,药效也产生差异。
桔梗与其他中药材一样,其有效成分皂苷也是次生代谢产物,是植物在长期演化过程中与环境(生物的和非生物的)相互作用的结果,外界环境能影响次生代谢产物的积累[8]。光是植物生命活动的重要环境因子之一,桔梗等中药材生长于自然环境时,周围高大的林木的遮蔽不仅改变了林下光照强度[9],也改变了林下的光质,而光质是不同波长的光谱,作为外界信号通过信号转导影响着植物内部的生理生化变化,从而间接地对植物的形态建成、生理代谢、光周期反应、生长发育及药用植物有效成分的含量起重要的调节作用[10]。光质对植物的次生代谢过程的影响及对有效成分的影响则因植物种类不同而有所差异,如黄光处理下三七单株总皂苷产量最高,有助于促进黄芪的干物质积累和有效成分的积累;红光能够提高根中差向紫杉醇的含量,黄光能显著提高根中紫杉醇及差向紫杉醇的含量,蓝光能显著提高根中紫杉醇的含量;红光+蓝光处理下,丹参中丹酚酸B含量显著提高;白光更有利于三七有效成分的积累,黄光处理下三七单株总皂苷产量最高[11-13],光质也影响黄酮类、花色素等合成[14],目前有关光质对桔梗生长及皂苷和多糖影响的研究鲜见报道。
本研究以2年生桔梗植株为试验材料,测定了在不同光质(红、黄、绿、紫、蓝)处理下的部分生长指标及产量、皂苷含量、多糖含量、Cu、Zn的含量及Cu/Zn比值,同时对产生差异的原因进行分析,探索皂苷、多糖等有效成分在桔梗体内累积的规律,对桔梗栽培环境的选择和栽培管理措施的选用具有指导意义,同时也可为中药材质量控制提供理论依据。
1 材料与方法
1.1 材料
桔梗来自商洛学院试验地栽植的2年生桔梗。
试验用紫、红、黄、绿和蓝色滤膜(遮光膜购于广州市乐迪灯光设备厂生产的光学色纸)模拟不同光质的光,将各色滤膜覆盖在用直径0.6 cm钢筋做成的支架(70 cm×120 cm×80 cm)上,膜各边下端距地面20 cm,顶端两边不封口并用直径2.0 cm的竹棍支开,这样有利于膜内空气流通和防止膜内侧凝结水珠。将每个处理设3个平行置于不同光质的膜下并随机排列。
1.2 材料处理
将2年生桔梗在不同滤膜下生长3个月后,在秋季将不同光质下新鲜桔梗根采收,洗净,刮去外皮,切片,一半置于80℃烘箱中杀青20 min,然后置于60℃烘箱中烘至恒重[15],粉碎过60目筛,为测定桔梗多糖含量备用;另一半直接置于80℃烘箱中烘至恒重,粉碎过60目筛,备用。
1.3 测定项目及方法
1.3.1 桔梗根生长性状及鲜重测定 测定新鲜桔梗根部性状指标[16]:主根粗(cm):用游标卡尺测量主根最大直径处;主根长(cm):用直尺测量主根从芦头到根尖(直径0.1 cm处)之间的长度;侧根数(个):测定从主根上发出的直径达到0.1 cm以上的侧根个数;单根鲜重(g):除去泥土,放在电子天平上称根部鲜重。每处理采样3株,进行各指标测定。
数据用Excel 2007处理,用Graphpad Prism 5软件进行方差分析。
1.3.2 桔梗多糖、皂苷及Cu、Zn含量测定
1.3.2.1 皂苷的提取及含量测定 1)皂苷提取:甲醇超声提取法[17]
精确称取桔梗干粉1.00 g,过60目筛,置具塞锥形瓶中,加入甲醇20 mL溶解,超声提取,温度45℃,时间30 min,重复3次,提取结束后放置至室温,抽滤,得滤液,浓缩,加15 mL乙醚萃取2次,弃去醚层,水层加入15 mL、10 mL正丁醇萃取2次,合并正丁醇液,减压回收得到沉淀物,称取质量,取5 mg用甲醇定容至50 mL备用。
2)皂苷含量测定:用桔梗皂苷标准品精确制备1 mg/mL的标准品溶液,按表1中的标准系列制备梯度溶液,依据香草醛-硫酸比色法操作步骤测定472 nm吸光度,制作标准曲线并进行各样品皂苷含量测定。
1.3.2.2 多糖的提取及含量测定 1)多糖提取:超声波辅助水提法[18]
精确称取桔梗干粉1.00 g,过60目筛,按料液比1∶30加入溶剂,放置一段时间,采用60℃超声波处理1 h,放置至室温,抽滤,得滤液,减压浓缩,加入3倍体积的无水乙醇出现絮状物,放在4℃冰箱中,静置24 h,倒掉上清液,抽滤,将滤纸烘干,准确称取样品溶解于蒸馏水中,并定容至浓度在200 μg/mL,备用。
2)多糖含量测定:配制1.0 mg/mL的葡萄糖标准液,再按表1中的标准系列制备梯度溶液,用硫酸-苯酚比色法测定标准490 nm吸光度。样品含量测定条件与做标准曲线相同。
1.3.2.3 Cu、Zn含量的测定[19]称取适量干桔梗根,置于三角瓶,加入5 mL浓硝酸,用封口膜封口静置过夜。第2天用小火加热直至无NO2气体产生,自然冷却,加入3 mL浓硫酸及5 mL浓硝酸后继续消化直至冒白烟,自然冷却后,加入5 mL HNO3及2 mL高氯酸(HClO4),继续消化到白烟冒完,自然冷却后测量取其体积,摇匀,备用,在样品消化同时还应做空白消化液一份。分别制备50 μg/mL的Cu铜标准溶液及Zn标准溶液,用火焰原子吸收分光光度计制作标准曲线并进行样品测定。
1.4 标准系列
桔梗皂苷、多糖、Cu、Zn标准曲线制作按表1、表2系列进行。

表1 皂苷、多糖标准系列及测定的波长

表2 微量元素标准系列及测定波长
2 结果与分析
2.1 不同光质处理对桔梗根生长性状影响
由表3可以看出,不同滤膜处理对桔梗生长及产量有不同影响,红膜处理下桔梗的主根鲜重、主根粗和侧根数均最高,绿膜处明显促进了桔梗主根的伸长,与对照组(太阳光)相比,红膜处理下桔梗主根鲜重、主根粗和侧根数分别提高了26.92%、22.48%、45.71%,蓝膜处理显著降低了桔梗的重量和主根直径,蓝膜下桔梗的侧根数也明显减少,紫、黄、绿膜对桔梗根的性状也有影响,黄膜下桔梗的主根鲜重显著降低,侧根数显著增多。
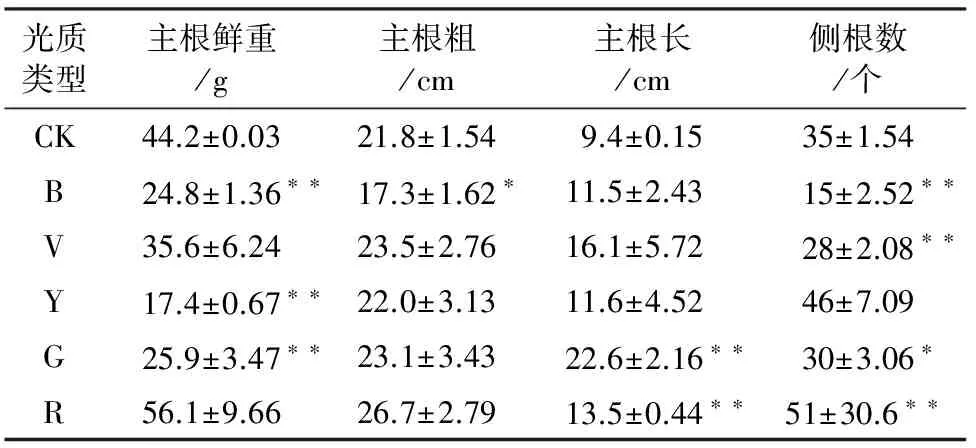
表3 不同光质下桔梗的根长、侧根数及鲜重
注:CK:对照、B:蓝光、V:紫光、Y:黄光、G:绿光、R:红光;表内数据使用Graphpad Prism 5进行方差分析,*表示差异显著(P≤0.05),**表示极显著(P≤0.01)。表4、表5同。
2.2 不同光质处理对桔梗皂苷和多糖含量的影响
由表4可知,不同滤膜处理对桔梗根中皂苷含量影响不同,大小依次为红>对照>绿>黄>蓝>紫,红膜处理下桔梗皂苷含量提高了3.27%,但未达显著水平,蓝膜与紫膜处理下桔梗皂苷含量显著降低,皂苷的含量分别降低了25.59%、32.14%,黄膜和绿膜处理对桔梗皂苷含量无显著影响。
由表4可知,在不同光质下处理对桔梗的多糖含量均有影响,多糖含量依次为蓝>红>绿>对照>紫>黄,与对照组相比,蓝、红和绿膜处理组的桔梗多糖含量均显著高于对照组,桔梗多糖含量分别高了36.82%、33.21%、18.28%,黄膜处理下桔梗多糖含量显著降低21.04%,紫膜对桔梗多糖含量无明显影响。
2.3 不同光质处理对桔梗Cu、Zn含量及Cu/Zn比值的影响
由表5可知,在不同光质处理均显著提高了桔梗中Cu含量,Cu含量由高到低依次为紫>黄>红> 蓝 >绿>对照,与对照组相比,Cu含量分别提高了28.13%、27.74%、24.48%、20.49%、5.63%;而光质处理对桔梗中Zn含量的也有显著影响,Zn含量由高到低依次为紫>红>蓝>对照>黄,除黄膜处理组中Zn含量降低了2.32%外,其余处理组中Zn含量均明显高于对照组,Zn含量分别高于对照组47.09、36.91%、31.83%、18.11%;蓝膜处理对桔梗的Cu/Zn比值明显影响,黄膜处理显著提高Cu/Zn比值,绿膜、紫膜明显降低了Cu/Zn比值,红膜也可降低Cu/Zn比值,Cu/Zn比值由低到高依次是绿<紫<红<对照<蓝<黄。
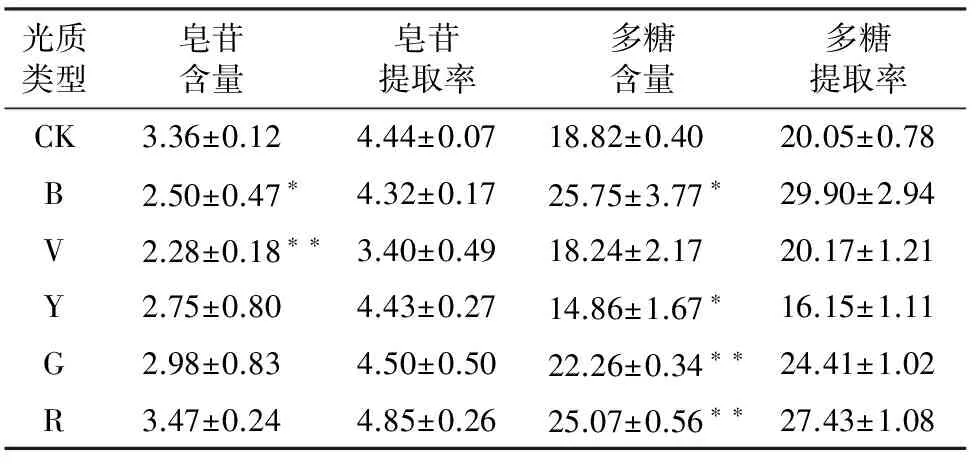
表4 不同光质处理下桔梗根中皂苷和多糖含量
3 结论与讨论
本研究利用不同颜色滤膜模拟林下不同光质对桔梗进行处理,研究了光质对桔梗生长、经济产量、桔梗皂苷、桔梗多糖、Cu、Zn含量及Cu/Zn比值均有不同程度的影响。研究表明,红膜对桔梗根系的生长有显著的促进作用,蓝膜对桔梗根系的生长显著的抑制作用,红膜能促进糖代谢作用[20],更有利于可溶性糖和多糖的积累,从而促进了根系及桔梗的营养生长,这与多数研究者的红光促进营养生长的研究结果相近。
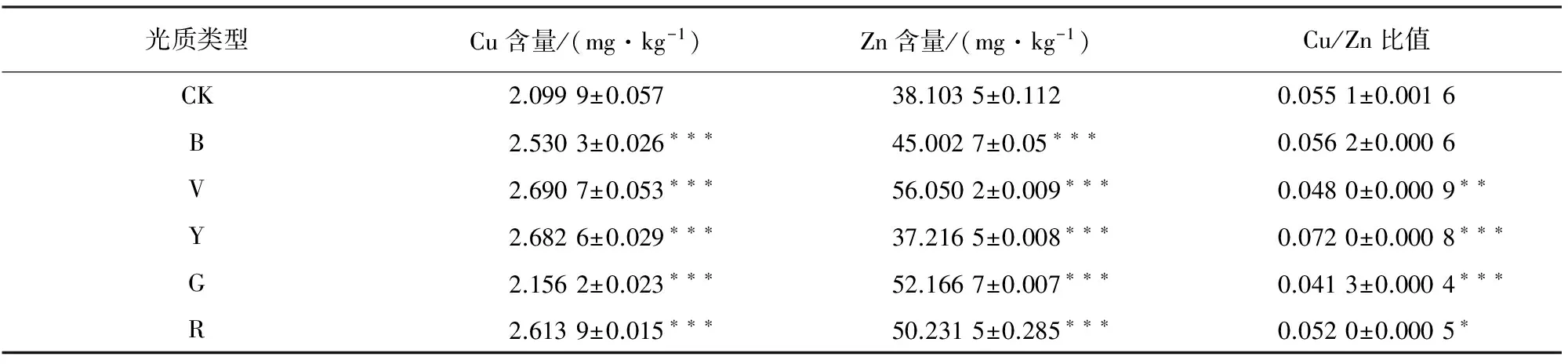
表5 不同光质处理下桔梗的Cu和Zn含量
通过本研究可知,与对照(太阳光)相比,蓝、紫膜能显著降低桔梗皂苷含量,黄膜和绿膜两种处理作用均不显著,这与李馨芸[21]在绞股蓝研究的结果相似,可能由于自然光包含了红光等单色光,桔梗皂苷的合成中调控位点不止一个,而影响皂苷合成的关键酶生理活性的环境因素也很多[22]。本研究中蓝、红和绿膜处理均显著提高桔梗多糖含量,黄膜处理显著降低了桔梗多糖含量,紫膜对桔梗多糖含量无显著影响。光质影响桔梗多糖含量的原因使多方面的,可能是由于不同光质影响着糖类物质的运输和积累,从而改变了根部可溶性糖的含量,也可能是光质的变化诱导了光敏色素对蔗糖代谢的酶的调控,促进与糖代谢相关的酶活性的提高,使更多的光合作用产物积累在桔梗根部。
不同光质对桔梗皂苷和桔梗多糖含量的影响也反映了植物的初生代谢和次生代谢的相互关系,桔梗皂苷合成是建立在初生代谢基础上的次生代谢,其产物种类与数量多少与初生代谢有直接联系。本研究中所显示的蓝光处理下桔梗多糖显著增加,而桔梗皂苷含量显著降低也正反映了皂苷的合成是建立在糖代谢等初生代谢基础上的次生代谢。通过蓝光处理可能抑制了皂苷合成的某些关键酶活性[23],也可能是蓝光能促进光合产物磷酸丙糖转化为蔗糖并进一步合成多糖,因而呈现出在蓝膜下桔梗多糖含量增高但是桔梗皂苷相对含量减少的现象。紫膜及黄膜处理下桔梗的生长、产量及有效成分的含量均比对照降低。
本研究还表明,除黄膜外,不同光质均能显著提高桔梗中的Cu、Zn 2种微量元素的含量,而且绿、紫、红膜能显著提高Zn含量,并显著降低了Cu/Zn比值,而黄光处理则显著提高了Cu/Zn比值,在桔梗生长后期,营养生长变慢,可用绿膜处理,以增加体内Zn含量,降低Cu/Zn比值。
根据其他研究者总结的桔梗生长的动态变化规律[17],结合本研究的结果,在桔梗生长的前期至中期可先用红膜处理,在后期用蓝膜或绿膜处理,既能提高鲜重及外观品质,又能促进其有效成分含量的增加药效。
光质只是影响桔梗生长和有效成分积累的重要的环境因子之一,光强度、光照时间、温度、水分、土壤肥力等也是桔梗生长及质量提高和道地性形成的关键因素,并且各环境因子之间也会相互作用或者通过信号转导途径的相互交叉影响桔梗的次生代谢,促进药材品质的提高,因此协调运用各种环境条件,才能建立适于桔梗规范化生产的栽培模式。
参考文献:
[1] 刘自刚,呼天明,杨亚丽,等.桔梗开花期花粉活力变化对其结实能力的影响[J].西北植物学报,2010,30(7):1371-1375.
LIU Z G,HU T M,YANG Y L,etal.Pollen vigor in blooming period and seed setting ofPlatycodongrandiflorum[J].Acta Bot.Boreal.-Occident.Sin.,2010,30(7):1371-1375.(in Chinese)
[2] 付文卫,窦德强,裴月湖.桔梗的化学成分和生物活性研究进展[J].沈阳药科大学学报,2006,23(3):184-191.
FU W W,DOU D Q,PEI Y H.Review on chemical components and bioactivities of Platycodon grandiflorum[J].Journal of Shenyang Pharmaceutical University,2006,23(3):184-191.(in Chinese)
[3] 国家药典委员会.中华人民共和国药典:2010年版一部[S].北京:中国医药科技出版社,2010:259-260.
[4] 邹葭霜,单进军,谢彤,等.桔梗皂苷D 的研究进展[J].中成药,2014,36(4):823-827.
[5] 潘瑞炽,王小菁,李娘辉.植物生理学[M].北京:高等教育出版社,2007.
[6] 许晓双,张福生,秦雪梅.三萜皂苷生物合成途径及关键酶的研究进展[J].世界科学技术-中医药现代化,2014,16(11):2440-2448.
XU X S,ZHANG F S,QIN X M.Research advances on triterpenoid saponins biosynthesis and its key enzymes[J].World Science and Technology/Modernization of Traditional Chinese Medicine and Materia Medica,2014,16(11):2440-2448.(in Chinese)
[7] 韩丽琴,朱志国,董顺福,等.脉通中金属元素含量的测定[J].光谱学与光谱分析,2003,23(4):797-799.
HAN L Q,ZHU Z G,DONG S F,etal.Determination of metallic elements in maitong by FAAS[J]. Spectroscopy and Spectral Analysis,2003,23(4):797-799.(in Chinese)
[8] 阎秀峰,王洋,李一蒙.植物次生代谢及其与环境的关系[J].生态学报,2007,27(6):2554-2562.
YAN X F,WANG Y,LI Y M.Plant secondary metabolism and its responsetoen vironment[J].Acta Ecologica Sinica,2007,27(6):2554-2562.(in Chinese)
[9] 毛世忠,赵博,蒋小华,等.林下不同光照条件对走马胎苗木生长及光合特性的影响[J].西北林学院学报,2016,31(1):21-24.
MAO S Z,ZHAO B,JIANG X H,etal.Influences of illumination on the seeding growth and photosynthetic characteristics of understoryAadisiagigantifolia[J].Journal of Northwest Forestry University,2016,31(1):21-24.(in Chinese)
[10] 陈祥伟,刘世琦,成波,等.不同LED光源对小白菜生长及品质的影响[J].长江蔬菜,2013(16):36-40.
CHEN X W,LIU S Q,CHENG B,etal.Effects of different LED light sources on growth and nutritional quality of pakchoi [J].Journal of Changjiang Vegetables,2013(16):36-40.(in Chinese)
[11] 苏建荣,臧传富,刘万德,等.光质对云南红豆杉生长及紫杉烷含量影响的研究[J].林业科学研究,2012,25(4):419-424.
[12] 梁宗锁,李倩,徐文晖.不同光质对丹参生长及有效成分积累和相关酶活性的影响[J].中国中药杂志,2012,37(14):2055-2060.
[13] 罗美佳,夏鹏国,齐志鸿,等.光质对三七生长、光合特性及有效成分积累的影响[J].中国中药杂志,2014,39(4):610-613.
[14] 杜丽娜,张存莉,朱玮,等.植物次生代谢合成途径及生物学意义[J].西北林学院学报,2005,20(3):150-155.
DU L N,ZHANG C L,ZHU W,etal.The synthetic way and biological significance of plant secondary metabolism[J].Journal of Northwest Forestry University,2005,20(3):150-155.(in Chinese)
[15] 赵祥升,赵禹凯,师凤华,等.不同加工方法对桔梗根中多糖含量的影响[J].中国现代应用药学,2010,27(11):983-986.
ZHAO X S,ZHAO Y K,SHI F H,etal.Effects of different processing methods on the content of polysaccharide in the root ofPlatycodongrandiflorum[J].Chinese Journal of Modern Applied Pharmacy,2010,27(11):983-986.(in Chinese)
[16] 李妍,张崇禧,魏建和,等.桔梗总皂苷含量测定方法研究[J].时珍国医国药,2009,20(7):1580-1581.
LI Y,ZHANG C X,WEI J H,etal.Determination of total saponins in Radix Platycodonis [J].Lishizhen Medicine and Materia,2009,20(7):1580-1581.(in Chinese)
[17] 金江山,严一字,王丽丽,等.桔梗根部性状生长动态研究[J].江苏农业科学,2010(2):259 -260.
[18] 于侃超,杨晓杰,李娜,等.桔梗多糖提取方法的比较[J].高师理科学刊,2014,34(3):71-73.
YU K C,YANG X J,LI N,etal.Optimization of the extraction process of polysaccharide fromPlatycodongrandiflorum[J].Journal of Science of Teachers' College and University,2014,34(3):71-73.(in Chinese)
[19] 李元敬,谢立群.火焰原子吸收光度法测定中药桔梗中锰、锌、铜、镍、钴[J].北华大学学报:自然科学版,2005,6(5):399-400.
LI Y J,XIE L Q.Determination of Manganese,Zinc,Copper,nickel and Cobalt in radix platicodi determined by flame atomic absorption spectrophotometry[J].Journal of Beihua University:Natural Science,2005,6(5):399-400.(in Chinese)
[20] 邸秀如,焦学磊,崔瑾,等.新型光源LED 辐射的不同光质配比光对菊花组培苗生长的影响[J].植物生理学通讯,2008,44(4):661-664.
DI X R,JIAO X L,CUI J,etal.Effects of different light quality ratios of LED on growth of chrysanthemum plantletsinvitro[J].Plant Physiology Communications,2008,44(4):661-664.(in Chinese)
[21] 李馨芸.光质对绞股蓝生长、光合作用及次生代谢产物积累的影响[D].吉首:吉首大学,2012.
[22] 李彦,周晓东,楼浙辉,等.植物次生代谢产物及影响其积累的因素研究综述[J].江西林业科技,2012(3):54-60.
LI Y,ZHOU X D,LOU Z H,etal.Review of plant secondary metabolites and the factors that influence its accumulation[J].Jiangxi Forestry Science and Technology,2012(3):54-60.(in Chinese)
[23] YUE C J,ZHOU X,ZHONG J J.Protopanaxadiol 6-hydroxylase and its role in regulating the ginsenoside heterogeneity inPanaxnotoginsengcells[J].Biotechnology and Bioengineering,2008,100(5):932-940.
