文冠果种皮黑色素稳定性与抗氧化活性研究
2018-04-24石长春肖建明戚建华
石长春,肖建明,戚建华,高 荣,李 剑
(1.陕西省治沙研究所,陕西 榆林 719000;2.陕西榆林毛乌素沙地荒漠生态系统国家定位观测研究站,陕西 榆林 719000;3.榆林市林业科学研究所,陕西 榆林 719000;4.西南林业大学 林学院,云南 昆明 650224)
色泽是食品的重要属性,是其品质的外在特征,生产中往往需要通过添加色素来补正食品的色调。食用色素可分为天然色素和合成色素两大类。与人工合成色素相比,天然色素安全性相对较高,且有些天然色素还具有一些保健功能。近年来人们更加崇尚天然,目前世界天然色素市场正在以2倍于人工合成色素的速度快速增长,市场前景广阔[1]。黑色素(melanin)是一类普遍存在于生物界结构复杂多样的酚类或吲哚类生物大分子色素的总称[2]。这类天然色素可以作为抗氧化剂,具有抗辐射[3]、光保护[4]、金属螯合[5]、抗氧化[6]、免疫促进[7]、抗蛇毒[8]、抗癌[9]等。
文冠果(Xanthocerassorbifolia)是我国特产的油料树种和园林绿化树种,适应性强,被我国政府确定为重点发展的生物能源树种,在北方干旱半干旱地区大面积栽培[10-12]。其种仁榨油用作生物柴油的生产原料,其黑色的种皮约占种子质量的50%,目前尚未被有效开发利用。
本研究以文冠果种皮为原料提取黑色素,研究该黑色素对pH、蔗糖、温度、光照、还原剂、氧化剂和金属离子的稳定性及其抗氧化活性,以期为文冠果种皮黑色素的开发利用供理论依据。
1 材料与方法
1.1 材料
文冠果种子采自榆林市林业科学研究所,带回实验室后手工剥取种皮,粉碎后过0.25 mm筛备用。二苯代苦味酰基自由基(DPPH·)购自Sigma公司(美国),其他所用试剂均为国产分析纯。
1.2 文冠果种皮黑色素的提取与精制
黑色素的提取参照姚增玉[13]等的方法,并略有改进。称取50 g文冠果种皮放入锥形瓶中,加入1 000 mL去离子水煮沸15 min后过滤,向滤渣中加入0.5 mol/L NaOH溶液750 mL,置于60℃水浴中提取24 h。提出液用棉布粗虑后以10 000 RPM离心10 min。收集上清液并以HCl酸化至pH 2,静置12 h后离心取沉淀。将得到的黑色素粗提物沉淀用7 mol/L HCl于100℃下水解2 h,离心并依次用纯水、乙醇、乙酸乙酯、丙酮洗涤所得沉淀,真空干燥后得到颗粒状黑色素。
1.3 文冠果种皮黑色素溶液的配制
将100 mg文冠果种皮黑色素用10 mL质量分数0.2% 的氨水在氮气保护下溶解,用旋转蒸发仪减压抽去多余氨气,直至pH 值达7.5,最后用去离子水稀释至所需浓度。
1.4 文冠果种皮黑色素的稳定性测试
1.4.1 对pH的稳定性 将文冠果种皮黑色素溶液用NaOH或HCl调至不同的pH值,测定400 nm处的吸光度。
1.4.2 对蔗糖的稳定性 4.5 mL 100 mg/L的文冠果种皮黑色素溶液与0.5 mL不同浓度的蔗糖溶液混合(混合液中蔗糖浓度分别为0.01、0.1 mg/L和1 mg/L),在室温下放置12 h后测定400 nm处的吸光度。
1.4.3 对温度的稳定性 在9支15 mL具塞试管中各加入5 mL浓度为100 mg/L的文冠果种皮黑色素溶液,加盖后分为3组,分别置于25、60℃和100℃水浴中。分别于0.5、1.5 h和3 h从每个水浴锅中取出1支试管立即用自来水冷却,测定400 nm处吸光度。
1.4.4 对紫外光的稳定性 取20 mL浓度为100 mg/L文冠果种皮黑色素溶液于直径90 mm的培养皿中,敞口置于距紫外灯管30 cm处进行照射,分别于0、0.5、1.5、3.5 h取出2 mL在400 nm波长下测其吸光度。
1.4.5 对自然光的稳定性 在2支具塞三角瓶中各加入50 mL浓度为100 mg/L的文冠果种皮黑色素溶液,加塞后将其中一支用黑布包裹,然后将它们同时置于室内自然光下,分别于5、10、15、30 d各取出2 mL在400 nm波长下测其吸光度。
1.4.6 对还原剂的稳定性 将4.5 mL浓度为100 mg/L的文冠果种皮黑色素溶液与0.5 mL不同浓度的Na2S2O3混合(混合液中Na2S2O3的浓度分别为0.01、0.1 mg/L和1 mg/L),在室温下放置12 h后测定400 nm处的吸光度。
1.4.7 对氧化剂的稳定性 同1.4.6,惟其以H2O2代替Na2S2O3。
1.4.8 对金属离子的稳定性 以金属的盐酸盐配制浓度为0.1、1 mmol/L和10 mmol/L的Na+、Mg2+、Al3+、Ca2+、Fe2+、Fe3+、Cu2+和Zn2+溶液。将4.5 mL浓度为100 mg/L的文冠果种皮黑色素溶液与0.5 mL金属离子溶液混合后在室温下放置12 h,观察是否产生沉淀,若未形成沉淀,则测定溶液400 nm处的吸光度。
1.5 文冠果种皮黑色素抗氧化活性测试
1.5.1 总抗氧化活性 总抗氧化活性采用β-胡萝卜素—亚油酸乳化液模型进行分析,方法参考Pratt[14]等的文献并略有改动。1 mL β-胡萝卜素的氯仿溶液(5.2 mg/mL)与40 mg亚油酸以及400 mg吐温20混合于烧瓶中,于40℃下旋转蒸发除去氯仿,然后缓慢加入100 mL超纯水并剧烈摇动制成乳化液。对照不加β-胡萝卜素溶液,其他同前。
在各试管中加入5 mL β-胡萝卜素-亚油酸乳化液和1 mL不同浓度的试样,摇匀后立即测定470 nm处的吸光度,作为0时刻的吸光度,然后将试管置于50℃水浴锅中温育1 h后再次测定吸光度。用于仪器调零的乳化液由5 mL不含β-胡萝卜素的乳化液和1 mL超纯水组成。

(1)

1.5.2 清除羟自由基(·OH)活性的测定 采用邻二氮菲—Fe2+氧化法测定[15]。1)依次向试管中加入0.75 mol/L邻二氮菲溶液1 mL,0.2 mmol/L pH 7.4的磷酸缓冲液2 mL和超纯水1 mL,摇匀后加入0.75 mmol/L硫酸亚铁溶液1 mL,混匀并加人0.01% H2O21 mL,37℃下反应60 min,测定536 nm处吸光度,其值称Af。2)用超纯水代替H2O2,其他同1),其吸光度称A0。3)用试样代替1)中的超纯水,其吸光度称Ax。4)用试样代替1)中的H2O2,测得的吸光度称As。
·OH 清除率=100-(As-Ax)/(A0-Af)×100%
(2)
1.5.3 清除DPPH·活性的测定 参照Sanchez-Moreno[16]的方法。0.2 mL试样与5 mL浓度为0.1 mmol/L的DPPH·甲醇溶液混合,于室温下遮光放置30 min,测定其517 nm处的吸光度值(A);以双蒸水代替样品为空白对照(A0);以0.2 mL样品与5 mL甲醇混合液为样品本底吸收校正(Aj);以甲醇调仪器零点。
DPPH·清除率=100-(A-Aj)/A0×100%
(3)
1.5.4 还原力的测定 参照M.Oyaizu[17]的方法测定。取0.25 mL不同浓度(20~500 μg/mL)的试样溶液,再加入200 mmol/L 磷酸盐缓冲液(pH=6.6)和浓度为1% 的K3Fe(CN)6溶液各2.5 mL,混合均匀后置于50℃水浴反应20 min。取出后再加入2.5 mL 10%三氯乙酸混匀,然后以650×g相对离心力离心10 min。取上层溶液5.0 mL加入蒸馏水5.0 mL,0.1% FeCl31.0 mL,测定700 nm处吸光度。
1.6 统计分析
每一个处理独立重复3次,文中数据表示为3次重复平均值±标准误差。
2 结果与分析
2.1 文冠果种皮黑色素的稳定性
2.1.1 pH和蔗糖对文冠果种皮黑色素的影响 文冠果种皮黑色素在pH<4时发生部分沉淀,其溶液的颜色随着pH值的增大而逐渐加深,从浅红棕色逐渐变为红褐色。黑色素在可见光区没有吸收峰,是一条随波长增加而吸光度减小的曲线[18-19]。可可色素的紫外可见光光谱亦是如此,国家标准中以400 nm作为测定可可色素色价的波长[20],因此本研究以400 nm处的吸光度作为评价文冠果种皮黑色素稳定性的指标。从图1A同样可以看出,400 nm处的吸光度进一步证实了文冠果种皮黑色素溶液的颜色随着pH增加而加深,类似现象在山杏种皮黑色素的研究中也有报道[19],这种颜色的变化被认为是由于黑色素中存在的羧基、酚羟基等酸性官能团的质子化—解离而引起的。
文冠果种皮黑色素溶液中加入蔗糖前后的400 nm处吸光度如图1B所示。从图中可以看出,加入蔗糖前后色素溶液的吸光度没有明显变化,说明文冠果种皮黑色素对蔗糖稳定。
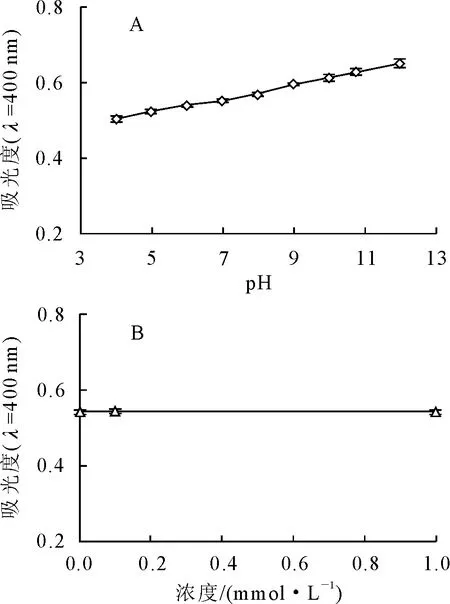
图1 溶液pH(A)和蔗糖(B)对文冠果种皮黑色素400 nm处吸光度的影响
2.1.2 温度对文冠果种皮黑色素的影响 不同温度下文冠果种皮黑色素溶液在400 nm处的吸光度随时间的变化如图2所示。从图2可以看出,在室温下文冠果种皮黑色素保持稳定,随着时间延长,其吸光度无明显变化;但加热可使其吸光度增大,且温度越高,变幅越大。植物黑色素为酚类聚合物,加热可能使部分酚羟基氧化成醌基,从而改变了色素的共轭体系,导致颜色加深。
2.1.3 光照对文冠果种皮黑色素的影响 将文冠果种皮黑色素溶液分别置于黑暗和室内自然光下放置,其400 nm处吸光度随放置天数的变化如图3(A)所示。从图3(A)可以看出,随着时间的推移,无论黑暗还是自然光照条件下,溶液吸光度都有所增大,且自然光照条件下增幅更大。从图3(B)可以看出,在紫外光照射下文冠果种皮黑色素的吸光度增大。说明自然光和紫外光对文冠果种皮黑色素具有增色作用。

图2 温度对文冠果种皮黑色素400 nm处吸光度的影响

图3 自然光(A)和紫外线(B)对文冠果种皮黑色素400 nm吸光度的影响
2.1.4 氧化剂和还原剂对文冠果种皮黑色素的影响 在文冠果种皮黑色素溶液中加入不同浓度的H2O2或Na2S2O3,其吸光度变化如图4所示。由图4可以看出,文冠果种皮黑色素可被H2O2氧化褪色,还原剂Na2S2O3对色素没有明显影响。这可能是因为黑色素具有一定的还原性。
2.1.5 金属离子对文冠果种皮黑色素的影响 由图5可以看出,在加入Na+或Mg2+后溶液吸光度没有显著变化;低浓度的Al3+、Ca2+、Fe2+、Fe3+、Cu2+和Zn2+可使溶液的吸光度增大,而高浓度时发生沉淀。说明文冠果种皮黑色素对Na+和Mg2+稳定而对Al3+、Ca2+、Fe2+、Fe3+、Cu2+和Zn2+不稳定,这可能是因为这些金属离子更容易与黑色素中的羟基、羧基等官能团络合。

图4 氧化剂和还原剂对文冠果种皮黑色素400 nm吸光度的影响
2.2 文冠果种皮黑色素的抗氧化活性
2.2.1 文冠果种皮黑色素的总抗氧化活性 β-胡萝卜素为多烯色素,亚油酸氧化产生的过氧化物能使反应体系中的β-胡萝卜素褪色,随着时间的延长吸光度逐渐减小,若在反应体系中加入抗氧化剂,则褪色速度减慢,且褪色程度与抗氧化活性呈负相关。本研究对文冠果种皮黑色素的抗氧化活性与传统的人工合成食品抗氧化剂2,6-二叔丁基对甲酚(BHT)进行对比,其结果如图6所示。由图6可以看出,2种抗氧化剂对β-胡萝卜素-亚油酸自氧化体系均有明显的抑制作用,文冠果种皮黑色素的抑制能力低于BHT。但在试验条件下,2种抗氧化剂在较高浓度(500 μg/mL)均可几乎完全抑制体系中β-胡萝卜素的氧化。

图5 金属离子对对文冠果种皮黑色素400 nm吸光度的影响

图6 文冠果种皮黑色素在β-胡萝卜素-亚油酸乳化液系统中的抗氧化效果
2.2.2 文冠果种皮黑色素的清除·OH和DPPH·活性 羟自由基活性强,可与生物体内脂类、蛋白质、DNA等多种物质反应,危害性大。DPPH·是一种比较稳定的有机自由基,对其的清除性能常被用于评价受试物降低多种自由基浓度和打断脂质过氧化链式反应的能力。文冠果种皮黑色素和BHT对·OH和DPPH·清除效果如图7所示。从图7A可以看出,2种抗氧化剂均具有清除·OH的能力。各试验浓度下,文冠果种皮黑色素对·OH的清除羟率与BHT均无显著差异。从图7B可以看出,2种抗氧化剂对DPPH·的清除能力均具有量效性。高浓度下(500 μg/mL)文冠果种皮黑色素清除DPPH·能力强于BHT。但是作为合成抗氧化剂的BHT设有使用限量,而天然抗氧化剂则无此限制。
2.2.3 文冠果种皮黑色素的还原力 还原力是物质潜在抗氧化性能的重要体现,因此还原力是抗氧化剂性能评价的重要指标之一。本研究将文冠果种皮黑色素的还原力与BHT进行对比分析,结果如图8所示,700 nm处的吸光度值越大还原能力越强。从图8可以看出,文冠果种皮黑色素的还原力高于BHT,在200 μg/mL的浓度下,前者吸光度为1.209,而后者仅为0.475。

图7 文冠果种皮黑色素清除·OH和DPPH·活性
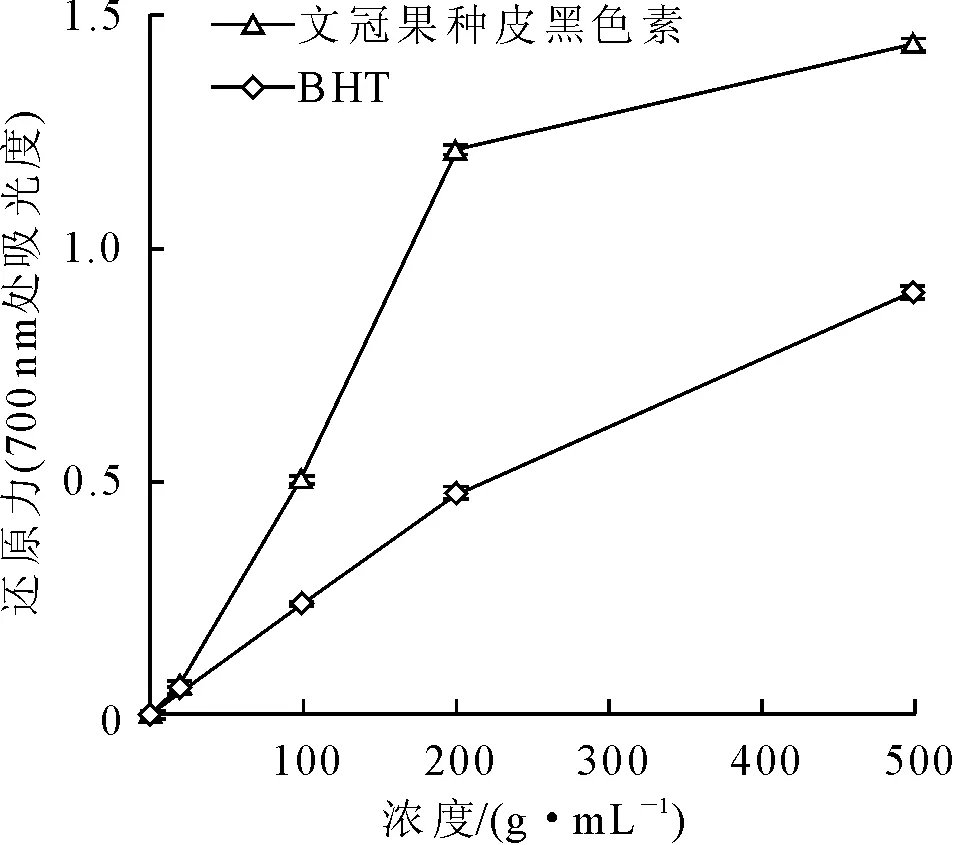
图8 文冠果种皮黑色素的还原力
3 结论与讨论
文冠果种皮黑色素在pH<4时发生部分沉淀,其溶液的颜色随着pH值的增大而逐渐加深;加热和光照线对文冠果种皮黑色素具有增色效应;氧化剂可使文冠果种皮黑色素褪色,而还原剂和蔗糖对其无显著影响;该色素对Al3+、Ca2+、Fe2+、Fe3+、Cu2+和Zn2+不稳定而对Na+和Mg2+稳定。文冠果种皮黑色素在对紫外光、自然光、还原剂等的稳定性方面与山杏种皮黑色素[9]、桂花种皮黑色素[21]并不一致,反映了它们在结构和类型上的差异。也为根据加工工艺、包装、储存和运输条件等具体情况选择合适的黑色素作为着色剂提供了可能。
文冠果种皮黑色素具有较强的抗氧化能力,其对·OH的清除羟率与BHT相当,高浓度下清除DPPH·能力强于BHT,还原能力高于BHT,但总抗氧化能力不及BHT。但山文冠果种皮黑色素兼具着色剂和抗氧化剂的双重作用,而BHT不具有着色功能;前者为天然产物,更易被受消费者接受。
植物黑色素不仅可以作为食品色素和抗氧化剂,还具有保健和治疗疾病的功能,诸如抗癌[22]、抗蛇毒[23]、免疫促进[24]、抗HIV[17]和治疗帕金森症[25]等,因而这类天然色素受到越来越多的研究人员关注,黑色食品也因其滋补、养生、抗衰老等方面的功效而引起人们浓厚的兴趣。此外,文冠果种皮为林产加工剩余物,资源丰富,廉价易得,具有可再生性。因此,文冠果种皮黑色素是一种兼具抗氧化功能甚至其他保健功能的着色剂资源,可资进一步开发利用。
参考文献:
[1] 李健,张猛,李祖明,等.类球红细菌红色素稳定性研究[J].中国食品学报,2014,14(1):80-86.
[2] SONG S,LI S,SU N,etal.Structural characterization,molecular modification and hepatoprotective effect of melanin from Lachnum YM226 on acute alcohol-induced liver injury in mice [J].Food and Function,2016,7(8):3617-3627.
[3] PACELLI C,BRYAN R A,ONOFRI S,etal.Melanin is effective in protecting fast and slow growing fungi from various types of ionizing radiation [J].Environmental Microbiology,2017,19(4):1612-1624.
[4] SANSINENEA E,ORTIZ A.Melanin:a photoprotection forBacillusthuringiensisbased biopesticides [J].Biotechnology Letters,2015,37(3):483-490.
[5] ELOBEID A S,KAMAL-ELDIN A,ABDELHALIM M A K,etal.Pharmacological properties of melanin and its function in health [J].Basic and Clinical Pharmacology and Toxicology,2017,120(6):515-522.
[6] YAO Z Y,QI J H.Comparison of antioxidant activities of melanin fractions from chestnut shell [J].Molecules,2016,21(4):487.
[7] SAVA V M,GALKIN B N,HONG M-Y,etal.A novel melanin-like pigment derived from black tea leaves with immuno-stimulating activity [J].Food Research International,2001,34(4):337-343.
[8] HUNG Y C,SAVA V,HONG M Y,etal.Inhibitory effects on phospholipase A2and antivenin activity of melanin extracted fromTheasinensisLinn [J].Life Sciences,2004,74(16):2037-2047.
[9] EL-OBEID A,AL-HARBI S,AL-JOMAH N,etal.Herbal melanin modulates tumor necrosis factor alpha (TNF-α),interleukin 6 (IL-6) and vascular endothelial growth factor (VEGF) production [J].Phytomedicine,2006,13(5):324-333.
[10] YAO Z Y,QI J H,YIN L M.Biodiesel production fromXanthocerassorbifoliain China:Opportunities and challenges [J].Renewable and Sustainable Energy Reviews,2013,24:57-65.
[11] 戚建华,姚增玉.文冠果的生殖生物学与良种繁育研究进展[J].西北林学院学报,2012,27(3):91-96.
[12] 敖妍,韩墨,赵磊磊,等.主要分布区文冠果类型的划分[J].西北林学院学报,2015,30(3):100-106.
[13] 姚增玉,赵忠,史清华,等.山杏种皮黑色素提取工艺研究[J].西北农林科技大学学报:自然科学版,2007,35(5):120-126.
[14] PRATT D E,MILLER E E.A flavonoid antioxidant in Spanish peanuts (Arachiahypogoea) [J].Journal of the American Oil Chemists' Society,1984,61(6):1064-1067.
[15] 凌关庭.抗氧化食品与健康[M].北京:化学工业出版社,2004.
[16] SANCHEZ-MORENO C.Methods used to evaluate the free radical scavenging activity in foods and biological systems [J].Food Science and Technology International,2002,8(3):121-137.
[17] OYAIZU M.Studies on products of browning reaction:antioxidative activity of products of browning reaction [J].Japanese Journal of Nutrition,1986,44(6):307-315.
[19] 姚增玉,赵忠,李科友,等.山杏种皮黑色素理化性质研究[J].食品与发酵工业,2007,33(9):37-41.
[20] GB 8818-2008食品添加剂可可壳色素[S].2008.
[21] WANG H,PAN Y,TANG X,etal.Isolation and characterization of melanin fromOsmanthusfragrans’ seeds [J].LWT-Food Science and Technology,2006,39(5):496-502.
[22] CHU M,HAI W,ZHANG Z,etal.Melanin nanoparticles derived from a homology of medicine and food for sentinel lymph node mapping and photothermalinvivocancer therapy [J].Biomaterials,2016,91:182-199.
[23] MANIVASAGAN P,VENKATESAN J,SENTHILKUMAR K,etal.Isolation and characterization of biologically active melanin fromActinoalloteichussp.MA-32[J].International Journal of Biological Macromolecules,2013,58:263-274.
[24] BRENNER S.Parkinson's disease may be due to failure of melanin in the substantia nigra to produce molecular hydrogen from dissociation of water,to protect the brain from oxidative stress [J].Medical Hypotheses,2014,82(4):503.
[25] LIN W P,LAI H L,LIU Y L,etal.Effect of melanin produced by a recombinantEscherichiacolion antibacterial activity of antibiotics [J].Journal of Microbiology,Immunology and Infection,2005,38 (5):320-326.
