8个矮牵牛品种抗旱性综合评价分析
2018-04-24关春景焦孟月张彦妮
关春景,焦孟月,张彦妮
(东北林业大学 园林学院,黑龙江 哈尔滨 150040)
矮牵牛(Petuniahybrida)属于茄科(Solanaceae)矮牵牛属(Petunia)多年生草本花卉,常作一二年生栽培,其原产于南美温带地区,有较高商业和观赏价值。矮牵牛品种繁多、花色丰富、环境适应能力强,在世界范围内被广泛栽培用于美化环境[1]。目前有研究发现,高温条件会影响矮牵牛的花量、株高、冠幅及结实等形态及生长特征,同时其各项生理指标也发生变化[2]。在盐渍干旱条件下矮牵牛叶的表皮腺毛浓密且角质层增厚,可以作为耐盐植物的选育种[3]。在寒冷条件下矮牵牛通过积累花青素和渗透调节物质抵御低温胁迫[4]。在镉(Cd)胁迫条件下,矮牵牛具有较强的抗氧化损伤能力[5]。
近些年,全球干旱日趋明显,水资源短缺加剧,社会各界大力倡导节约型园林,因此,选择节水型绿化植物显得尤为重要。矮牵牛作为园林常用的观赏花卉,对水分条件的适应能力早有研究,但对不同品种间抗旱性差异的研究较少。本研究对8种不同品种矮牵牛植株的抗旱能力进行综合评价,对矮牵牛品种在干旱条件下的应用提供参考,从中筛选抗旱性较强的矮牵牛品种,为矮牵牛在园林上的应用提供依据。
1 材料与方法
1.1 材料
8个矮牵牛品种(均为常用的绿化地被品种)的种子(4 ℃保存)见表1。
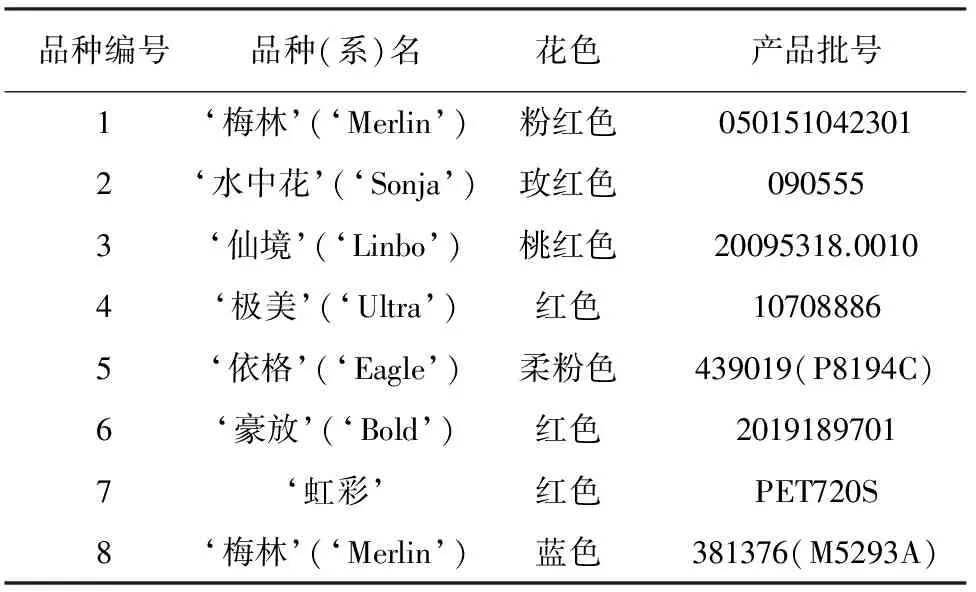
表1 材料编号及品种
注:材料来自厦门爱垦园艺及虹越园艺有限公司。
1.2 试验设计及处理
采用穴盘播种育苗的方法进行播种育苗。待幼苗长至5~6片真叶时,选择生长整齐健壮的幼苗移植于8 cm×8 cm(口径×高度)的营养钵中,每钵1株。栽培土壤为过筛园土∶育苗基质=1∶1,每钵土量为150 g,之后进行常规养护管理。
初花期(移栽后60 d)进行干旱胁迫处理。采用称重法控水处理,以田间最大持水量的百分含量设置4个水分处理梯度:85%~90%对照(CK)、65%~70%轻度胁迫(LD)、45%~50%中度胁迫(MD)、25%~30%重度胁迫(HD)。每天16:30称重控制水分,每个处理3次重复,每重复10盆幼苗。干旱胁迫时间至15 d,测定相关形态指标。选择形态学顶端自上而下第3~5片完全展开叶取样,以新鲜叶片测定叶片相对含水量(RWC),其他叶片保存于-80℃冰箱用于测定叶绿素含量(CHL)、超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)活性、丙二醛(MDA)含量和可溶性蛋白质含量等生理指标。胁迫至20 d测定净光合速率、蒸腾速率及水分利用率等光合特性。
1.3 试验指标的测定
1.3.1 植株形态指标及叶片相对含水量测定 统计测定每种矮牵牛品种在不同胁迫下的开花率(%)、花径(cm)及株高(cm)。采用饱和含水量法测定叶片相对含水量,新鲜叶片于蒸馏水浸泡8 h,称量饱和叶片质量,置于100℃烘箱72 h烘至恒重。
计算叶片相对含水量:
RWC/%=(FW-DW)/(TW-DW)×100
(1)
式中,FW为新鲜叶片质量;TW为饱和叶片质量;DW为烘干叶片质量。
1.3.2 植株生理指标测定 采用LI-6400便携式光合仪(LICOR Inc,USA)测定光合作用相关生理因子。测量于9:00-11:00进行,选取形态学顶端自上而下第3~5片完全展开且生长良好大小相近的叶片,测定时温度设为25℃,相对湿度为60%,光合有效辐射为1 200 μmol·m-2·s-1,CO2浓度380 μmol·mol-1(使用CO2小钢瓶)。每组测定3片叶子,每次测量重复记录5组数据,计算平均值。
测定指标:叶片净光合速率(Pn,μmol·m-2·s-1)、蒸腾速率(Tr,μmol·m-2·s-1)、水分利用率(WUE)
WUE=Pn/Tr
(2)
CHL、SOD、POD、CAT、MDA及可溶性蛋白含量等各生理指标参考李合生[6]测定方法。
1.4 数据处理
应用Excel及SPSS19.0对试验数据进行整理分析并制图。采用最小显著性差异法(LSD)分析比较各品种胁迫处理间的差异性,采用Pearson相关系数法评价各指标的相关性。利用隶属函数公式对试验原始数据进行定量转换,评价各品种的抗旱性强弱。
2 结果与分析
2.1 干旱胁迫对不同品种矮牵牛植株形态的影响
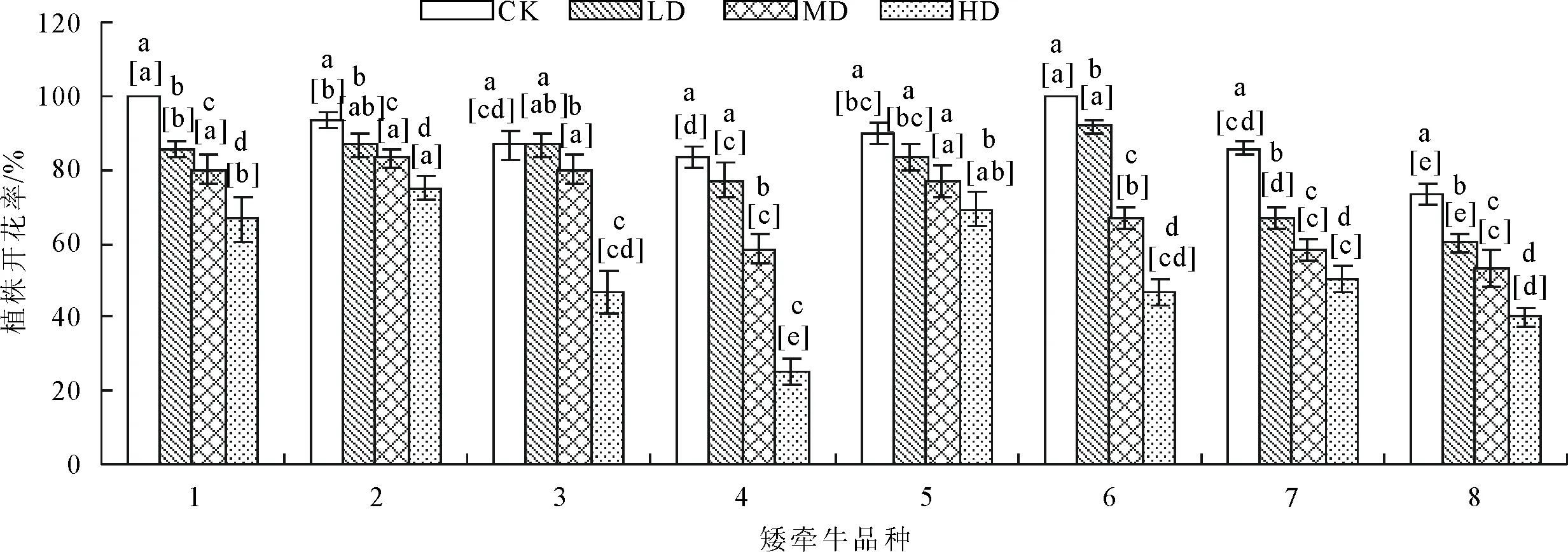
2.1.1 对开花率的影响 花量是决定花卉观赏价值的重要指标,随着胁迫程度的升高,各品种的开花率整体呈现下降趋势(图1)。正常水分条件下,1号及6号品种的开花率均达到100%,轻度胁迫下6号品种开花率显著(P<0.05)高于其他品种,中度和重度胁迫下2号品种开花率显著(P<0.05)高于其他品种。
2.1.2 对花径的影响 随着胁迫程度的增强,矮牵牛花径大小呈降低趋势(图2、图3)。在正常水分条件至中度干旱胁迫条件下6号品种花径下降幅度较小,在轻度至重度胁迫条件下4号、7号品种下降幅度较小。正常水分条件下与干旱胁迫条件下5号品种花径都显著高(P<0.05)于其他品种。
注:括号内字母表示品种间的差异性,括号外表示水分梯度间的差异性。下同。
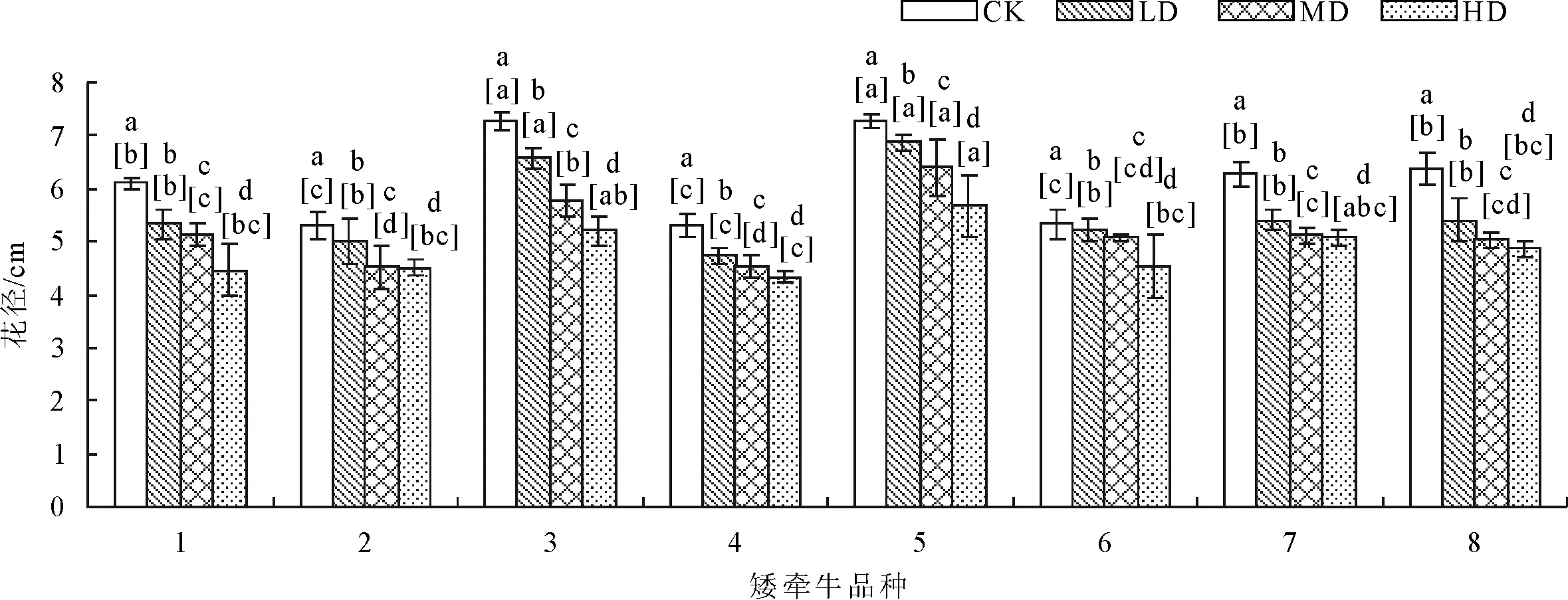
图2 干旱胁迫对不同品种矮牵牛花径大小的影响

图3 不同干旱条件下各品种矮牵牛花径大小
2.1.3 对株高的影响 正常水分条件下,各品种矮牵牛株高存在差异,1、3、5号品种株高为8~9 cm,其余品种株高为13~16 cm。随着水分的减少,各品种株高出现不同程度的下降(图4),植株较矮的品种株高下降幅度较小(图5),表明株型较高的品种对干旱胁迫更敏感。轻度胁迫条件下,3号品种株高较对照未产生显著变化。1号和5号品种在轻度至重度胁迫条件下株高变化不显著。
2.2 干旱胁迫对不同品种矮牵牛植株生理指标的影响
2.2.1 对光合特性的影响 各矮牵牛品种随着干旱胁迫程度的加重,净光合速率及蒸腾速率均有下降趋势,且不同胁迫下数据差异显著(图6、图7)。正常水分条件下7号品种净光合速率显著(P<0.05)高于其他品种;在干旱胁迫条件下,7号品种净光合速率下降幅度较大。6号品种在轻度和中度胁迫下净光合速率下降幅度较小,在重度干旱条件下各个品种净光合速率均显著下降。4号和5号在正常水分条件下蒸腾速率显著(P<0.05)高于其他品种,在干旱条件下这2个品种净光合速率下降幅度明显。8号品种在轻度至重度干旱条件下蒸腾速率下降幅度小于其他品种。
随着水分的减少,各个品种水分利用率呈先增高后降低的趋势,轻度胁迫条件下升高,重度胁迫条件下大幅下降(图8)。中度胁迫下,6、7、8号品种WUE低于对照,其他品种仍高于对照。在重度胁迫1号品种水分利用率下降幅度最小。
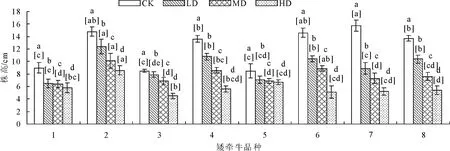
图4 干旱胁迫对不同品种矮牵牛株高的影响

图5 不同胁迫条件下各品种矮牵牛株高
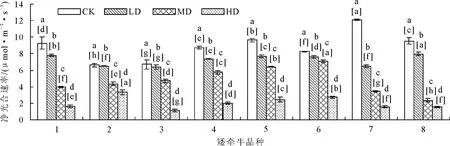
图6 干旱胁迫对不同品种矮牵牛净光合速率的影响
2.2.2 对叶片相对含水量的影响 正常水分条件下,各品种叶片相对含水量差异不显著。随着土壤水分胁迫加剧,矮牵牛各品种叶片相对含水量逐渐下降(图9)。轻度胁迫下,2号和4号品种叶片相对含水量显著(P<0.05)高于其他品种。在轻度至重度胁迫下,7号品种叶片相对含水量下降幅度较小,表明7号品种的叶片具有很好的保水性;而3号品种的叶片相对含水量都显著(P<0.05)低于其他品种的叶片相对含水量。
2.2.3 对叶绿素含量的影响 正常田间持水量条件下,不同品种叶绿素含量存在明显差异,随着土壤水分的减少,不同品种叶绿素含量表现出不同程度的下降趋势(图10)。正常水分和轻度胁迫条件下,3号品种叶绿素含量显著(P<0.05)高于其他品种,中度和重度胁迫条件下4号品种叶绿素含量显著(P<0.05)高于其他品种。
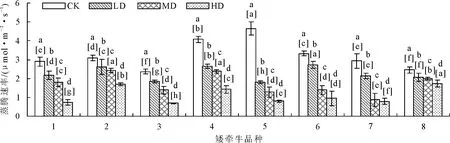
图7 干旱胁迫对不同品种矮牵牛蒸腾速率的影响
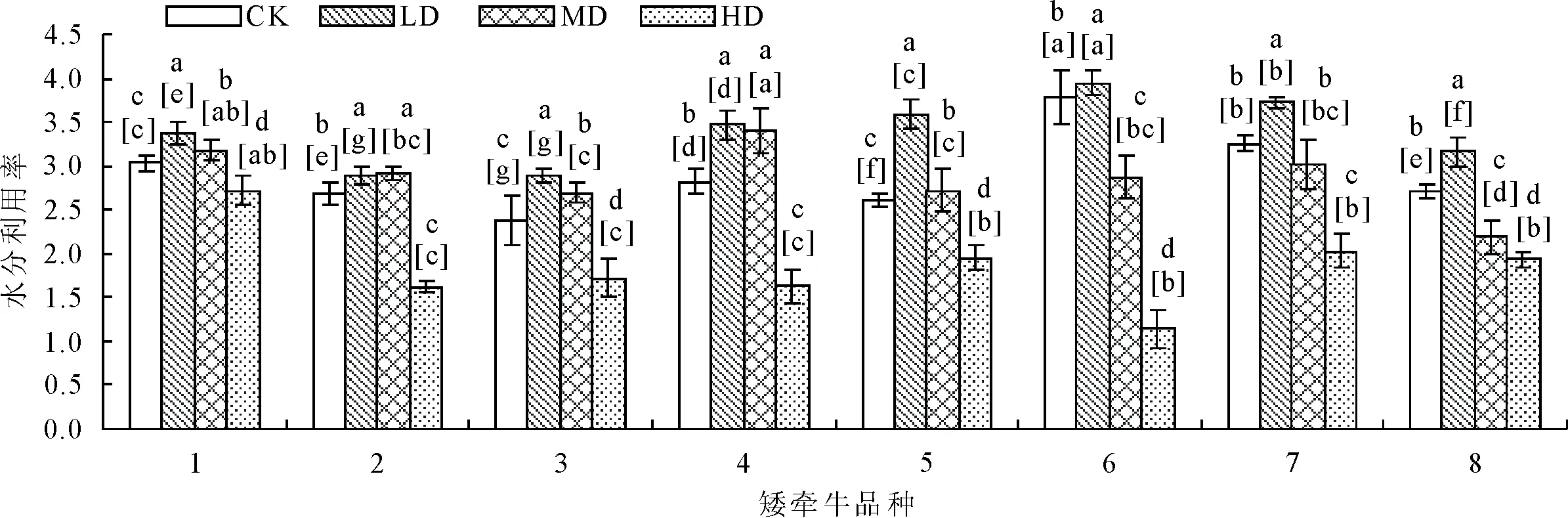
图8 干旱胁迫对不同品种矮牵牛水分利用率的影响
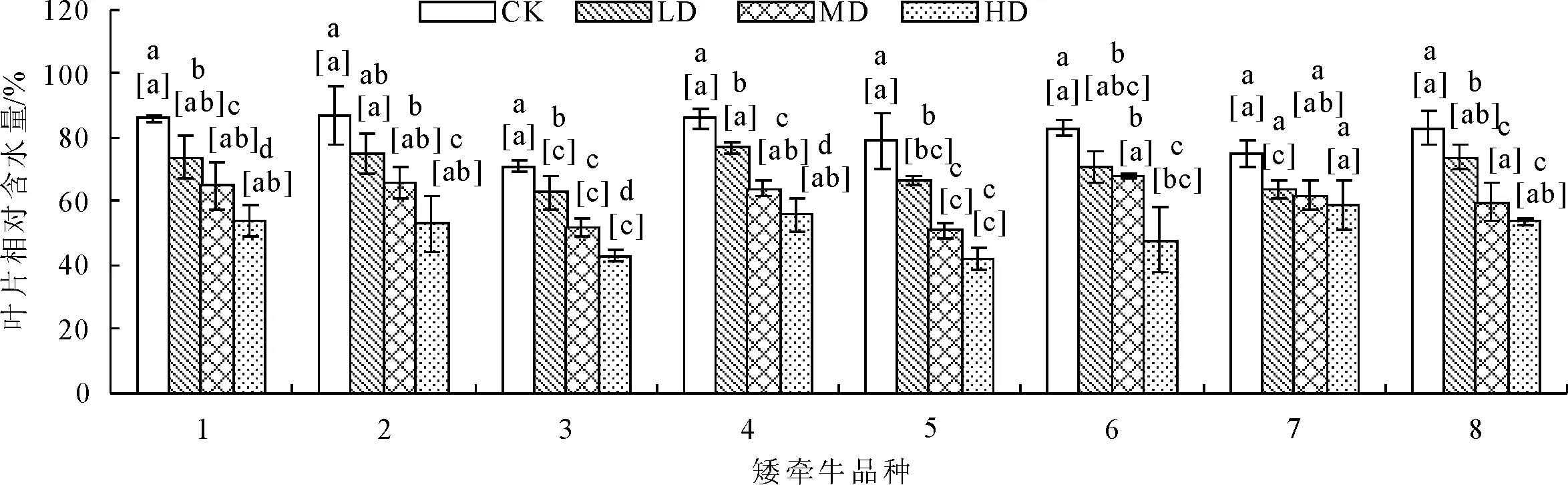
图9 干旱胁迫对不同品种矮牵牛叶片相对含水量的影响
2.2.4 对植株酶活性的影响 随着干旱程度的增强,SOD、POD、CAT等酶的活性均呈逐渐升高的趋势(图11~图13)。在旱胁迫条件下,1号品种SOD和POD活性显著(P<0.05)高于其他品种,8号品种CAT活性显著(P<0.05)高于其他品种。重度胁迫条件下,3号品种POD酶活性呈现大幅升高,其他胁迫条件下升高幅度较小;3号和8号品种CAT含量显著(P<0.05)高于其他品种;3、4、6号品种CAT酶活性升高幅度较大。
2.2.5 对丙二醛含量的影响 随着干旱胁迫程度的升高,各品种MDA含量呈升高趋势(图14)。轻度胁迫条件下,7号和8号品种的MDA含量显著(P<0.05)高于其他品种。3号品种在重度胁迫条件下MDA含量大幅升高,其他胁迫条件增长幅度较小,表明重度胁迫下3号品种质膜受损程度较其他品种严重。

图10 干旱胁迫对不同品种矮牵牛叶绿素含量的影响
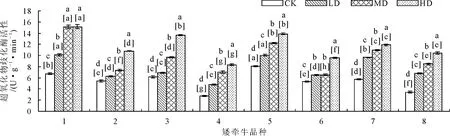
图11 干旱胁迫对不同品种矮牵牛SOD活性的影响

图12 干旱胁迫对不同品种矮牵牛POD活性的影响
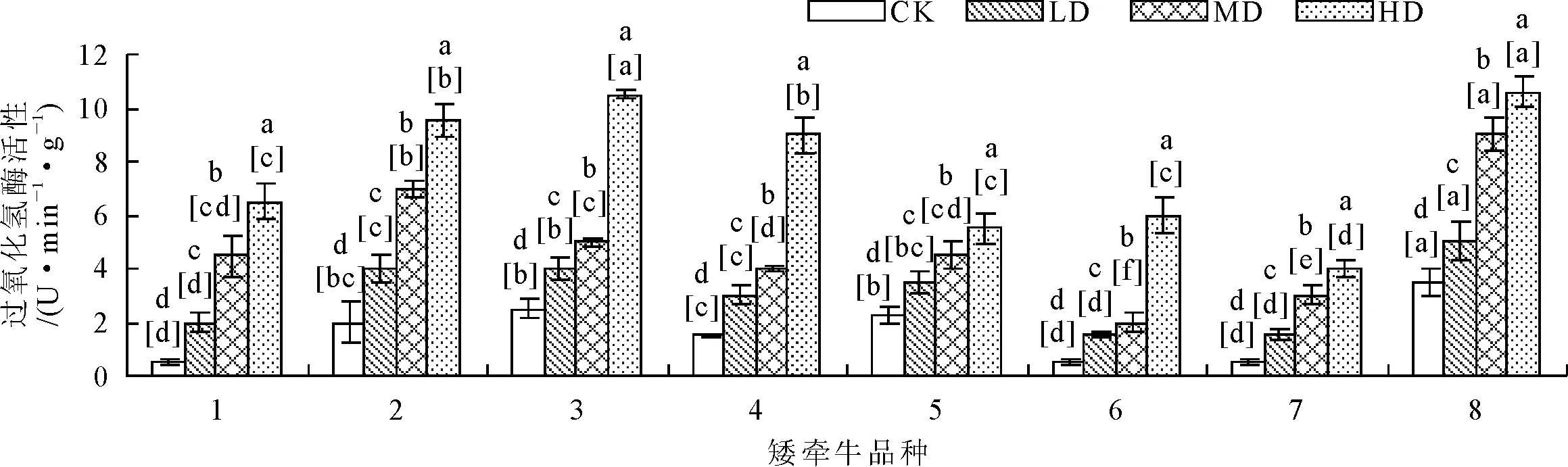
图13 干旱胁迫对不同品种矮牵牛CAT活性的影响
2.2.6 对可溶性蛋白含量的影响 随着干旱程度不断增加,植物体内可溶性蛋白含量逐渐升高(图15),表明矮牵牛通过增加可溶性蛋白的含量以适应干旱条件。中度和重度胁迫下,4号和8号品种可溶性蛋白显著(P<0.05)高于其他品种。3号品种从中度至重度胁迫条件下可溶性蛋白含量增加幅度较大。1、5、6、7号品种可溶性蛋白含量较对照小幅增加,表明干旱胁迫对这几个矮牵牛品种影响较小。
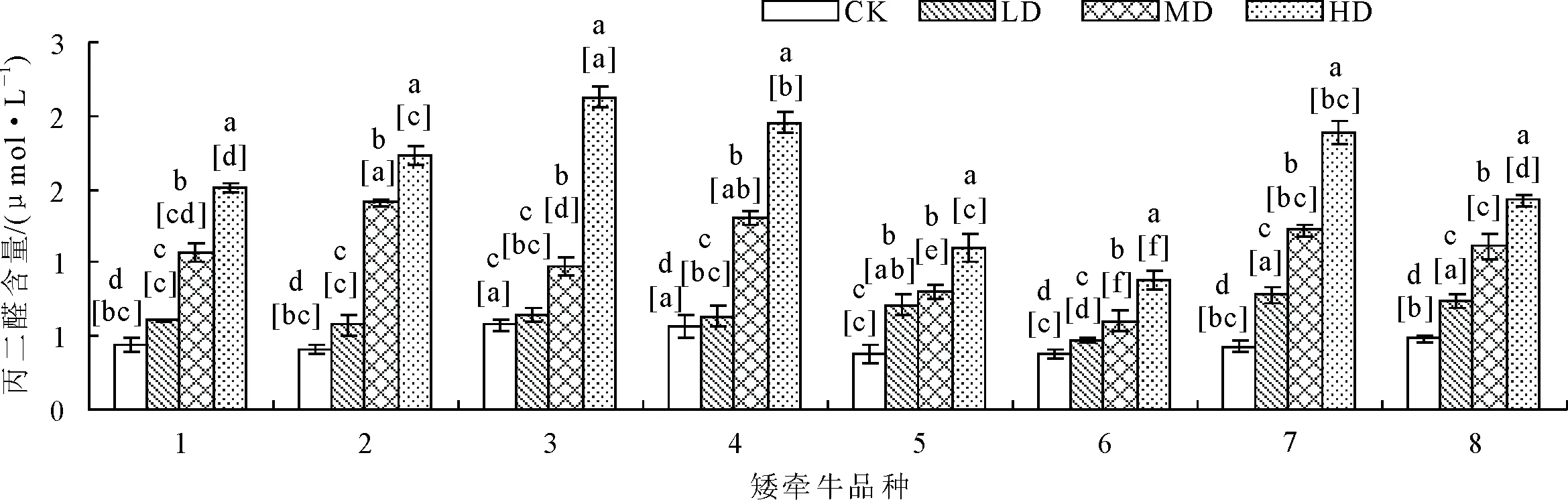
图14 干旱胁迫对不同品种矮牵牛丙二醛含量的影响
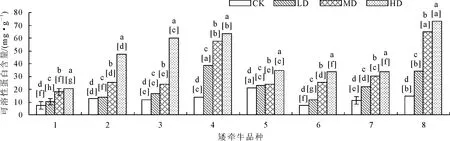
图15 干旱胁迫对不同品种矮牵牛可溶性蛋白含量的影响
2.3 矮牵牛品种抗旱性隶属函数分析
植物的耐旱性可以通过外部形态和内部生理变化等不同的方式来表现,因此,评价植物耐旱性应该从多个指标的变化来综合分析,从而弥补单个指标对植物耐旱性评价的片面性[7]。以4种胁迫下矮牵牛不同品种的形态变化及生理指标的平均值进行隶属函数处理,对平均隶属函数值比较排序,得出8个矮牵牛品种抗旱性强弱依次为3号>6号>4号>2号>5号>1号>8号>7号(表2)。
随着社会经济的快速发展,能源的快速消耗已成为国家可持续发展战略中亟待解决的问题.随着能源消耗水平的不断提高,节能减排已纳入国家十二五规划目标,绿色低碳生活理念也逐渐间被人们所接受.
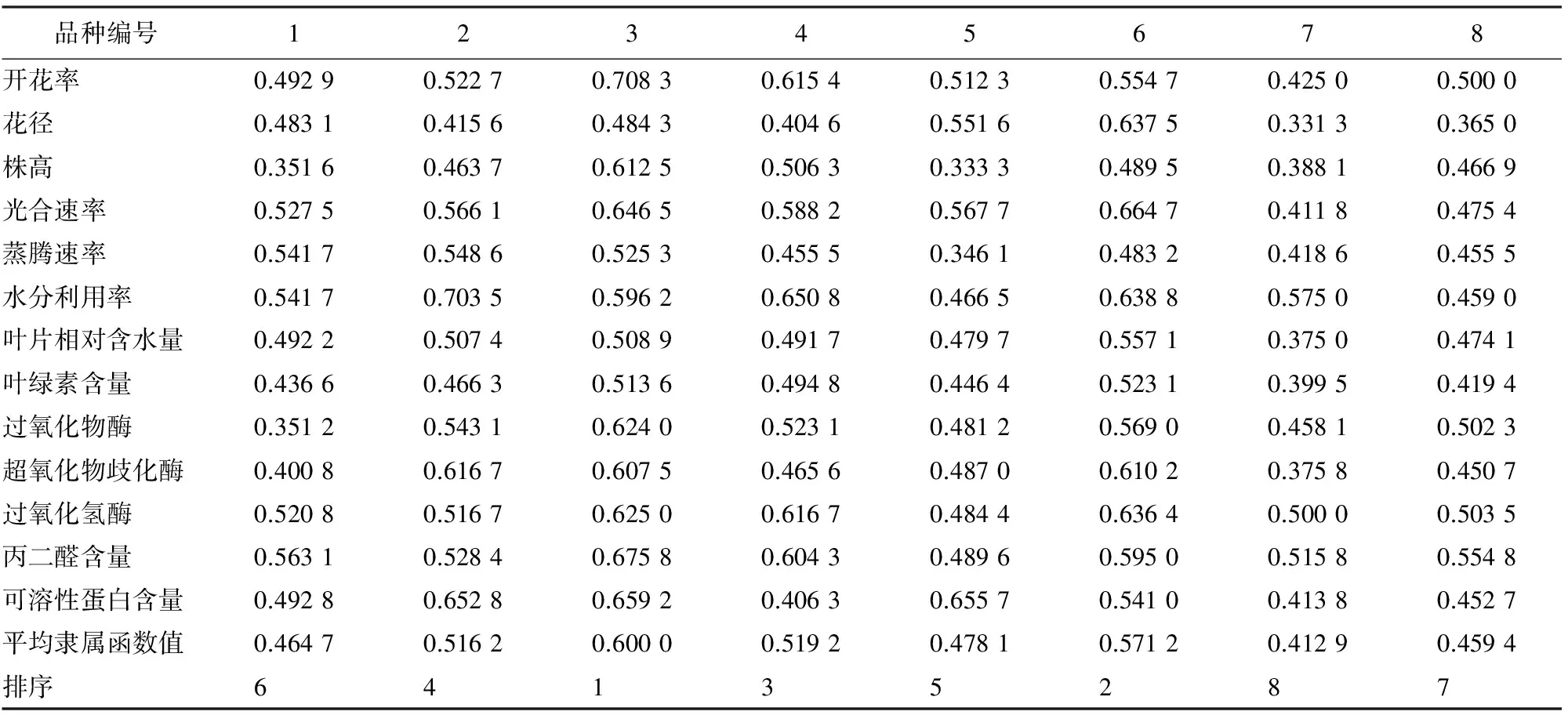
表2 矮牵牛各品种抗旱性隶属函数值
3 结论与讨论
适宜的水分条件是确保矮牵牛具有较高观赏价值的条件之一,花芽分化前期,适当的干旱使植物体内的C/N及激素含量发生变化,促进花芽分化,增加花量[8-9]。本研究中随着土壤相对含水量的减少,矮牵牛开花率及花径大小呈下降趋势,且随胁迫程度升高,表现出花色加深、花瓣不硬挺、花期变短、加速衰老等性状。大量研究证明,株高对水分条件十分敏感,本研究发现高株型植物对水分更加敏感,株高下降幅度大。
光合作用是植物重要的代谢过程,可以为植物生长提供同化物和能量。干旱打破光能捕获和利用的能量平衡,进而影响光合活性[25],植物在干旱条件下光合速率会降低,而降低的幅度取决于干旱的程度和植物本身的耐旱能力[10-12]。本研究中,8个品种的净光合速率、蒸腾速率和叶绿素含量均呈现逐渐降低的趋势,不同品种下降幅度不同。在重度干旱胁迫下各品种植株叶片净光合速率、蒸腾速率与对照存在极显著差异。干旱条件下,植物体通过减少自身蒸腾作用来保持水分平衡。本研究中,8号品种在轻度干旱胁迫下净光合速率显著高于其他品种,同时保持较低的蒸腾速率。6号品种在中度胁迫时维持了较高的净光合速率和较低的蒸腾速率。进一步说明了蒸腾速率一定程度上反应植物调节水分损失的能力,抗旱性较好的能够维持较高的光合速率和较低蒸腾速率[13]。
水分利用效率是评价植物对环境适应的生理生态指标,也是衡量植物体生长发育所需水分供应的重要指标[14]。本研究中,8个品种的水分利用效率呈现先增加后降低的趋势,在轻度和中度干旱胁迫时增加,重度干旱胁迫时下降,说明适度的干旱有利于提高水分利用效率。其中1~5号品种在中度干旱时水分利用率虽然有所下降,但仍高于对照,说明这几个品种有较强的维持细胞膨压的能力从而有较高的耐旱性,而其他3个品种维持细胞膨压的能力和耐旱性相对较弱。
干旱胁迫下POD、SOD和CAT活性增强,加快了对活性氧的清除,从而维持活性氧代谢平衡保护膜结构[15-16]。本试验表明,在轻度胁迫下,矮牵牛品种叶片的MDA含量上升幅度较小,主要是由轻度胁迫下矮牵牛品种的POD、SOD和CAT活性较高,有效的清除了植株体内的活性氧,维持了植物体内活性氧的产生与清除的动态平衡。但在中度和重度胁迫下,3号品种丙二醛含量显著上升,保护酶的活性随之大幅度升高;相反抗性较差的7号品种丙二醛含量大幅度升高时保护酶活性上升幅度较小。干旱胁迫条件下,植物体内合成蛋白质保护植物不受损伤从而提高植物的抗旱能力。本试验中,随着干旱胁迫的加剧,可溶性蛋白含量呈上升趋势,表明各品种通过可溶性蛋白的积累,提高自身的抗旱能力,由于抗旱性存在差异,可溶性蛋白含量的涨幅不同,抗旱性强的品种增长幅度大。
植物的抗旱性是由多基因控制的复杂数量性状,涉及到植物形态及生理生化等各方面,以单一指标分析品种的抗旱能力不够准确。近年来多采用综合指标评价法,本研究采用隶属函数法对8个矮牵牛品种的抗旱性进行综合分析,得到较为准确全面的评价结果,抗旱性由强到弱依次为3号>6号>4号>2号>5号>1号>8号>7号。研究结果对不同品种矮牵牛在园林中的应用具有重要的实践指导意义。
参考文献:
[1] 武术杰.矮牵牛繁殖的研究进展[J].北方园艺,2007(5):175-177.
[2] 邱勇波,罗凤霞,白瑞琴,等.热胁迫下矮牵牛幼苗的形态和生理变化[J].河北农业大学学报,2008,31(1):88-31.
[3] 杨晓玲,郭金耀.矮牵牛耐盐的形态结构研究[J].北方园艺,2011,11(15):113-115.
[4] 宁露云,包满珠,张蔚.低温胁迫对矮牵牛H株系花青素、游离脯氨酸及可溶性糖含量的影响[J].湖北农业科学,2016,55(6):1500-1503.
[5] 范庆,吕秀军,杨柳,等.镉胁迫对矮牵牛种子萌发,幼苗生长及抗氧化酶活性的影响[J].植物研究,2010,30(6):685-691.
[6] 李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2004.
[7] 钱塘磺,雷江丽,庄雪影.3种草本厥类植物耐旱性研究[J].西北林学院学报2012,27(1):22-27.
QIAN T H,LEI J L,ZHUANG X Y.Anti-drought stress capacity of 3 herbal ferns[J].Journal of Northwest Forestry University,2012,27(1):22-27.(in Chinese)
[8] LIU F.Biomass partitioning,specific leaf area,and water use efficiency of vegetable amaranth (Amaranthusspp.) in response to drought stress[J].Scientia Horticulturae,2004,102(1):15-27.
[9] 任庆成,杨铁钊,刘培玉,等.物植抗旱性研究进展[J].中国农学通报,2009,25(15):76-79.
[10] 刘建宁,石永红,侯志宏,等.4份菊苣种质材料苗期抗旱性评价[J].草业学报,2012,21(2):241-248.
[11] 裴斌,张光灿,张淑勇,等.土壤干旱胁迫对沙棘叶片光合作用和抗氧化酶活性的影响[J].生态学报,2013,33(5):1386-1396.
PEI B,ZHANG G C,ZHANG S Y,etal.Effects of soil drought stress on photosynthetic characteristics and antioxidant enzyme activities inHippophaerhamnoidesLinn seedings[J].Acta Ecologica Sinica,2013,33(5):1386-1396.(in Chinese)
[12] 陈征,许嘉阳,范艺宽,等.不同烤烟品种幼苗形态结构及光合参数对干旱胁迫响应机制的差异[J].中国生态农业学报,2016,24(11):1508-1520.
CHEN Z,XU J Y,FAN Y K,etal.Response of morphological structure and photosynthetic parameters to water deficit in four flue-cured tobacco cultivar seedlings[J].Chinese Agricultural Science Bulletin,2016,24(11):1508-1520.(in Chinese)
[13] 井大炜,邢尚军,杜振宇,等.干旱胁迫对杨树幼苗生长,光合特性及活性氧代谢的影响[J].应用生态学报,2013(7):1809-1816.
JING D W,XING S J,DU Z Y,etal.Effects of drought stress on the growth,photosynthetic characteristics and active oxygen metabolism of poplar seedlings[J].Chinese Journal of Applied Ecology,2013(7):1809-1816.(in Chinese)
[14] 曹弈磷,曾春菡,刘小波,等.PEG模拟干旱胁迫下4种苔鲜植物的生理指标变化及其耐旱性评价[J].西北林学院学报2014,29(4):33-39.
CAO Y L,ZENG C H,LIU X B,etal.Physiological and biochemical response and drought resistance evaluation of four wild bryophytes[J].Journal of Northwest Forestry University,2014,29(4):33-39.(in Chinese)
[15] STEDUTO P,KATERJI N,PUERTOS-MOLINA H,etal.Water-use efficiency of sweet sorghum under water stress conditions:gas-exchange investigations at leaf and canopy scales[J].Field Crops Research,1997,54(2/3):221-234.
[16] 张刚,魏典典,邬佳宝,等.干旱胁迫下不同种源文冠果幼苗的生理反应及其抗旱性分析[J].西北林学院学报,2014,29(1):1-7.
ZHANG G,WEI D D,WU J B,etal.Effects of drought stress on physiological characteristics ofXathocerassorbifoliafrom different provenances and analysis on drought-resistance in seedling stage[J].Journal of Northwest Forestry University,2014,29(1):1-7.(in Chinese)
