新辅助放化疗对局部进展期直肠癌的疗效观察
2018-04-24闫燕丽马晓薇刘嘉欣
闫燕丽,马晓薇,谭 黎,邵 帅,刘嘉欣,任 娟
(西安交通大学第一附属医院肿瘤放疗科,陕西西安 710061)
直肠癌是常见的消化道恶性肿瘤之一,由于其早期病变缺乏特异性症状,70%~80%的患者在临床确诊时疾病已处于局部进展期,治疗效果差[1]。近年来,国内外临床研究表明,新辅助放化疗可明显减轻局部进展期直肠癌的瘤负荷,提高手术切除率及保肛率,提高生存率、降低局部复发率和远处转移率。为探讨西安交通大学第一附属医院对局部进展期直肠癌新辅助放化疗的临床效果,本研究收集2014年3月至2017年3月接受新辅助放化疗的局部进展期直肠癌患者的临床资料并报告如下。
1 对象与方法
1.1研究对象收集2014年3月至2017年3月在西安交通大学第一附属医院就诊的局部进展期直肠癌患者32例。纳入标准:①治疗前经病理组织学检查、影像学盆腔磁共振(MRI)、直肠腔内超声、胸部及腹部CT检查确诊为局部进展期直肠癌的患者,且为初发初治;②治疗前血常规、心电图、肝功能、肾功能检查结果均正常,无放、化疗禁忌证;③无肝、肺等远处转移;④KPS评分≥70分;⑤签署知情同意书。排除标准:①完全性肠梗阻或出血;②严重心、肝、肾功能异常,无法耐受放、化疗,存在手术禁忌证;③既往盆腔放疗史。
根据是否行新辅助放化疗将所纳入的32例患者分为2组。接受新辅助放化疗的患者16例,为观察组;其中男性7例,女性9例;年龄46~86岁,平均(59.5±10.9)岁;腺癌13例,黏液腺癌3例;肿瘤下缘至肛门距离为2~11cm,平均(4.9±2.6)cm。未接受新辅助放化疗而直接手术的患者16例,为观察组,其中男性8例,女性8例;年龄44~66岁,平均(57.4±7.0)岁;腺癌15例,黏液腺癌1例;肿瘤下缘至肛门距离为2~10cm,平均(3.8±2.2)cm。
1.2治疗方法
1.2.1观察组 观察组16例患者行新辅助放化疗+手术治疗±术后辅助放化疗。
新辅助放疗:16例患者均接受新辅助放疗。采用10MV-X线的直线加速器行三维适形放射治疗或调强放射治疗,接受照射剂量DT50Gy/25F/5W 者10例;DT37~48 Gy/10~13F+局部补量5.4 Gy/3F者3例;DT25 Gy/5F/W者1例;DT45 Gy/15F/3W者1例;DT60 Gy/30F/6W者1例。
新辅助化疗:16例患者均接受新辅助化疗。①采用交替化放疗者8例,其中FOLFOX(奥沙利铂+氟尿嘧啶+亚叶酸钙)化疗2~4周期者4例(2例放疗期间采用卡培他滨化疗);FOLFOX化疗2周期+ FL(氟尿嘧啶+亚叶酸钙)化疗1周期者1例;XELOX(卡培他滨+奥沙利铂)化疗1~2周期者3例(1例放疗期间采用卡培他滨化疗)。②同步化放疗者6例,其中替吉奥化疗者3例;卡培他滨化疗者2例;FL(氟尿嘧啶+亚叶酸钙)化疗2周期者1例。③序贯化放疗者2例,化疗方案分别采用FL(氟尿嘧啶+亚叶酸钙)或XELOX(卡培他滨+奥沙利铂)化疗2周期。
手术治疗:1例患者新辅助放化疗后复查肠镜显示病灶完全消失,拒绝手术而未行手术治疗。15例患者在新辅助治疗后行全直肠系膜切除术,其中14例患者新辅助治疗结束后4~8周行手术治疗,1例患者因接受高单次剂量放疗(25 Gy/5F)在新辅助治疗结束后1周行手术治疗;8例患者行直肠低位前切除术(Dixon术),7例患者行腹会阴联合切除术(Miles术)。
术后辅助治疗:未行术后辅助治疗者8例;接受术后辅助化疗者8例,化疗方案分别为:FOLFOX化疗3~8周期者4例,XELOX化疗6周期者2例,SOX(替吉奥+奥沙利铂)化疗8周期者1例,FOLFOX化疗4周期+XELOX化疗1周期者1例。接受术后辅助放疗者2例,放疗剂量分别为DT10 Gy/5F和DT16 Gy/8F。
1.2.2对照组 对照组16例患者均行手术治疗±术后辅助放化疗。
手术治疗:16例患者均行全直肠系膜切除术,其中3例患者行Dixon术,13例患者行Miles术。
辅助放疗:12例患者接受术后辅助放疗,采用10 MV-X线的直线加速器行三维适形放射治疗或调强放射治疗。其中接受照射剂量DT45或50 Gy/25F/5W者8例;DT60 Gy/30F/6W者3例;DT50.4 Gy/28F者1例。
辅助化疗:13例患者接受术后辅助化疗,其中FOLFOX化疗5~10周期者5例;FOLFOX+卡培他滨化疗者2例;FOLFOX+替吉奥化疗者2例;XELOX化疗者1例;FOLFOX+TOF(+奥沙利铂+氟尿嘧啶)化疗者1例;FOLFOX+替吉奥+XELOX化疗者1例;卡培他滨化疗者1例。
1.3观察指标观察组病例的疾病缓解率及术中情况:①根据2009年发表的RECIST1.1标准[2]将疾病情况分为完全缓解(complete response, CR)、部分缓解(partial response, PR)、疾病稳定(stable disease, SD)和疾病进展(progress disease, PD),总缓解率=(CR例数+PR例数)/总例数。②术中发现肠道情况,包括是否存在肠道水肿或肠道粘连。观察组与对照组病例疗效及不良事件的比较:①保肛率、局部复发率、远处转移率;②放化疗毒性反应:胃肠道反应、骨髓抑制、肛周皮肤反应等;③术后并发症:吻合口瘘、肠梗阻等。
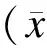
2 结 果
2.1两组患者一般资料的比较观察组与对照组患者的性别、年龄、病理类型、肿瘤下缘至肛门距离等一般资料进行比较,差异无统计学意义,二者具有可比性(P>0.05,表1)。
表1两组患者一般资料的比较
Tab.1 Comparison of general information between observation group and control group

组别性别(例)男女年龄(岁)病理类型(例)腺癌黏液腺癌肿瘤下缘至肛门距离(cm)观察组7946~86(59.5±10.8)1332~11(4.9±2.6)对照组8844~66(57.4±7.0)1512~10(3.8±2.2)χ2/t0.1251.7481.1430.276P0.7230.1960.2850.610
性别、病理类型的比较采用χ2检验,年龄、肿瘤下缘至肛门距离比较采用独立样本t检验,差异无统计学意义(P>0.05)。
2.2观察组患者的疾病缓解率及术中情况观察组16例直肠癌患者在新辅助治疗后行直肠指诊、肠镜检查或手术后病理检查发现,CR者2例,PR者10例,SD者4例,总缓解率(CR+PR)为75%(12/16)。1例患者新辅助放化疗后复查肠镜显示病灶完全消失,拒绝手术而未行手术治疗。15例患者在新辅助治疗后均接受手术治疗,术中探查发现1例患者存在肠道水肿,7例患者的腹腔存在不同程度的肠粘连,但均未影响手术治疗。
2.3观察组与对照组患者疗效及不良事件的比较
2.3.1两组患者疗效的比较 观察组16例患者均接受新辅助放化疗,保肛率为56.25%(9/16),对照组16例患者直接行手术治疗,保肛率为18.75%(3/16),观察组患者的保肛率显著高于对照组,差异有统计学意义(χ2=4.800,P=0.028)。观察组患者的局部复发率为0%(0/16)、远处转移率为12.50%(2/16),对照组患者的局部复发率为18.75%(3/16)、远处转移率为31.25%(5/16),两组比较差异无统计学意义(χ2=2.133、0.667,P=0.144、0.414)(表2)。
2.3.2两组患者放化疗毒性反应的比较 观察组16例患者均接受新辅助放化疗±术后辅助放化疗治疗,对照组13例患者接受术后辅助放疗±化疗。两组病例间放化疗毒性反应(包括胃肠道反应、骨髓抑制情况以及肛周皮肤反应)的差异均无统计学意义(P>0.05,表3)。
表2两组患者疗效的比较
Tab.2 Comparison of therapeutic effects between observation group and control group (n=16,n/%)

组别保肛局部复发远处转移观察组9/56.250/03/18.75对照组3/18.752/12.505/31.25χ24.8002.1330.667P0.0280.1440.414
疗效比较采用χ2检验,两组的保肛率差异有统计学意义(P<0.05),局部复发率与远处转移率差异无统计学意义(P>0.05)。
2.3.3两组患者术后并发症的比较 观察组16例患者中1例患者因新辅助放化疗后复查肠镜显示病灶完全消失,拒绝手术而未行手术治疗,余15例患者在新辅助治疗后均接受手术治疗。对照组16例患者均接受手术治疗。两组病例发生肠梗阻、切口裂开、吻合口瘘及小肠阴道瘘的差异均无统计学意义(P>0.05,表4)。
表3两组患者放化疗毒性反应的比较
Tab.3 Comparison of toxic effects of radiotherapy and chemotherapy between observation group and control group (n/%)

组别(例)胃肠道反应恶心呕吐腹泻骨髓抑制白细胞减少中性粒细胞减少血小板减少肛周皮肤反应观察组(16)3/18.752/12.505/31.2515/93.7510/62.505/31.252/12.50对照组(13)1/7.691/7.691/7.6910/76.927/53.856/46.152/15.38χ20.7380.1792.4261.7080.0501.0110.097P0.3900.6720.1190.1910.8230.3510.755
放化疗毒性反应比较采用χ2检验,差异无统计学意义(P>0.05)。
表4两组患者术后并发症的比较
Tab.4 Comparison of postoperative complications between observation group and control group (n/%)

组别(例)肠梗阻切口裂开吻合口瘘小肠阴道瘘观察组(15)1/6.670/00/00/0对照组(16)2/12.501/6.251/6.251/6.25χ20.3010.9690.9690.969P0.5830.3250.3250.325
术后并发症比较采用χ2检验,差异无统计学意义,P>0.05。
3 讨 论
近年来,随着人们经济水平的提高及生活模式的西化,高脂肪、高蛋白、低膳食纤维的饮食结构导致了结直肠癌的发病率逐年升高,成为仅次于胃癌的消化道恶性肿瘤。大多数直肠癌患者在就诊时以局部进展期直肠癌居多,其中Ⅲ期患者占30%~40%[3]。单纯手术不是为尽可能清除肿瘤而扩大手术范围严重影响患者生存质量,就是为保留肛门而无法达到彻底清除肿瘤的效果从而造成较高的局部复发率。因此,如何在保留肛门的同时又能达到肿瘤根治的效果,一直以来是研究的热点问题。尽管近年来全直肠系膜切除术在临床的广泛应用,使术后局部复发率降到10%以下,但5年生存率仍未达到理想效果[4]。随着多学科综合治疗(multidisciplinary treatment, MDT)理念的不断深入,局部进展期直肠癌的新辅助治疗使更多的患者获益[5-6]。目前新辅助放化疗已经成为局部进展期直肠癌的标准治疗[7]。
新辅助放化疗优点在于:①缩小瘤体,降低肿瘤分期,部分肿瘤可以达到完全缓解,从而提高根治性手术切除率;②提高保肛率,辅助放疗后低位直肠癌的保肛率可由40%左右提高到约60%[8];③放疗后肿瘤细胞发生坏死及纤维化,减少肿瘤细胞因术中牵拉或挤压而导致脱落的机会,降低肿瘤细胞的增殖活性以及切缘阳性率[9];④避免了术后放疗的缺点,术后因纤维化瘢痕的包裹,肿瘤细胞处于相对乏氧状态,放射敏感性下降;此外,术后部分小肠降入盆腔并发生粘连、固定,从而加重放射损伤;术前放疗无吻合口的放射损伤问题[9];⑤术前化疗可尽早治疗微小转移灶,判断肿瘤对化疗的反应,有助于术后治疗计划的制定[10]。
本研究探讨了新辅助放化疗对就诊于西安交通大学第一附属医院的局部进展期直肠癌患者的临床疗效及安全性。目前术前放疗的方式有短程快速大分割放疗和常规分割放疗两种。北欧国家常采用短程快速大分割放疗,其优点是可迅速完成围手术期的治疗,但是其存在较多缺点:在放疗结束后1周进行手术,由于肿瘤退缩不明显,临床降期率不充分,未降低切缘阳性率,不能提高手术保肛率。瑞典研究发现高单次高剂量放疗(25 Gy/5F)可产生更多的急性期和晚期放射副反应,合并较高的神经放射性损伤及术后并发症[11];此外,短程快速大分割放疗的治疗时间短,不能与足够剂量的化疗药物的作用相协同。传统的常规分割放疗(总剂量45~60 Gy,单次剂量1.8~2.0 Gy)是大部分国家常用的放疗方式,其优点在于有充足的放射急性反应恢复时间及肿瘤退缩和降期的时间[12]。
本研究观察组16例患者接受照射剂量DT50 Gy/25F/5W者10例,DT37~48 Gy/10~13F+局部补量5.4 Gy/3F者3例,DT25 Gy/5F/W者1例,DT45 Gy/15F/3W者1例,DT60 Gy/30F/6W者1例;新辅助化疗采用FOLFOX、XELOX、卡培他滨或替吉奥等方案化疗。术中1例(6.67%)患者出现肠道水肿,7例(46.67%)出现肠道粘连,但并未降低手术切除率;肠梗阻、吻合口瘘、切口裂开等术后并发症的发生率与对照组相比差异均无统计学意义,且明显低于同类国内研究[12-14]。就临床疗效而言,观察组病例保肛率(56.25%)明显高于对照组18.75%(χ2=4.800,P=0.028),但局部复发率和远处转移率未见统计学差异,且两组间放化疗不良反应(胃肠道反应、骨髓抑制及肛周皮肤反应)的发生率均无明显差异。由此可见,新辅助放化疗在提高患者保肛率的同时,并未增加术后并发症及放化疗不良反应的发生率,与国内外研究结果较相似[12,15]。本研究的缺陷在于观察组与对照组纳入的病例数较少。此外,各病例间新辅助放化疗和辅助放化疗方案异质性较大,但其结果与已发表的国内外研究相比差异不大,结果可信。
综上所述,在不增加术后并发症及放化疗不良反应的情况下,新辅助放化疗可明显提高局部进展期直肠癌患者的保肛率,从而改善患者远期预后及生存质量,具有很高的临床应用价值,值得进一步推广应用。
参考文献:
[1] FERLAY J, SHIN HR, BRAY F, et al. Estimates of worldwide burden of cancer in 2008: GLOBOCAN 2008[J]. Int J Cancer, 2010, 127(12):2893-2917.
[2] EISENHAUER EA, THERASSE P, BOGAERTS J, et al. New response evaluation criteria in solid tumours: Revised RECIST guideline (version 1.1)[J]. Eur J Cancer, 2009, 45(2):228-247.
[3] QURIKE P, STEELE R, MONSON J, et al. Effect of the plane of surgery achieved on local recurrence in patients with operable rectal cancer: A prospective study using data from the MRC CR07 and NCIC-CTG CO16 randomised clinical trial[J]. Lancet, 2009, 373(9666):821-828.
[4] GUILLEM JG, CHESSIN DB, COHEN AM, et al. Long-term oncologic outcome following preoperative combined modality therapy and total mesorectal excision of locally advanced rectal cancer[J]. Ann Surg, 2005, 241(5):836-838.
[5] HOFHEINZ RD, WENZ F, POST S, et al. Chemoradiotherapy with capecitabine versus fluorouracil for locally advanced rectal cancer: A randomised, multicentre, non-inferiority, phase 3 trial[J]. Lancet Oncol, 2012, 13(6):579-588.
[6] ASCHELE C, CIONINI L, LONARDI S, et al. Primary tumor response to preoperative chemoradiation with or without oxaliplatin in locally advanced rectal cancer: pathologic results of the STAR-01 randomized phase III trial[J]. J Clin Oncol, 2011, 29(20):2773-2780.
[7] 彭俊杰,朱骥,刘方奇,等. 中国局部进展期直肠癌诊疗专家共识[J]. 中国癌症杂志, 2017, 27(1):41-80.
[8] WAGMAN R, MINSKY BD, COHEN AM, et al. Sphincter preservation in rectal cancer with preoperative radiation therapy and coloanal anastomosis: Long term follow-up[J]. Int J Radiat Oncol, 1998, 42(1):51-57.
[9] 周皎琳,邱辉忠. 直肠癌新辅助放化疗[J]. 癌症进展, 2006, 4(1):46-49.
[10] 顾晋,杜敬曾. 客观评价和正确开展结直肠癌的新辅助治疗[J]. 中国实用外科杂志, 2011,31(1):47-49.
[11] JULIEN LA, THORSON AG. Current neoadjuvant strategies in rectal cancer[J].J Surg Oncol, 2010, 101(4):321-326.
[12] 柴宇啸,曲兴龙,王奕静,等. 同步新辅助放化疗联合全直肠系膜切除术治疗中低位局部进展期直肠癌的临床研究[J]. 肿瘤, 2011, 31(7):658-661.
[13] 王泽军,张汝一,王文玲,等. 新辅助同步放化疗联合全直肠系膜切除术治疗中低位局部进展期直肠癌的疗效[J]. 当代医药论丛月刊, 2013, 11(12):55-57.
[14] 刘丽丽,张凤祥,郑国宝,等. 直肠癌术前放疗的效果观察[J]. 实用医药杂志, 2009, 26(3):18-20.
[15] BOSSET JF, CALAIS G, DABAN A, et al. Preoperative chemoradiotherapy versus preoperative radiotherapy in rectal cancer patients: Assessment of acute toxicity and treatment compliance. Report of the 22921 randomised trial conducted by the EORTC Radiotherapy Group[J]. Eur J Cancer, 2004, 40(2):219-224.
