内侧半月板失稳诱发C57BL/6小鼠骨关节炎模型中关节腔微量注射方法的建立
2018-04-24武淑芳邱裕生
冯 萌,钱 庄,李 萌,彭 航,3,张 婉,3,武淑芳,邱裕生
(西安交通大学:1. 第一附属医院骨科,陕西西安 710061;2. 第一附属医院骨关节病研究中心,陕西西安 710061;3. 前沿科学与技术研究院,陕西西安 710054)
骨关节炎(osteoarthritis, OA)是一种累及整个关节内组织,以原发性或继发性关节软骨变性破坏、骨重建、滑膜增生、肌肉挛缩及关节僵直畸形为特征的慢性关节病[1-2]。流行病学数据表明,原发性OA患病率在美国65岁及以上人群中高达33.6%,且呈现出OA日益年轻化的趋势。其中膝关节和踝关节的继发性OA以创伤性骨关节炎多见[3-4],其与运动损伤、机械载荷应力异常、关节失稳及先天性关节结构异常、畸形等有关。患者后期常常伴有剧烈疼痛或关节畸形,给患者造成极大痛苦,严重影响其生活质量。因此,OA是运动医学领域急需解决的一大难题。
利用哺乳动物制备骨关节炎模型的方法相对成熟,如家兔,但在小鼠内侧半月板失稳术(destabilization of medial meniscus, DMM)诱导骨关节炎模型中[5],由于种属差异及C57BL/6鼠膝关节形态小,在内侧半月板失稳术过程中存在关节囊损伤大、缝合不全、术后感染致小鼠死亡、造模不可靠等问题。现有研究缺乏相关标准可靠的微创手术视频资料[6-7],且在OA模型中行关节腔内注射存在可重复性差的问题[8]。本课题通过模拟关节腔注射OA疾病改善药物来构建一套标准操作流程,旨在提高转基因小鼠DMM造模及关节腔微量注射的重复性和可靠性。
1 材料与方法
1.1动物喂养及动物福利本课题通过西安交通大学动物伦理委员会审批。24只雄性8周龄小鼠[9]购自西安交通大学实验动物中心,体质量为(20±2)g,SPF级动物房温度在25 ℃左右,昼夜交替规律(12 h∶12 h),提供充足的饮食,每3 d更换木屑1次[10]。适应性饲养后行DMM造模,术后确保小鼠麻醉苏醒并存活,正常喂食进水,每隔2 d补充1次饲料和水。根据西安交通大学实验动物尸体处置操作规程,焚化处理动物尸体。
1.2主要实验材料10 μL微量注射器(MicroliterTMSyringes, Hamilton Company, Nevada, USA),烧杯(50 mL),生理盐水,甲苯胺蓝,番红O/固绿(西安化学试剂厂)。消毒用品为碘伏、无菌棉球等,显微手术器械包括外科显微镜(重光COIC)及尼康D7100单反相机,有齿镊、弯钳、持针器、医用缝合线(7-0)、手术刀柄及11P号尖刀片。实验人员防护设施包括口罩、帽子、一次性手套、垫单及锐器收集盒。
1.3小鼠骨关节炎造模C57BL/6小鼠随机分假手术组及DMM组(n=12)。麻醉使用50 g/L水合氯醛腹腔注射,术区剃毛,小鼠选取仰卧位固定左后肢屈膝90°,充分消毒术野。由图1示,剪开皮肤暴露髌韧带,用尖刀剪沿髌韧带内缘剖开关节囊,钝性清理关节内脂肪组织,内侧半月板通过内侧半月板胫副韧带(MMTL)与胫骨平台相连。离断MMTL,冲洗创口后,7-0手术缝线缝合关节腔,关闭皮肤创口,局部外敷阿莫西林预防创口感染。假手术组仅剖开关节囊后逐层缝合。同时观察小鼠麻醉苏醒及伤口愈合情况。
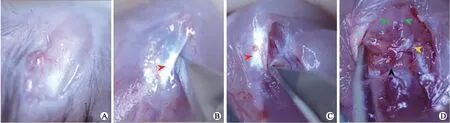
图1内侧半月板失稳术诱发C57BL/6小鼠骨关节炎的操作图
Fig.1 Destabilization of the medial meniscus to induce osteoarthritis model in C57BL/6 mice
A:切开皮肤;B:沿着髌韧带(红色箭头示)切开关节囊;C:暴露内侧半月板,离断内侧半月板胫骨韧带;D:将髌韧带后脱位充分显露小鼠膝关节腔解剖结构,绿色箭头示股骨髁,黑色箭头示胫骨平台,橙色箭头示内侧半月板,实际DMM造模不做步骤D。
1.4国际骨关节炎研究学会标准分级/分期评分系统小鼠颈椎脱位处死取出右膝关节,40 g/L多聚甲醛固定24~48 h,100 g/L EDTA脱钙1周,石蜡包埋,每隔4 μm行冠状位切片,行番红O/固绿染色。双人分开采用国际骨关节炎研究学会(Osteoarthritis Research Society International, OARSI)分级/分期系统,即OARSI分7级,OA软骨病理损伤涉及范围分5期(0期未见OA活动,1期<10%,2期为10%~25%,3期为25%~50%,4期>50%),总病理评分=分级×分期[11]。
1.5骨关节炎模型中关节腔微量注射方法的建立12只DMM造模2周后小鼠随机分2组(n=6),实验组关节腔注射甲苯胺蓝,对照组为生理盐水,频率为1周/次。麻醉小鼠后备皮消毒,取膝关节正中纵向皮肤切口,长约2 mm,牵拉皮肤寻找膝关节髌韧带,应用微量注射器以髌韧带内缘中点为进针点,斜向后上方约1.5 mm深度注射生理盐水或甲苯胺蓝入关节腔,拔针后稍用力加压针眼处,最后缝合皮肤切口。
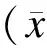
2 结 果
2.1DMM诱发C57BL/6小鼠膝不同区域软骨组织的病理改变DMM术中膝关节出血少,经观察术后1 h左右小鼠逐渐复苏并可自由活动,均未出现麻醉过量反应。造模4周后行番红O/固绿染色,以关节解剖结构分区,DMM组小鼠膝关节内侧胫骨平台表面软骨不规则,番红O着色减少,负重区软骨侵蚀破坏达到钙化软骨层,约占内侧股骨髁软骨表面的50%(图2)。而DMM组内侧股骨髁软骨破坏相对较浅,外侧股骨髁及胫骨平台关节软骨显示基本正常。假手术组和DMM组相比较,关节4个区域的软骨相对完整,无番红着色缺失,未见骨赘形成及滑膜增生。

图2小鼠膝关节不同解剖区域骨关节炎的病理改变
Fig.2 Site-specific staining of knee joint sections from DMM-induced osteoarthritis model in mice
番红O/固绿染色,A、C:bar=500 μm;B、D:bar=125 μm。
2.2OARSI分级/分期系统评定小鼠OA软骨病理的程度由于膝内侧解剖区域的软骨OA病理改变显著,在 OARSI评分表现为DMM组股骨内侧髁(MFC)评分为3.417±0.642 1(n=12),内侧胫骨平台(MTP)评分为9.583 0±0.811 5(n=12),二者行配对双尾t检验,具有统计学差异(P<0.000 1),说明胫骨平台OARSI病理评分较股骨髁评分高(图3)。假手术组MFC评分结果为0.416 7±0.148 6(n=12),MTP评分为 0.583 3±0.148 6(n=12),t检验二者无统计学差异(P<0.503 5)。而DMM组和假手术组的MFC及MTP评分分别利用独立样本t检验比较,具有统计学差异(P=0.000 2,P<0.000 1)。
2.3甲苯胺蓝使软骨着色验证了关节腔微量注射技术可靠由图4可见,DMM术后关节囊愈合良好,注射生理盐水组的膝关节(图4A、4B)不能使关节腔内软骨着色。图4C、图4D示,成功注射甲苯胺蓝则关节腔充盈,切开关节囊后软骨组织明显蓝染。此外,发现成年OA小鼠关节腔容积在6~10 μL,若给药剂量过大因关节腔张力过高易发生渗漏现象。

图3C57BL/6小鼠膝骨关节炎病理组织的OARSI评分
Fig.3 Histological assessment of knee joint in C57BL/6 mice based on OARSI score system
3 讨 论
由于C57BL/6小鼠膝关节形态小,关节软骨厚度约30 μm[12],小鼠关节腔微量给药及注射剂量可供参考文献少,初学者较难掌握DMM及微量注射技术。

图4小鼠关节腔微量注射的操作图
Fig.4 Representative images showed the procedure of joint cavity micro-aspiration in mice
A、C:斜后上方进针,注射生理盐水/甲苯胺蓝后压迫2 min,针眼无液体渗出;B、D:处死小鼠后切断前后交叉韧带,充分暴露关节面。红色箭头示髌韧带,黑色箭头示胫骨上段,橙色箭头示股骨髁。
在研究基因敲除小鼠OA模型中,关节腔注射给药技术的可重复性决定最终实验结果的可信性。GLASSON等[5]曾报道129/SvEv小鼠OA造模,但转基因背景小鼠价格昂贵,获得困难且小鼠品系种属存在差异。本组实验通过DMM诱发制备C57BL/6雄性小鼠OA模型,在此基础上建立膝关节腔注射微量给药方法,该可视化、一站式微创操作流程效果可靠,有助于微量注射技术在转基因小鼠OA模型中的应用,指导关节腔注射OA疾病改善药物的方法来治疗OA[13-14]。因此,本课题建立的微量注射方法具有重要实际应用价值。
其次,与大鼠常用的前交叉韧带切断术、家兔中应用木瓜蛋白酶联合前交叉韧带切断术制备持续进展OA模型操作不同[15],小鼠OA模型制备为显微操作[8]。本课题为初学人员提供了手术图像资料,有助于在熟悉关节解剖结构并保护其完整的前提下,降低关节囊损伤,节约转基因小鼠数量,避免关节缝合不全、术后感染等问题。目前,OA的诊治和软骨修复一直是临床和基础研究的难题[1,16],利用动物实验建立正常组、假手术组及DMM诱发OA模型组,从分子机制去理解OA病理进展过程[6-7,13,17],可为OA的精准治疗提供依据。
不同于Mankin评分系统,OARSI分级/分期评分在评估C57BL/6小鼠的OA早期病理改变,可信度较高[11],推荐版的OARSI半定量分级评分针对小鼠膝关节冠状位切片按解剖区域评估软骨病理,更易掌握[12]。本课题中DMM组C57BL/6小鼠内侧股骨髁及胫骨平台OA进展相对较重,负重较大的胫骨平台软骨侵蚀最突出,表现为OASRI评分增高,与GLASSON等[5]文献报道一致。此外,通过OA小鼠膝关节腔注射,发现第2周时关节腔的创口已良好愈合。与单次关节腔注射不同[6],在OA小鼠膝关节中多次隔周重复注射,关节囊结构可保持完整,并发现OA关节腔的容积在6~10 μL之间,这对关节腔注射给药剂量的确定具有参考价值。
总之,本研究为各专业背景人员从理论和操作上建立了一站式图文操作流程,有利于推进转基因小鼠OA造模及关节腔注射给药的规范化。
参考文献:
[1] GLYN-JONES S, PALMER AJ, AGRICOLA R, et al. Osteoarthritis[J]. Lancet, 2015, 386(9991):376-387.
[2] LOESER RF, GOLDRING SR, SCANZELLO CR, et al. Osteoarthritis: A disease of the joint as an organ[J]. Arthritis Rheum, 2012, 64(6):1697-1707.
[3] LAWRENCE RC, FELSON DT, HELMICK CG, et al. Estimates of the prevalence of arthritis and other rheumatic conditions in the United States. Part II[J]. Arthritis Rheum, 2008, 58(1):26-35.
[4] GOUTTEBARGE V, INKLAAR H, BACKX F, et al. Prevalence of osteoarthritis in former elite athletes: A systematic overview of the recent literature[J]. Rheumatol Int, 2015, 35(3):405-418.
[5] GLASSON SS, BLANCHET TJ, MORRIS EA. The surgical destabilization of the medial meniscus (DMM) model of osteoarthritis in the 129/SvEv mouse[J]. Osteoarthr Cartil, 2007, 15(9): 1061-1069.
[6] MATSUZAKI T, MATSUSHITA T, TABATA Y, et al. Intra-articular administration of gelatin hydrogels incorporating rapamycin-micelles reduces the development of experimental osteoarthritis in a murine model[J]. Biomaterials, 2014, 35(37): 9904-9911.
[7] TAKAYAMA K, KAWAKAMI Y, KOBAYASHI M, et al. Local intra-articular injection of rapamycin delays articular cartilage degeneration in a murine model of osteoarthritis[J]. Arthritis Res Ther, 2014, 16(6):482.
[8] KIM BJ, CHOI BH, JIN L, et al. Comparison between subchondral bone change and cartilage degeneration in collagenase- and DMM-induced osteoarthritis (OA) models in mice[J]. Tissue Eng Regen Med, 2013, 10(4):211-217.
[9] MA HL, BLANCHET TJ, PELUSO D, et al. Osteoarthritis severity is sex dependent in a surgical mouse model[J]. Osteoarthr Cartil, 2007, 15(6):695-700.
[10] HASHIMOTO S, RAI MF, JANISZAK KL, et al. Cartilage and bone changes during development of post-traumatic osteoarthritis in selected LGXSM recombinant inbred mice[J]. Osteoarthr Cartil, 2012, 20(6):562-571.
[11] PRITZKER KPH, GAY S, JIMENEZ SA, et al. Osteoarthritis cartilage histopathology: Grading and staging[J]. Osteoarthr Cartil, 2006,14(1):13-29.
[12] GLASSON SS, CHAMBERS MG, VAN DEN BERG WB, et al. The OARSI histopathology initiative--recommendations for histological assessments of osteoarthritis in the mouse[J]. Osteoarthr Cartil, 2010, 18(S13): S17-S23.
[13] LI W, CAI L, ZHANG Y, et al. Intra-articular resveratrol injection prevents osteoarthritis progression in a mouse model by activating SIRT1 and thereby silencing HIF-2alpha[J]. J Orthop Res, 2012, 33(7): 1061-1070.
[14] SASAKI H, TAKAYAMA K, MATSUSHITA T, et al. Autophagy modulates osteoarthritis-related gene expression in human chondrocytes[J]. Arthritis Rheum, 2012, 64(6):1920-1928.
[15] LI F, YIN Z, WU H, et al. Section of the anterior cruciate ligament in the rabbit as animal model for osteoarthritis progression[J]. Int Orthop, 2016, 40(2):407-416.
[16] 冯萌,邱裕生,陈迁,等. 骨关节炎骨软骨损伤修复的研究现状[J]. 中国矫形外科杂志, 2016, 24(14):1295-1298.
[17] ROWE MA, HARPER LR, MCNULTY MA, et al. Reduced osteoarthritis severity in aged mice with deletion of macrophage migration inhibitory factor[J]. Arthritis Rheum, 2017, 69(2):352-361.
