不同分期溃疡性结肠炎结肠黏膜血清素再摄取转运体的表达分析
2018-04-24王进海徐艳丽李新红刘素蓉
秦 燕,王进海,徐艳丽,刘 娟,李新红,刘素蓉
(1. 西安交通大学第二附属医院消化内科,陕西西安 710004;2. 兵器工业卫生研究所老年病科,陕西西安 710065)
肠易激综合征(irritable bowel syndrome, IBS)以排便习惯和大便性状异常为主要症状,在溃疡性结肠炎(ulcerative colitis, UC)患者中较为常见,但其产生的原因尚未明确[1-2]。研究提示,胃肠运动功能紊乱、应激反应、内脏反应、肠道固有免疫及肠道微生物、基因多态性等因素均参与IBS的发病过程[3-5]。5-羟色胺(5-hydroxy tryptamine, 5-HT)为单胺类神经递质,由色氨酸羟化酶-1(tryptophan hydroxylase-1, TPH-1)参与合成,在肠道系统广泛表达,调节肠道运动功能。5-HT代谢异常与IBS发生密切相关,其受体也是IBS治疗药物的靶点[4]。
血清素再摄取转运体(serotonin reuptake transporter, SERT)可以通过重吸收5-HT调节其活性[6-7]。SERT基因启动子多态性可以影响转运体在结肠黏膜中表达,在IBS的致病过程中起到重要作用[8]。动物实验结果提示,SERT基因在结肠炎模型中表达降低,另外炎性因子水平提高可以下调SERT基因的表达[9-11]。目前,关于SERT是否在不同疾病分期UC患者结肠黏膜中有所差异尚存在争议,而缓解期UC患者结肠黏膜中SERT表达的相关研究更为罕见。
本研究选择UC患者作为研究对象,结合动物实验,检测SERT基因在活动期和缓解期UC患者结肠黏膜及动物模型中的表达情况。并利用内镜窄带成像术(narrow band imaging, NBI)检查分类缓解期黏膜,分析SERT表达与内镜检查结果、炎症因子及血管形成相关基因表达的相关性,探讨UC疾病中IBS样症状发生的机制,为炎症性肠病的诊疗提供依据。
1 材料与方法
1.1主要试剂HE染色试剂盒、免疫组织化学检测试剂盒(武汉博士德);DAB显色试剂盒、DEPC、Trizol试剂(Sigma公司,美国);所有一抗、辣根过氧化酶标记羊抗兔二抗(Santa Cruz公司,美国);逆转录试剂盒(Roche公司,美国);SYBR®Select Master Mix(Applied Biosystems,美国)。其他试剂为实验室常备。
1.2研究对象与资料收集研究对象均系西安交通大学第二附属医院消化内科及兵器工业卫生研究所收治患者。纳入标准:根据临床病史、症状、体征以及内镜检查结果诊断为UC(活动期或者缓解期)。排除标准:①合并其他肠道疾病;②合并肿瘤、感染等重大疾病或者其他系统影响研究结果的疾病;③具有内窥镜检查或者活检检查禁忌证。收集研究对象门诊及住院就诊医疗记录。本研究方案经机构伦理委员会批准同意,相关方案获得患者和家属知情同意。
自2011年至2015年间共有31名患者纳入研究,其中男性17名,女性14名,平均年龄(47.2±5.3)岁。患者病变累及全结肠共16例,左半结肠9例,直肠6例。平均患病时间6.1年,平均腹泻次数(2.11±0.21)次。9名患者按照罗马Ⅲ标准诊断为IBS(腹泻型2名,便秘型1名,不定型6名)。根据临床病史、体征结合内镜检查结果,共有11名患者诊断为活动期,20名患者诊断为缓解期。
1.3内镜检查与标本收集使用NBI检查进一步将缓解期黏膜分为常规血管型(R型)和非常规血管型(UR型),由2名医师独立评估分型。R型定义为:NBI图像显示黏膜具有腺窝开口,伴随常规血管网环绕;UR型定义为:结肠黏膜图像与R型表现差异较大。使用内窥镜活检术取出活检标本,用于组织学评估及RNA检测。每位患者采集至多3个样本,对于全部黏膜处于缓解期患者,取出R型和UR型样本,对于活动期患者取出活动期黏膜样本。活检标本部分快速冰冻,液氮保存,部分40 g/L多聚甲醛固定,用于组织学评估。
1.4实时定量PCR检测将上述部分肠黏膜标本于RNA贮存专用试管,抽提总RNA,测定RNA浓度,利用cDNA合成试剂盒反转录RNA,选择GAPDH mRNA作为内参,计算各基因相对浓度。检测结肠炎症对黏膜SERT表达的影响。使用NCBI blast tool及Primer3进行引物设计。
1.5HE染色进行标本组织学评估标本置于40 g/L多聚甲醛固定3 d,逐级脱水,二甲苯透明,石蜡包埋,切片,片厚5 μm,行HE染色。按照炎性活动评分(Matts)进行组织学分级:1级,基本正常;2级,黏膜或黏膜下层有单核或者多核粒细胞浸润;3级,结肠全层糜烂伴有炎性细胞浸润;4级,黏膜糜烂、隐窝脓肿,伴有炎性细胞全层浸润;5级,溃疡、出血、黏膜坏死伴有上述细胞浸润。
1.6免疫组织化学染色石蜡包埋标本切片后,脱蜡至水,按照SP法行免疫组织化学染色。利用血清封闭内源性过氧化物酶活性,使用兔抗人SERT抗体以及TPH-1抗体孵育过夜,检测SERT及TPH-1的表达。镜下观察细胞膜、细胞质及细胞外基质中出现棕黄色反应产物判定为阳性。
1.7高通量PCR分析成血管通路基因表达利用RT2 Profile PCR分析系统检测成血管通路相关的84个关键性基因,即疾病相关通路表达谱。同上述提取总RNA,检测RNA浓度,按照第1序列试剂盒操作说明进行RNA反转录,PCR仪参数设定为95 ℃(10 min),40个循环:变性95 ℃ 15 s-退火60 ℃ 1 min-延长60 ℃ 1 min。根据与GAPDH mRNA测定值的比例,计算mRNA 的相对浓度。
1.8动物模型的构建及相关基因检测采用右旋葡聚糖苷钠(DSS)诱导结肠炎模型。8周龄清洁级C57B/6J雄性小鼠共40只,体质量20~25 g,由西安交通大学实验动物中心提供,相关实验按照西安交通大学动物伦理标准进行。实验前适应性喂养1周。实验动物随机分为两组:模型组20只,饮水中加入2.5% DSS,持续5 d;对照组20只,饮水中加入等浓度葡萄糖。造模后0、7、14、21、28、56、84 d 采集结肠标本,检测相关基因变化,部分标本甲醛固定后石蜡包埋切片,行组织学评估。
1.9统计学处理采用SPSS 20.0统计软件进行分析。计量资料以均数±标准差表示,两组间比较采用校正t检验;计数资料采用卡方检验;使用Spearman秩和检验分析指标间相关性。P<0.05为差异有统计学意义。
2 结 果
2.1UC患者SERT的表达及其与IBS样症状发生的相关性活动期患者IBS发生率为36.4%(4/11),缓解期患者IBS发生率为40.0%(5/20)。常规结肠镜活检共取出有效标本39个,其中11例由活动期黏膜取出,28例由缓解期黏膜取出。SERT免疫组化结果提示,缓解期结肠黏膜肠上皮细胞SERT表达呈现强阳性,活动期黏膜SERT阳性程度较低(图1)。RT-PCR结果提示,缓解期黏膜SERT基因相对浓度高于活动期黏膜,经校正t检验,差异具有统计学意义。Spearman秩和检验分析结果提示,SERT基因的表达与IBS症状表达呈负相关。

图1溃疡性结肠炎结肠黏膜组织SERT表达情况
Fig.1 Expression of SERT in ulcerative colonic mucosa
A:肠上皮细胞SERT表达(缓解期);B:肠上皮细胞SERT表达(活动期)。
2.2UC患者SERT的表达与结肠炎症的相关性Matts组织分级,1级5例标本,2级22例标本,3级7例标本,4级3例标本,5级2例标本。Matts组织分级结果与SERT mRNA的相对表达量呈负相关(r=-0.38,P<0.001)。活动期黏膜IL-8 mRNA相对量高于缓解期黏膜,经校正t检验,差异具有统计学意义(P<0.001,图2)。IL-8 mRNA相对量与SERT mRNA相对量呈负相关(r=-0.59,P=0.002)。

图2溃疡性结肠炎结肠黏膜SERT和IL-8mRNA表达
Fig.2 Expressions of SERT and IL-8 mRNA in ulcerative colonic mucosa
A:SERT mRNA表达;B:IL-8 mRNA表达。
2.3UC患者结肠黏膜TPH-1表达及其与结肠炎症的相关性免疫组化染色结果显示,TPH-1主要在上皮细胞中表达,在活动期黏膜和缓解期黏膜组织中均有表达。活动期黏膜TPH-1 mRNA相对量与缓解期黏膜相比,差异无统计学意义(P=0.420)。TPH-1 mRNA的表达与黏膜IL-8 mRNA表达无显著相关性(r=0.28,P=0.100,图3)。

图3溃疡性结肠炎患者结肠黏膜TPH-1表达
Fig.3 Expression of TPH-1 in ulcerative colonic mucosa
A:肠上皮细胞TPH-1表达(缓解期);B:肠上皮细胞TPH-1表达(活动期);C:TPH-1 mRNA表达。
2.4R型和UR型缓解期黏膜中SERT、TPH-1的表达缓解期R型黏膜大体表现与正常黏膜较为一致,两种黏膜组织Matts组织学分级差异无统计学意义(P=0.172)。R型黏膜SERT基因mRNA的表达相对量与UR型黏膜相比,差异具有统计学意义(P<0.001);两组SERT基因表达水平与活动期黏膜SERT基因表达相比,差异均具有统计学意义(P1<0.001,P2<0.001)。R型黏膜TPH-1 mRNA相对表达水平与UR型黏膜相比,差异无统计学意义(P=0.840,图4)。
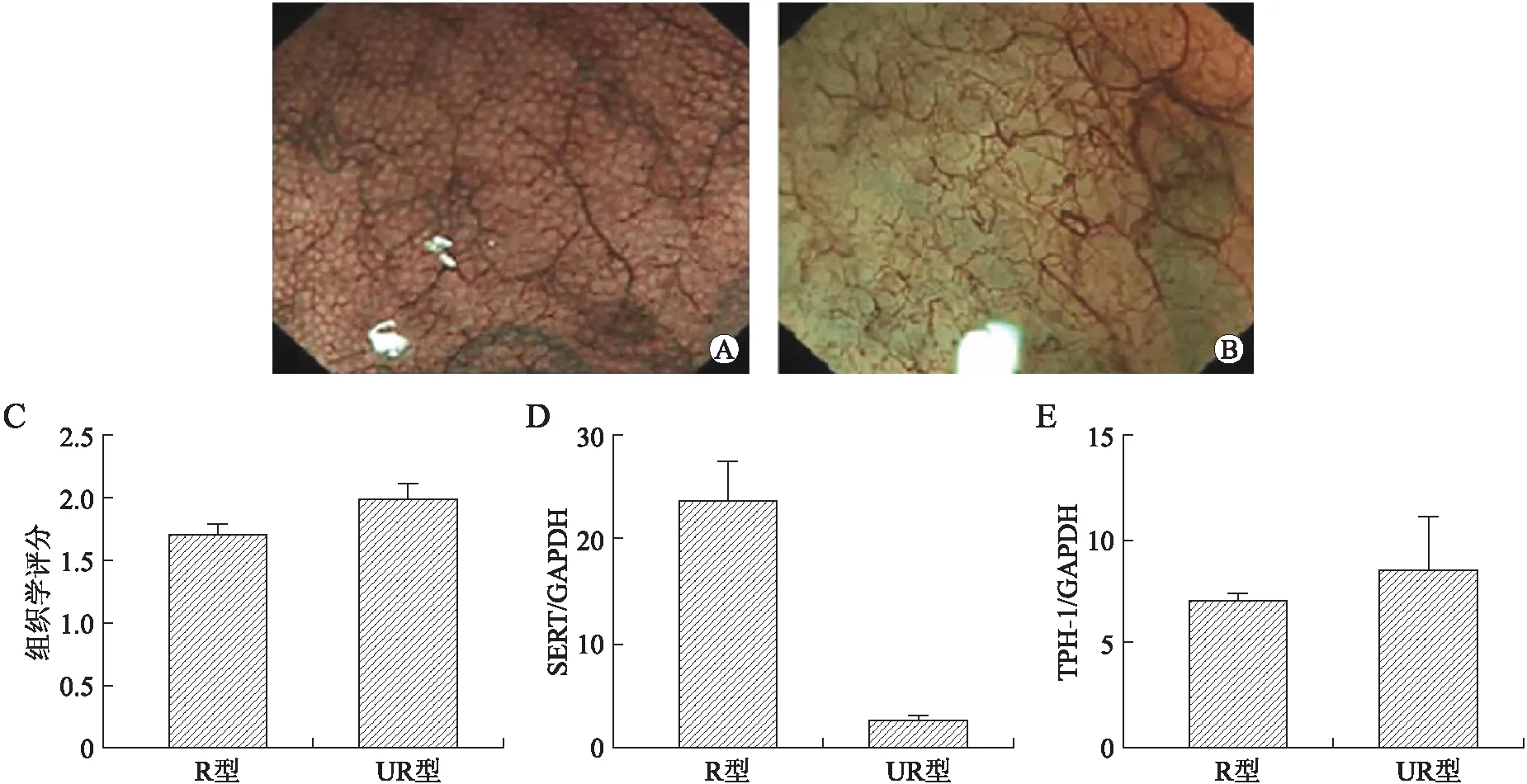
图4常规血管型和非常规血管型缓解期黏膜NBI成像及SERT表达
Fig.4 NBI images and expression of SERT genes in colonic mucosa of irregular pattern and regular vessel pattern
A:R型黏膜NBI成像;B:UR型黏膜NBI成像;C:组织学评分对比;D:SERT mRNA表达;E:TPH-1 mRNA表达。
2.5R型和UR型缓解期黏膜中炎症/成血管通路基因的表达高通量PCR分析结果提示,在84个基因中,10个基因在UR型黏膜组织中增高(图5),其中IL-1β、IL-8、CXCL3、CXCL5、CXCL1 mRNA相对表达水平显著增高。上述基因在不同分期不同分型黏膜中表达如图6所示。与3种黏膜SERT表达水平做相关性分析,结果见表1。
2.6小鼠结肠炎模型SERT和MIP-2的表达造模后84 d时,DSS诱导的小鼠结肠炎模型中结肠组织中巨噬细胞炎性蛋白2(MIP-2)mRNA相对表达水平为1.54±0.53,对照组为0.03±0.01,经t检验,差异具有统计学意义(P=0.020),提示模型构建成功。模型组SERT基因mRNA的表达相对浓度比为0.81±0.04,对照组为1.80±0.30,经t检验,差异具有统计学意义(P=0.001)。对比模型组SERT基因表达水平,在造模后84 d内持续降低,MIP-2表达在造模过程中持续升高,停用DSS后下降。

图5常规血管型和非常规血管型缓解期黏膜中炎症/成血管通路基因的表达
Fig.5 Expression of inflammation- and angiogenesis-related genes in colonic mucosa of irregular pattern and regular vessel pattern

图65种炎症/成血管通路基因在不同分期分型黏膜中的相对表达
Fig.6 Expressions of five kinds of inflammation- and angiogenesis-related genes in colonic mucosa of different stages and types
表15种炎症/成血管通路基因与SERT表达的相关性分析
Tab.1 Correlation of five kinds of inflammation- and angiogenesis-related genes and the expression of SERT mRNA

基因相关系数PIL⁃1β0.5190.001IL⁃80.631<0.001CXCL30.6580.001CXCL50.970<0.001CXCL10.923<0.001
3 讨 论
本研究结果提示,在活动期UC患者其结肠黏膜组织SERT基因表达下调,动物实验结果与之一致。SERT基因在缓解期UC患者结肠黏膜中表达与局部炎症因子表达具有相关性,由于局部低程度的炎症持续存在,可能导致SERT基因表达下调未恢复至正常。
SERT是5-HT的再摄取转运体,主要调节黏膜中5-HT的浓度,SERT基因水平下调,导致5-HT水平升高,影响胃肠正常运动功能,导致肠胃运动亢进或者障碍。既往研究多提示异常的SERT基因水平与IBS的发生密切相关。腹泻型IBS患者血小板中SERT表达量明显减少。SERT mRNA与十二指肠炎症活动具有负相关性,SERT表达水平下降还可能影响上消化道系统功能[12]。SERT基因启动子区域的多态序列存在44对基本的缺失或者突变,可以形成S/L型等位基因。SS和SL型基因型与SERT mRNA的低水平转录具有相关性,是腹泻型IBS的危险因素[13]。还有研究指出,SERT启动子区域多态性与腹泻型IBS发生无相关性[14]。因此,SERT基因多态性是否是SERT水平影响胃肠功能的具体机制,这一观点还存在较多争议。本研究未做相关多态性研究。
UC中SERT表达的相关研究报道不多。COATES等[15]发现UC患者结肠上皮细胞SERT mRNA的含量与免疫反应程度具有负相关性;LACKNER等[16]利用UC和克罗恩病患者活检组织,检测SERT mRNA,结果提示克罗恩病患者活检组织SERT表达量较高。有研究报道了SERT在UC缓解期黏膜中的表达水平与炎症的关系[17],文中分型与SERT表达结果与本研究类似,但是该研究中未比较活动期黏膜与不同分型黏膜的SERT水平差异。本研究结果提示,在活动期UC结肠黏膜组织中SERT的相对表达水平显著低于缓解期不同分型结肠黏膜,SERT表达水平与IL-8炎性因子表达具有显著相关。本研究严格筛选研究对象,入选对象经临床病史、症状以及内镜检查确诊,采用RT-PCR技术检测SERT mRNA的表达情况,结论较为可靠。另外,上述相关研究中未分析IBS临床症状与SERT相关性,本研究结论提示UC患者IBS样症状与SERT基因表达具有显著相关性。
组织病理学评估以及免疫组织化学染色结果也支持上述结论。在结肠炎动物模型中SERT在肠上皮细胞表达,模型组炎性蛋白MIP-2表达增加,在停止DSS干预后,MIP-2水平回落,但是该组SERT表达持续呈低水平表达。在使用细菌制剂或者TNBS等诱导的肠炎中可以观察到类似结果[18]。
本研究检测了TPH-1 mRNA的相对水平,结果显示TPH-1表达在不同疾病分期标本中无显著差异,与炎性因子表达无关。TPH-1是参与5-HT合成的重要物质,该结果显示5-HT水平改变导致的胃肠功能紊乱可能与TPH-1无关,侧面反映了SERT在上述病理过程的重要作用。
本研究通过NBI成像技术,将缓解期结肠黏膜分为R型和UR型,结果显示SERT表达在UC患者缓解期黏膜中表达受到抑制,在UR型的缓解期黏膜中下降明显。高通量PCR分析结果显示,在UR型的缓解期黏膜中很多炎症及血管相关基因表达上调,提示UR型黏膜存在低程度的炎性活动。上述结果提示,SERT在UR型黏膜中表达下降与低程度的炎症活动存余有关。
近年来,有研究报道胃肠道免疫激活可能参与IBS的发生[19]。研究提示低程度的肠道炎症以浆细胞、T细胞和巨噬细胞浸润为表现,以前炎性因子的表达增加以及上皮细胞增生为特征。LAM等[20]检测IBS患者十二指肠部位活检标本时发现,组织上皮间隙淋巴细胞和浆细胞增多,SERT基因表达下调。SERT基因在IBS发病过程的重要作用已有较多文献报道。本研究通过上述检查发现的SERT基因在炎症性结肠炎患者结肠黏膜的表达程度及规律,一方面为UC患者IBS样症状形成的病理机制提供一定基础;另一方面也揭示炎症过程与SERT基因表达的关系,为IBS疾病研究提供证据。
综上所述,本研究发现SERT在溃疡性患者活动期黏膜中表达下调,局部黏膜存在低程度炎症时,缓解期黏膜中SERT表达水平仍然下调。提示SERT参与 UC患者IBS样症状形成的病理过程。
参考文献:
[1] SPILLER R, MAJOR G. IBS and IBD separate entities or on a spectrum?[J]. Nat Rev Gastroenterol Hepatol, 2016, 13(10):613-621.
[2] STANISIC V, QUIGLEY EM. The overlap between IBS and IBD—what is it and what does it mean?[J]. Expert Rev Gastroenterol Hepatol, 2014, 8(2):139-145.
[3] LIU W, XIE Y, MA J, et al. IBS: An illustrator for the presentation and visualization of biological sequences[J]. Bioinformatics, 2015, 31(20):3359-3361.
[4] BARBARA G. IBS: Biomarkers for IBS: Ready for prime time?[J]. Nat Rev Gastroenterol Hepatol, 2015, 12(1):9-10.
[5] STAUDACHER HM, IRVING PM, LOMER MC, et al. Mechanisms and efficacy of dietary FODMAP restriction in IBS[J]. Nat Rev Gastroenterol Hepatol, 2014, 11(4):256-266.
[6] NAZIR S, KUMAR A, CHATTERJEE I, et al. Mechanisms of intestinal serotonin transporter (SERT) upregulation by TGF-β1 induced non-Smad pathways[J]. PLoS One, 2015, 10(5):2571-2579.
[7] JIN DC, CAO HL, XU MQ, et al. Regulation of the serotonin transporter in the pathogenesis of irritable bowel syndrome[J]. World J Gastroenterol, 2016, 22(36) :8137-8148.
[8] HOU X, CHEN S, ZHANG Y, et al. Quality of life in patients with irritable bowel syndrome (IBS), asses?[J]. Clin Drug Investig, 2014, 34(11):783-793.
[9] PUTIGNANI L, DEL CF, VERNOCCHI P, et al. Gut microbiota dysbiosis as risk and premorbid factors of IBD and IBS along the childhood-adulthood transition.[J]. Inflamm Bowel Dis, 2016, 22(2):487-504.
[10] 靳继伟, 王迎寒, 张晓峰. 5-HT信号通路在肠易激综合征发病机制中的研究进展[J]. 承德医学院学报, 2015,32(6):514-516.
[11] SCHOENFELD P, PIMENTEL M. Editorial: Safety and tolerability of rifaximin for IBS—more information is required; authors’ reply[J]. Aliment Pharmacol Ther, 2014, 40(2):208.
[12] DRABE M, BOETTCHER Y, RULLMANN M, et al. Serotonin transporter (SERT) gene methylation is associated with in vivo SERT availability and body-mass-index (BMI) in obese subjects[J]. J Nucl Med, 2015, 56(supple 3):34.
[13] BILIC P, JUKIC V, VILIBIC M, et al. Treatment-resistant schizophrenia and DAT and SERT polymorphisms[J]. Gene, 2014, 543(1):125-132.
[14] LEE BY, PARK SY, RYU HM, et al. Changes in the methylation status of DAT, SERT, and MeCP2 gene promoters in the blood cell in families exposed to alcohol during the periconceptional period[J]. Alcohol Clin Exp Res, 2015, 39(2):239-250.
[15] COATES M, WILLIAMS ED, TINSLEY A, et al. Sa1904 tobacco use and pouchitis in ulcerative colitis with restorative proctocolectomy: A mixed story[J]. Gastroenterology, 2016, 150(4):S398.
[16] LACKNER JM, GUDLESKI GD, THAKUR ER, et al. The impact of physical complaints, social environment, and psychological functioning on IBS patients health perceptions: Looking beyond GI symptom severity[J]. Am J Gastroenterol, 2014, 109(2):224-233.
[17] TADA Y, ISHIHARA S, KAWASHIMA K, et al. Downregulation of serotonin reuptake transporter gene expression in healing colonic mucosa in presence of remaining low-grade inflammation in ulcerative colitis[J]. J Gastroenterol, 2016, 31(8):1443-1452.
[18] LEE Y, KIM W, HONG S, et al. Colon-targeted celecoxib ameliorates TNBS-induced rat colitis: A potential pharmacologic mechanism and therapeutic advantages[J]. Eur J Pharmacol, 2014, 726(1):49-56.
[19] OHMAN L, SIMRÉN M. Pathogenesis of IBS: role of inflammation, immunity and neuroimmune interactions[J]. Nat Rev Gastroenterol Hepatol, 2010, 7(3):163-173.
[20] LAM C, TAN W, LEIGHTON M, et al. OC-069 Mesalazine for treatment of diarrhoea-predominant irritable bowel syndrome (ibs-d): A multi-centre, parallel group, randomised placebo controlled trial[J]. Gut, 2014, 63(Suppl 1):123-124.
