外源消化酶对断奶羔羊营养物质消化代谢的影响
2018-04-24韩向敏王彩莲潘发明宋淑珍宫旭胤
孟 芳, 韩向敏, 王彩莲, 潘发明, 宋淑珍, 郎 侠, 王 斐, 宫旭胤
(1.甘肃农业大学动物科技学院,甘肃兰州730070;2.甘肃省农业科学院畜草与绿色农业研究所,甘肃兰州730070)
外源消化酶是提高反刍动物饲料利用率的一种新型饲料添加剂,愈来愈受到人们的重视。将外源淀粉酶、蛋白酶添加到幼畜日粮中,不但能补充内源酶不足,而且能刺激内源酶的分泌和活性。将淀粉分解成糊精、麦芽糖和葡萄糖等,将蛋白质分解成多肽、寡肽和氨基酸,有利于幼畜对淀粉和蛋白质的消化和吸收(刘瑞玲,2009)。在羔羊饲粮中添加不同组合的外源消化酶,可以提高羔羊日均采食量、日均增重、饲料转化效率(辛总秀,2012)。外源酶的添加可以促进机体内源酶的分泌,并对幼龄动物胃肠道、肝脏及胰腺的发育有促进作用(沈水宝等,2005)。目前关于外源酶制剂对断奶羔羊营养物质消化和血液生化指标的影响这方面的研究很少。因此,本试验研究在断奶羔羊精料中添加不同种类的外源酶制剂,先饲喂精料,然后饲喂粗饲料,通过检测试验羊营养物质消化率和血液生化指标,探讨精料中添加外源酶制剂对断奶羔羊的营养促进作用,为其在幼龄反刍动物生产中的应用提供科学依据,同时也为外源酶制剂在反刍动物生产中推广应用提供参考。
1 材料与方法
1.1 试验材料 外源消化酶为市场售的分析纯,皆为固体粉末状,其活力为:中性蛋白酶≥60000 U/g(中国)、α-淀粉酶≥3700 U/g(中国)、纤维素酶 30000 U/g(C8270 Cellulase,日本)。
1.2 试验动物与试验设计 选择25只遗传基础相同,出生日期相近、健康、生长发育正常、体重相近的小尾寒羊(♀)×萨福克(♂)杂交一代公羔羊,2月龄断奶(断奶重12 kg),随机分为5组,分别为Ⅰ组,对照组:基础日粮;Ⅱ组:基础日粮+纤维素酶+蛋白酶+淀粉酶 (纤维素酶13000 IU/kg精料,蛋白酶13000 IU/kg精料,淀粉酶14000 IU/kg精料);Ⅲ组:基础日粮+淀粉酶(30000 IU/kg精料);Ⅳ组:基础日粮+蛋白酶(30000 IU/kg精料);Ⅴ组∶基础日粮+纤维素酶(30000 IU/kg精料),见表1,所有试验羊按饲养场原免疫程序进行免疫注射。各组羔羊20日龄补饲基础日粮和干净的苜蓿干草,任其采食,60日龄强制断奶,单笼饲养。采用单因素随机分组设计,以外源酶为试验因子,在体外发酵试验的基础上设计酶的添加量。试验期20 d,15 d预试期,5 d正式期。精料与消化酶混合后先喂精料,每只羔羊380 g/d,精料采食完毕,饲喂粗饲料(苜蓿干草),自由采食,日喂2次(07∶00、16∶00),自由饮水,精料配方及营养水平见表2。记录每只羔羊每天的采食量。

表1 试验分组

表2 羔羊精料配方及营养水平
1.3 样品采集与制备
1.3.1 饲料样品采集 正式期每次饲喂前取料样30 g,5 d的样混匀,取10 g测定饲料中的常规营养成分。
1.3.2 血样采集 羔羊于试验期结束当天晨饲前由颈静脉采血约5 mL,3000 g/min离心10 min,收集血浆,-20℃冷藏待测。
1.3.3 粪样采集与制备 采用全收粪法采集粪样。正式期内准确收集每只羊每日(日与日间以早饲后1~1.5 h为界限)全天24 h粪样。正式期第一天早上6∶00,给羔羊带上特制的收粪袋,隔6 h收集一次粪样。将每只羊5日所收粪样充分混匀,称重,取12.5%粪样置入玻璃瓶,加入2%的硫酸浸没粪样,放入冰箱内保存备测定粪氮用。粪样置铝盒中,在60~65℃条件下烘干至恒重,置室温下回潮24 h,称重、记录,磨碎过40目筛,取样装瓶,备测。
1.4 测定指标与方法
1.4.1 血液生化指标 羔羊颈静脉血液中的血糖(GLU)、 总蛋白 (TP)、 白蛋白 (ALB)、 球蛋白(GLOB)、尿素氮(UN)、谷丙转氨酶(ALT/GPT)活性、谷草转氨酶 (AST/GOT)活性、碱性磷酸酶(ALP/AKP)活性、乳酸脱氢酶(LDHL/LDH)活性、磷酸肌酸激酶(CK)活性等指标用血液生化指标仪进行测定。
1.4.2 消化代谢指标 饲料原料及粪样中的干物质参照《饲料中水分的测定方法》进行测定;能量用PARR1281氧弹式热量计;粗蛋白质参照GB/T 6432-1994《饲料中粗蛋白质测定方法》进行测定;粗脂肪、中性洗涤纤维(NDF)和酸性洗涤纤维(ADF)参照GB/T 6433-2006进行测定;粗灰分参照GB/T 6438-1992《饲料中粗灰分的测定方法》进行;钙、磷参照《饲料分析及饲料质量检测技术》中的高锰酸钾滴定法进行测定。
按下列公式计算养分消化率,公式如下:

1.5 数据统计分析 采用 Excel软件整理数据,数据统计分析采用SPSS 19.0软件ANOVA过程进行方差分析,多重比较用Turkey法。结果以“平均值±标准差”表示。
2 结果与分析
2.1 外源消化酶对断奶羔羊血液生化指标的影响 外源消化酶对断奶羔羊血液生化指标的影响,见表3。
表3为不同处理方式对断奶羔羊血液生化指标的影响。从表中可以看出,试验Ⅱ组谷草转氨酶、总蛋白、白蛋白、尿素氮、肌酸激酶、乳酸脱氢酶较对照组分别提高了 36.8%、2.8%、12.4%、71.7%、16.8%、8.5%。碱性磷酸酶、球蛋白、葡萄糖较对照组分别降低了19.1%、1.8%、3.6%;试验Ⅲ组谷草转氨酶、白蛋白、葡萄糖、尿素氮、乳酸脱氢酶较对照组分别提高了14.2%、16.3%、3.8%、43.5%、3.6%。谷丙转氨酶、碱性磷酸酶、总蛋白、球蛋白、肌酸激酶较对照组分别降低了29.4%、2.5%、4.3%、14.1%、15.8%;试验Ⅳ组谷草转氨酶、碱性磷酸酶、白蛋白、葡萄糖、乳酸脱氢酶较对照组分别提高了 6.7%、3.5%、20.9%、7.8%、7.0%。谷丙转氨酶、总蛋白、球蛋白、尿素氮、肌酸激酶较对照组分别降低了21.6%、3.8%、15.6%、16.3%、8.2%;试验Ⅴ组总蛋白、白蛋白、尿素氮较对照组分别提高了4.9%、5.4%、10.1%。谷丙转氨酶、谷草转氨酶、碱性磷酸酶、球蛋白、葡萄糖、肌酸激酶、乳酸脱氢酶较对照组分别降低了 2.9%、4.5%、48.8%、1.8%、10.9%、32.5%、20.4%。由此可见,与对照组相比,添加复合酶制剂可以提高谷草转氨酶 (谷草转氨酶/GOT)、总蛋白 (TP)、白蛋白、尿素氮 (UN)、肌酸激酶(CK)、乳酸脱氢酶(LDHL/LDH)的含量;外源消化酶对谷丙转氨酶、球蛋白、葡萄糖的含量影响较小。
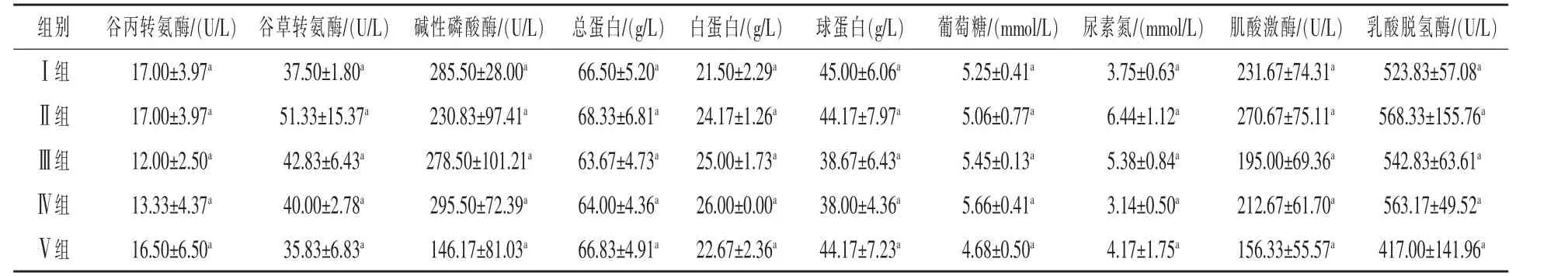
表3 不同处理对断奶羔羊血液生化指标的影响
2.2 外源消化酶对断奶羔羊采食量的影响 外源消化酶对断奶羔羊采食量的影响见表4。可以看出,试验组采食量较对照组分别降低了30.6%、44.1%、27.9%、39.4%。其中,试验Ⅱ组、Ⅲ组、Ⅴ组采食量极显著低于对照组(P<0.01);试验Ⅳ组的采食量显著低于对照组(P<0.05);各试验组间差异不显著(P>0.05)。酶制剂的添加显著降低了羔羊的采食量。
2.3 外源消化酶对断奶羔羊营养物质消化率的影响 表5为不同处理对断奶羔羊营养物质消化率的影响。可以看出,试验组干物质消化率较对照组分别降低了 10.1%、13.5%、8.2%、6.4%;试验Ⅱ组粗蛋白质消化率较对照组提高了0.6%;试验Ⅲ组、Ⅳ组、Ⅴ组粗蛋白质消化率较对照组分别降低了 10.6%、13.5%、8.2%、6.4%;试验组粗脂肪消化率较对照组分别降低了6.1%、5.8%、20.61%、2.4%;试验组能量消化率较对照组分别降低了10.5%、13.6%、9.1%、6.3%;试验组NDF消化率较对照组分别降低了26.1%、31.9%、14.9%、12.6%;试验组ADF消化率较对照组分别降低了 20.7%、28.2%、13.0%、10.8%;试验组钙消化率较对照组分别降低了37.6%、62.4%、40.1%、38.3%;试验组磷消化率较对照组分别降低了3.4%、4.4%、31.1%、38.4%。试验Ⅱ组、Ⅲ组的NDF消化率显著低于对照组 (P<0.05);各试验组间差异不显著(P>0.05)。试验Ⅲ组的ADF消化率极显著低于对照组 (P<0.01);各试验组间差异不显著(P>0.05)。干物质、粗蛋白质、粗脂肪、能量、钙、磷消化率等指标差异不显著(P>0.05)。外源消化酶对断奶羔羊的采食量、干物质、粗蛋白质、粗脂肪、能量、NDF、ADF、钙、磷的消化率有下降趋势。本试验结果表明在断奶羔羊日粮中添加外源消化酶对促进干物质、粗蛋白质、粗脂肪、能量、NDF、ADF、钙、磷的消化率无显著影响。

表4 不同处理对断奶羔羊采食量的影响
3 讨论
3.1 外源消化酶对断奶羔羊血液生化指标的影响谷丙转氨酶是肝脏高度特异性酶,适应症为各种肝炎及其他肝病。肝损伤时,因肝细胞病变而使谷丙转氨酶释放到血液中,故血清中此酶活性升高,其增高程度与肝细胞破坏程度成正比。谷草转氨酶是在氨基酸分解和合成中起重要作用的一类酶,主要来自肝细胞并广泛存在于线粒体中。血液中谷草转氨酶的含量与心脏的功能密切相关,并且与绵羊的生长发育速度及生产性能具有较强的相关性(王建刚等,2006)。绵羊机体的调节和适应能力在一定程度上取决于各项血清酶的表达水平 (董淑丽等,2004)。本试验中,血清中谷草转氨酶含量高于正常值,可能与绵羊肝脏的代谢水平、生长发育速度等有关(罗建川等,2015)。卡拉库尔羊谷丙转氨酶较绵羊正常水平低,谷草转氨酶活性在正常范围内,表明卡拉库尔羊的肝脏功能正常(李树伟等,2005)。从本试验结果可以看出,试验Ⅲ组谷草转氨酶的含量高于其他组,与张峰(2004)的结果相似。试验中各试验组的谷丙转氨酶含量均低于对照组,说明外源酶的添加对断奶羔羊的肝脏功能并无影响。
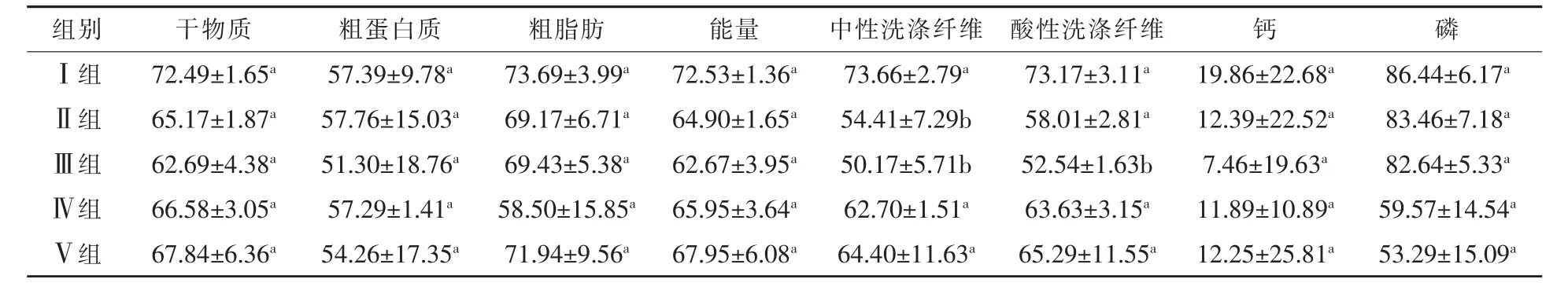
表5 不同处理对断奶羔羊营养物质消化率的影响%
尿素氮是通过鸟氨酸循环合成,是蛋白质和氨基酸代谢的终产物,其质量浓度受饲料中蛋白质和氨基酸含量的影响,其含量与体内氮沉积率,蛋白质或氨基酸的利用率显著负相关。在日粮蛋白质含量稳定的情况下,血清下降是蛋白质利用率增强的结果(邱玉朗等,2013)。对于反刍动物而言,血液中的尿素氮一部分通过血液循环由唾液和瘤胃壁的渗透进入瘤胃再次被利用,另一部分经肾脏随尿液排出体外。血清尿素氮是动物体内反映蛋白质代谢和日粮氨基酸平衡状况的指标(Stanley等,2002)。当日粮中含氮物质增高,或体内氨基酸代谢旺盛、组织遭受破坏、核蛋白清除量增加、肾功能障碍和血中尿素得不到正常排除等,均会使血浆尿素氮浓度升高 (张宏福等,2001;Kanjanapruthipong,1998)。 有相关报道称,尿素氮除与采食蛋白质的量有关外,还与蛋白质特别是可消化蛋白质的利用率有关。该实验中,添加复合酶制剂的试验组羔羊血液中尿素氮的含量较对照组有所增高。表明复合酶制剂的添加导致断奶羔羊体内氮沉积率下降,降低了蛋白质的利用率。断奶羔羊瘤胃体系尚未发育完善,缺乏分解利用纤维素酶、蛋白酶和淀粉酶的微生物。故使其不能得到充分的利用。这也是试验中断奶羔羊血液中尿素氮的含量升高的一个原因。
总蛋白是白蛋白和球蛋白的总称。白蛋白是由肝脏合成的;球蛋白中的A-球蛋白主要是由肝脏合成,C-球蛋白及某些B-球蛋白主要在网状内皮系统的浆细胞内合成。它们有维持血浆正常胶体渗透压、运输脂肪酸和胆红素、维持血浆pH恒定等作用(白俊艳等,2010)。试验组中白蛋白的含量都有所增加,且以试验Ⅱ组的含量最高,球蛋白的含量对照组高于其他各组,这可能是由于羔羊的免疫系统还未发育完全,故不能充分利用外源酶提高其球蛋白含量,增强免疫功能。
反刍动物的血糖主要是由体内生糖物质转化而来 ,其每天所需要的葡萄糖中90%以上是靠糖异生作用在体内合成的,约10%来源于消化道吸收。而糖异生作用的主要前体物就是丙酸,如果大量饲喂低质粗饲料,就会使反刍动物瘤胃中发酵产生的丙酸数量不足,无法满足糖异生作用的正常进行,机体就不得不动员血液内源生糖氨基酸来合成葡萄糖,这就会导致机体蛋白质沉积下降、氮平衡趋于负值、母畜产奶量下降,并出现代谢病等一系列问题(杨凤,2004)。试验组的血糖含量与对照组相比,差异并不明显,由此可见,日粮中添加外源酶对断奶羔羊的血糖含量并无明显影响。
碱性磷酸酶是一种磷酸单酯酶,在肝脏、骨骼、肠和肾等重要组织器官均有分布,该酶可催化磷酸分子,其在血液中的含量与骨骼发育存在关联(王秋颖,2011)。在该试验中,试验组中碱性磷酸酶的含量较对照组低,外源复合酶对断奶羔羊的骨骼发育并无促进作用。
肌酸激酶是一类细胞内转移酶,广泛存在于横纹肌、心肌和脑组织,以横纹肌含量最多,具有组织器官特异性。有研究发现,肌酸激酶活性高,失水率高,pH低,且肌酸激酶活性与胴体瘦肉率有一定相关性(韩剑众等,2002)。另外,肌酸激酶也是反映动物应激状态的敏感指标,肌酸激酶活性高的动物抗应激能力弱。本试验中,试验组中肌酸激酶的含量较对照组高,尤以试验Ⅱ组含量最高。
乳酸脱氢酶广泛存在于机体各组织中,有研究表明,血清乳酸脱氢酶活性与酮体瘦肉率及平均日增重呈正相关。血液中乳酸脱氢酶活性随着年龄的增长有所降低(王高富等,2013)。本试验结果显示,试验组中乳酸脱氢酶的含量较对照组高,尤以试验Ⅱ组含量最高。
3.2 外源消化酶对断奶羔羊采食量的影响 采食量是衡量反刍动物生产性能和生产潜力的一项重要指标,是科学配制动物日粮的前提,它决定着维持动物健康和生产所需营养物质的数量,也是决定反刍动物生产力水平高低的重要因素(李茂等,2013)。反刍动物的采食是一个复杂的、动态的、生物和非生物因素相互作用和相互影响的过程,其受动物、饲粮、环境、生理和管理等因素的影响(龙瑞军等,2003)。该试验中,在羔羊日粮中添加外源消化酶显著降低了断奶羔羊的采食量。这可能是由于羔羊消化器官发育不成熟、消化机能不完善,早期或超早期断奶后面临着从液态母乳到液态乳与固态饲料混合物的快速转变及对日粮发生过敏反应两个过程 (宋代军等,2007)。在此过程中,羔羊消化道pH升高、肠道受损、胃肠道主要消化酶活性降低,故羔羊的采食量变小(张英杰等,2005)。本试验中,添加外源消化酶显著降低断奶羔羊的采食量。试验Ⅱ组、Ⅲ组、Ⅴ组采食量极显著低于对照组(P<0.01);试验Ⅳ组的采食量显著低于对照组 (P<0.05);各试验组间差异不显著(P>0.05)。近年来的研究表明,在以苜蓿干草或大麦为基础的日粮中添加纤维素酶,也没有提高羔羊采食量和日增重(何受春,2010)。这与本试验结果相似。
3.3 外源消化酶对断奶羔羊营养物质消化率的影响 饲粮中添加外源消化酶能补充羔羊内源性消化酶的不足,提高对营养物质的消化率,有利于将羔羊消化道内大分子营养物质转化为小分子,便于消化吸收(辛总秀,2012)。本试验结果显示,试验Ⅱ组、Ⅲ组的NDF消化率显著低于对照组(P < 0.05);各试验组间差异不显著(P > 0.05)。试验Ⅲ组的ADF消化率极显著低于对照组 (P<0.01);各试验组间差异不显著(P>0.05)。干物质消化率,粗蛋白质消化率,粗脂肪消化率,能量消化率,钙消化率,磷消化率等指标差异不显著(P>0.05)。外源消化酶对断奶羔羊的干物质、粗蛋白质、粗脂肪、能量、NDF、ADF、钙、磷的消化率有下降趋势。可能是由于羔羊断奶致使小肠各段的绒毛高度降低和隐窝深度加深,肠绒毛上皮成熟细胞数量减少,因而造成羔羊肠道消化吸收面积减少,消化能力下降(宋代军等,2007)。有研究表明,在以粉碎的玉米和苜蓿干草日粮中添加淀粉酶、纤维素酶、蛋白水解酶的混合制剂后饲喂育肥羔羊,结果并没有提高羔羊的饲料转化率和日增重(何受春,2010)。这与本试验结果相似。
4 结论
在本试验条件下,添加外源酶制剂断奶羔羊的采食量显著降低;淀粉酶显著或极显著降低断奶羔羊NDF、ADF消化率;纤维素酶+淀粉酶+蛋白酶混合会极显著降低断奶羔羊NDF消化率。添加复合酶制剂对断奶羔羊血液生化指标造成一定的影响。
[1]白俊艳,赵淑娟,庞有志,等.河南地方绵羊品种的血液生化指标比较分析[J].江苏农业科学,2010,3:271 ~ 272.
[2]董淑丽,王占彬,雷雪芹,等.热应激对动物血液生化指标的影响[J].家畜生态学报,2004,25(2):54 ~ 56.
[3]韩剑众,董文明,葛长荣,等.中草药添加剂饲喂猪肉中CPK,GPI活性和肉质关系的研究[J].云南农业大学学报,2002,17(1):91~93.
[4]何受春.反刍动物饲用酶制剂应用效果研究[J].现代商贸工业,2010,22(12):328 ~ 328.
[5]李茂,字学娟,徐铁山,等.季节和生长阶段对海南黑山羊采食量的影响[J].西南农业学报,2013,26(6):2596 ~ 2600.
[6]李树伟,许宗运,应璐,等.卡拉库尔羊血液生化指标常值测定[J].塔里木大学学报,2005,17(1):8 ~ 10.
[7]刘瑞玲.酶制剂及其在奶牛养殖中的应用 [J].中国奶牛,2009,3:19 ~ 22.
[8]龙瑞军,董世魁,王元素,等.反刍动物采食量的概念与研究方法[J].草业学报,2003,12(5):8 ~ 17.
[9]罗建川,王强军,张彦,等.贵州杂交绵羊体重体尺及血液生化指标测定与分析[J].安徽农业大学学报,2015,42(5):715 ~ 720.
[10]邱玉朗,罗斌,于维,等.发酵全混合日粮对肉羊生长性能与血液生化指标的影响[J].饲料研究,2013,12:46~48.
[11]沈水宝,冯定远.外源酶对仔猪消化道发育及消化系统酶活性的影响[C]//全国酶制剂在饲料工业中应用学术与技术研讨会.2005.
[12]宋代军,张家骅,杨游,等.羔羊不同断奶日龄对小肠黏膜形态的影响[J].动物营养学报,2007,19(4):344 ~ 349.
[13]王高富,黄勇富,任航行,等.酉州乌羊血液生化指标测定及其相关性分析[J].中国农学通报,2013,29(35):47 ~ 52.
[14]王建刚,宋宇轩,程雪妮,等.杜泊羊主要血清生化指标的测定[J].西北农林科技大学学报:自然科学版,2006,34(3):26 ~ 28.
[15]王秋颖.碱性磷酸酶特性及其应用的研究进展[J].中国畜牧兽医,2011,38(1):157 ~ 161.
[16]辛总秀.外源消化酶对羔羊营养物质消化率及生产性能的影响[J].粮食与饲料工业,2012,9:53 ~ 55.
[17]杨凤.动物营养学[M].中国农业出版社,2004.
[18]张峰.不同氮源对绵羊生长性能、消化代谢及血清生化指标的影响[D].河北农业大学,2004.
[19]张宏福,顾宪红.仔猪营养生理与饲料配制技术研究[M].中国农业科技出版社,2001.
[20]张英杰,刘月琴,孙洪新,等.羔羊小肠pH及主要消化酶发育规律的研究[J].畜牧兽医学报,2005,36(2):149 ~ 152.
[21] Kanjanapruthipong J.Supplementation of milk replacers containing soy protein with threonine,methionine,and lysine in the dietsof calves[J].Journal of Dairy Science,1998,81(11):2912.
[22]Stanley C C,Williams C C,Jenny B F,et al.Effects of Feeding Milk Replacer Once Versus Twice Daily on Glucose Metabolism in Holstein and Jersey Calves 1[J].Journal of Dairy Science,2002,85(9):2335 ~ 2334.
