遮阴对黎药鳄嘴花生长动态及生物量分配的影响研究
2018-04-23邱明红连春枝刘盛波杜尚嘉吴挺佳吴海霞陈国德
邱明红,连春枝,刘盛波,杜尚嘉,吴挺佳,吴海霞,陈国德
(海南省林业科学研究所,海南 海口571158)
鳄嘴花[Clinacanthusnutans(Burm. f.)Lindau]别名忧遁草,为爵床科鳄嘴花属(Clinacanthus)高大草本,直立或有时攀援状。鳄嘴花具有较好的营养保健和药用价值,全株均可入药[1]。目前,从鳄嘴花分离得到的17种氨基酸中,7种为人体必需氨基酸[2],具有很好的保健作用。从鳄嘴花中分离鉴定的化合物包括甾醇类、三萜类、黄酮碳苷、含硫糖苷、脑苷类、叶绿素类、megastigmanes、benzenoids及生物碱类等,其具有抗病毒、抗氧化、抗肿瘤、抗炎、抗菌及免疫调节等广泛的药理作用,且毒理研究表明其无毒副作用或毒副作用小[3-6]。此外,有研究从鳄嘴花叶片分离得到羽扇豆醇、异牡荆苷、β-胡萝卜苷和肥皂草苷4种主要成分,它们分别对保护人体心脏、肝脏,降低血脂以及心血管疾病的治疗均有帮助[7-9]。
鳄嘴花生长于低海拔亚热带疏林中或灌丛内[10]。近年来,由于生态环境恶化,导致鳄嘴花生境遭到严重破坏。此外,其药用、保健作用日益被人们重视也加剧了野生资源的过度采集,导致野生资源日益匮乏。国内外对鳄嘴花的研究主要集中在其化学成分、毒理及营养价值等[11-13]。但是,针对鳄嘴花栽培技术方面的研究鲜见报道。本研究拟通过对鳄嘴花进行不同遮阴差异处理试验,探索鳄嘴花栽培过程中对光照强度要求,以期为鳄嘴花栽培及增产提供理论依据。
1 材料与方法
1.1 材料与试验方法
1.1.1 试验材料
试验所用材料来源海南省五指山市海南省林业科学研究所大院内,经多位植物学专家鉴定为鳄嘴花。
1.1.2 试验方法
(1) 扦插处理方法
利用剪刀剪取长度为(15±2) cm的鳄嘴花健壮插条若干,剪取枝条上叶片与分枝,每条插穗上尽量保留有2~3枝节,插穗上端剪为平面,下方为马蹄形。将剪好的插穗浸泡于清水约2 h后,以20 cm×10 cm株行距扦插于经多菌灵溶液消毒的插床,插床基质为红壤∶椰糠∶河沙=2∶1∶1。扦插后及时浇溉充足,并覆盖不同遮阴膜,如表1所示:

表1 各遮阴处理组光照强度 lx
(2) 研究指标的测定方法
扦插后定期对插穗进行愈伤组织、生根情况的观察,并统计其枝条数、枝节数、枝长、枝围、叶片数以及生物量等,每周一早上约8:30、中午约11:30、下午约17:30分别测定鳄嘴花叶片的叶绿素a、b以及总叶绿素浓度,各指标的测定方法如下:
1) 生物量分配比例(干重)[14]:生物量分配比例= 各构件生物量/总生物量×100%
2) 根冠比(干重):根冠比=地下部分质量(干重)/地上部分质量
3) 叶绿素含量[15]:将鳄嘴花新鲜叶片分别放入研钵中,用剪刀剪碎,加入适量的95%的乙醇,研磨至匀浆。将剪好的滤纸套入漏斗中,漏斗下接25 mL棕色容量瓶,用乙醇将研钵冲洗2~3次,全部冲入漏斗里,然后再将滤纸冲洗干净,最后用胶头滴管定容至25 mL。摇匀把叶绿素提取液倒入宽1cm的比色杯内,用分光光度计分别在波长649 nm、665 nm下测量其吸光值OD649和OD665,以95%乙醇为空白对照。得到的吸光值按公式分别计算叶绿素a、b的浓度(g/L),相加即得总浓度。公式如下:
OD649=24.58Ca+46.84CbOD665=83.81Ca+23.10CbC总=Ca+Cb
式中:Ca—叶绿素a的浓度;Cb—叶绿素b的浓度
1.1.3 数据处理方法
利用Excel对试验数据进行初步统计,并利用SPSS16.0对数据进行方差分析。
2 结果与分析
2.1 遮阴对鳄嘴花扦插生长的影响及不同遮光强度鳄嘴花的生长动态规律分析
2.1.1 遮阴差异对鳄嘴花愈伤组织产生率、生根率的影响分析生根率的影响分析

图1 遮阴差异对鳄嘴花愈伤组织产生率/生根率的影响
通过对不同遮阴强度条件鳄嘴花扦插的愈伤组织产生率和生根率观察可知(图1),L3愈伤组织产生率较高,为(80.0±14.0)%,L2较低,为(56.7±13.0)%,L3较L2愈伤组织产生率高23.3%,且L3与L2间差异显著(P<0.05),而L1、L3和L4两两间差异不显著(P>0.05)。通过对不同遮阴处理鳄嘴花扦插生根率的观测发现,各个处理组间生根率均差异不显著(P>0.05)。
2.1.2 遮阴差异下鳄嘴花叶片数和叶绿素浓度差异及其动态变化分析
通过连续4个月对各个遮阴处理组的鳄嘴花叶片统计得到(图2),各处理组鳄嘴花叶片随着试验进行,叶片数均逐渐增加。其中,L4处理组叶片平均增长率较快,为(142.4±2.6)%,而L2较慢,为(43.8±8.3)%,L4叶片增长率较L2高98.6%,且L4和L2在各个月份叶片数均差异显著 (P<0.05)。从叶量来看,L4叶量较大,为(96.4±7.3)片/株,而L1叶量较小,为(17.7±3.3)片/株,L4是L1的5.4倍,且两者均差异显著(P<0.05)。除5月份外,6—7月份各处理组随着遮阴强度下降叶量逐渐升高,且在7月份较为显著。

(a)

(b)
(c)
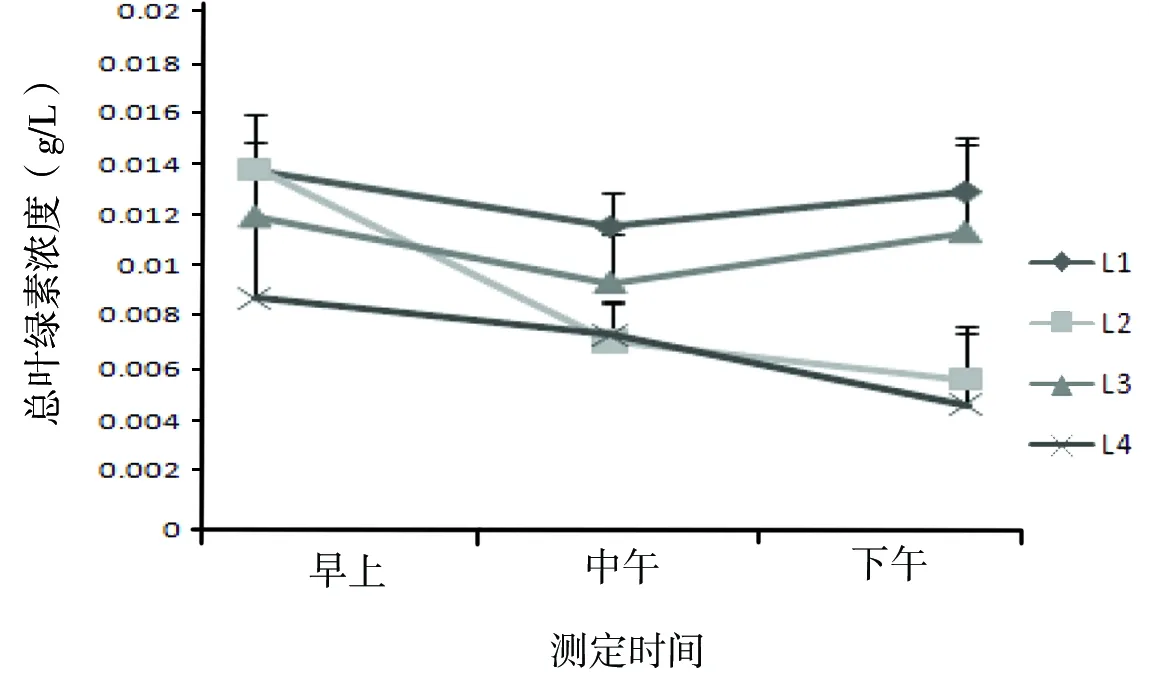
通过对各个处理组鳄嘴花连续3个月每天3个时间点叶绿素浓度的测定发现,除了L4处理组17:30时间点的叶绿素b外,同一时间点,同一处理条件叶绿素a、b以及总叶绿素浓度变化规律相似。
早上:各处理组随着遮光强度减弱,叶绿素a、b以及总叶绿素浓度逐渐下降。其中L1组叶绿素a、b以及总叶绿素浓度较高,分别为(0.012 3±0.004 0) g/L、(0.004 1±0.001 2)g/L和(0.016 4±0.001 7)g/L,L4的较低,分别为(0.008 1±0.004 9)g/L、(0.002 8±0.003 9)g/L、(0.010 9±0.002 5)g/L,L1叶绿素a、b以及总叶绿素浓度分别较L4高 0.004 3 g/L、0.001 3 g/L和0.005 5 g/L,两者间均差异显著(P<0.05)。
中午:各处理组在叶绿素a、b以及总叶绿素浓度变化相似,即均为L1高,分别为(0.010 6±0.005 0)g/L、(0.003 4±0.001 0)g/L和(0.014 0±0.004 1)g/L,而L2较低,分别为(0.007 1±0.003 0) g/L、(0.001 9±0.000 7)g/L和(0.009 0±0.001 4)g/L,但同一监测指标的不同遮光梯度处理变化规律不明显。通过方差分析发现,L1与L2、L3以及L4均差异显著(P<0.05),L2与L4差异不显著(P>0.05)。 L1叶绿素a、b以及总叶绿素浓度分别较L2高 0.003 5 g/L、0.002 5 g/L和0.005 0 g/L。
下午:不同遮光梯度的叶绿素a与总叶绿素浓度变化规律相似,但叶绿素b与叶绿素a、总叶绿素浓度变化规律存在差异,且同一监测指标的不同遮光梯度处理变化规律不明显。叶绿素a和总叶绿素均为,L1处理组浓度较高,分别为(0.011 7±0.003 6)g/L和(0.015 5±0.002 3)g/L,而L4较低,分别为(0.001 7±0.000 5)g/L和(0.006 2±0.001 1)g/L,且两者间存在显著差异(P<0.05)。而叶绿素b中,L4较高,为(0.004 5±0.001 3)g/L,而L2较低,为(0.001 7±0.000 7) g/L,且两者间差异显著(P<0.05),但是L4与L1差异不显著(P>0.05)。
2.1.3 遮阴差异下鳄嘴花枝长、枝条数、茎围以及枝节数差异及其动态变化分析
由图4(a)~(d)可知,随着遮阴强度减弱,鳄嘴花枝围、枝长、枝条数以及枝节数均逐渐升高,且差异逐渐明显。但是,各项监测指标的增长率变化规律不明显。鳄嘴花L4枝围、枝长、枝条数以及枝节数均较大,分别为(4.13±0.31)mm、(81.26±22.95)cm、(3.03±0.26)条/株和(23.41±1.31)节/株;L1较小,分别为(1.77±0.24)mm、(10.71±1.52)cm、(1.42±0.21)条/株和(6.11±1.22)节/株,且均存在显著差异(P<0.05)。L4枝围、枝长、枝条数以及枝节数分别是L1的2.3 、7.6 、0.7 和3.8倍。通过增长率监测发现,除了L2枝长增长率较高外,枝围、枝条数以及枝节数均为L4较高。通过方差分析发现,L2和L4枝长增长率差异不显著(P>0.05),与其余处理组枝长增长率均差异显著(P<0.05)。L4枝围、枝条数以及枝节数增长率均与其他处理组差异显著(P<0.05)。在枝围、枝长、枝条数以及枝节数4个指标中,较大增长率处理组分别比较小增长率处理组高52.6%、96.7%、35.7%和109.2%。

(a)

(b)

(c)

(d)

表2 遮阴处理组间枝长枝节数比(B/I)
此外,通过枝长与枝节数比发现,随着遮阴强度减弱,枝长枝节比逐渐增大,且差异显著(P<0.05),说明遮阴可能缩短了鳄嘴花节间长度。
2.2 遮阴差异对鳄嘴花生物量分配及根冠比的影响分析
2.2.1 遮阴差异对鳄嘴花根茎叶生物量分配的影响

表3 遮阴差异与鳄嘴花各构件生物量分配结果
通过对各遮阴处理组鳄嘴花生物量的测定发现,随着遮阴强度减弱,鳄嘴花总生物量逐渐增加。其中,L4总生物量较高,为(53.18±5.97)g/株,其与其他处理组均差异显著(P<0.05),而L1较低,为(1.25±0.44)g/株,L1与L2差异不显著(P>0.05),但是与L3、L4均差异显著(P<0.05),L4总生物量较L1高51.93 g/株,约是L1的43倍。通过对不同遮阴处理组鳄嘴花各构件的生物量分配比可知,随着遮阴强度减弱,各处理组根的分配比逐渐下降。其中,L1较高,为(7.6±0.4)%,L4较低,为(4.7±0.1)%,L1与其他处理组均差异显著(P<0.05),但是L2、L3、L4间均差异不显著(P>0.05);各遮阴处理组茎和叶的生物量分配比则刚好相反,即茎生物量分配大小为:L4>L3>L1>L2。而叶生物量分配大小为:L2>L1>L3>L4。其中,茎L4与L3差异不显著(P>0.05),与L1、L2均差异显著(P<0.05),L1与L2差异不显著(P>0.05),L4较L2高18.2%。而叶L1与L2差异不显著(P>0.05),与L3、L4均差异显著(P<0.05),L3与L4差异不显著(P>0.05),L2较L4高21.7%。
2.2.2 遮阴差异对鳄嘴花根冠比的影响分析
根据图5可知,随着遮阴强度减弱,鳄嘴花根冠比逐渐下降。说明随着遮阴强度减弱,鳄嘴花的地下部分下降,而地上部分升高。其中,L1根冠比较高(0.082),L4较低(0.050),L1与L2、L3、L4根冠比均差异显著(P<0.05),但L2、L3、L4件均差异不显著(P>0.05)。

图5 各遮阴处理组鳄嘴花根冠比(干重)
3 讨论与结论
3.1 讨论
光是重要的生态因子, 是植物进行光合作用的原初能量来源[16]。通过对鳄嘴花扦插可知,不同遮阴处理对鳄嘴花扦插愈伤组织和生根情况影响不显著。说明光强度对鳄嘴花愈伤组织产生、生根率影响不大,而可能与细胞全能性能力的高低、栽培基质成分关系更密切。有研究表明,光不是植物愈伤组织形成的必需条件。反而, 黑暗环境中愈伤组织诱导率比在光照条件下高, 并且形成的愈伤组织形态结构良好[17-18]。此外,陈海燕等人研究表明,光照对根形成的必需条件[19]。但是,本研究中不同光照强度对生根率影响差异不显著。
叶片是植物接收阳光、进行光合作用等生理活动的重要器官[20-21]。叶片的数量直接影响植物的光合作用,进而影响植物生产力。结果分析得出,不同遮阴强度处理对鳄嘴花叶片数影响较为明显。不同遮阴处理组鳄嘴花叶片数与遮阴强度呈反比关系,即遮阴强度弱,则叶片数高。这可能是由于阴暗条件阻碍了植物正常光合作用,影响植物叶片的生长。而光照有利于植物进行光合作用来维持正常生命活动,促进叶片的生长。
高等植物叶绿素包括叶绿素a和叶绿素b,是捕获光能并驱动电子转移的重要光合色素,而光又通过影响叶绿素合成相关酶的活性来影响叶绿素的合成[22-24]。但是,本研究发现低光照强度时叶绿素a、叶绿素b以及总叶绿素浓度较高。而同一天内,中午时间的叶绿素会明显下降,这与王祥宁等人的研究一致。可能原因是鳄嘴花虽为喜阴性植物,但可能自身叶绿素合成的光阈值较低,当达到光阈值后鳄嘴花叶绿素合成即会受到抑制而下降。此外,阳光中的紫外线对叶绿素中某些色素的氧化破坏可能也是强光下叶绿素含量较弱光照低的另一个原因[25-27]。这其中的生物学过程可能需要进一步深入研究。
随着遮阴强度减弱,鳄嘴花枝长、枝条数、茎围以及茎节数均逐渐增高。说明适当的增加光照可以促进以上指标的生长。通过对以上4项指标的增长率分析发现,其增长率并不与光照强度梯度变化呈规律性递增或递减。L2枝长增长率较高但是枝长较短,其可能原因是该处理在某时段增长率较快,而之后明显下降导致。通过分析其标准差发现,其标准差为0.304,均较其他处理组标准差高,进一步说明了以上解释。枝节与株高关系密切[28],通过枝长与枝节数比发现,随着遮阴强度减弱,枝长枝节比逐渐增大,且差异显著(P<0.05),说明遮阴缩短了鳄嘴花节间长度。
从总生物量来看,遮光抑制了鳄嘴花的生物量。未遮光组L4的生物量是强遮光组L1的43倍,说明遮光差异对鳄嘴花总产量产生显著影响。对于地下部分和叶片的生物量分配比例,强遮光组较高,而弱遮光组较低。这可能是由于鳄嘴花在逆境下通过增加地下部分来吸收更多的水和其他养分来增强自身抗逆性,根冠比的结果也体现了这一结论。而叶片生物量分配比例较高的可能原因是,叶片是鳄嘴花进行光合作用的主要场所,通过增加叶片生物量分配比例可以提高植株的光接收面积,以此来提高光合效率。而且,鳄嘴花地上部分生物量主要集中在叶片上,这也是鳄嘴花针对碳水化合物的主要合成场所进行的物质投资,目的是为了获得更多的光合产物来提高抗逆性。所以说植物这种自动调节其生物量的能力,是植物通过长期的自然选择而获得的赖以生存的重要手段[25]。
3.2 结论
通过对不同遮阴强度处理的鳄嘴花试验研究得到,不同光强度差异对鳄嘴花插穗愈伤组织产生、生根率均不显著。但是对鳄嘴花叶量的影响较为明显。表现为鳄嘴花叶量与遮阴强度呈反比关系,即遮阴强度弱,则叶量越大。鳄嘴花枝长、枝条数、茎围以及茎节数与遮阴强度的关系也存在于叶量与遮阴强度相似的变化规律。且随着遮阴强度减弱,枝长与枝节比逐渐增大,说明遮阴缩短了鳄嘴花节间长度。其次,低光照强度时叶绿素a、叶绿素b以及总叶绿素浓度较高。中午时段,所有处理组叶绿素会明显下降。此外,遮阴处理抑制了鳄嘴花的总生物量。但是,对于地下部分和叶片的生物量分配比例,强遮光组较高,而弱遮光组较低。
参考文献:
[1] 王贤儿,钟希文,张文霞,等.基于忧遁草化学成分研究分析其抗肿瘤作用[J].中国药房,2013,43:4104-4107.
[2] 易博,徐文彤,邓盾,等.鳄嘴花叶氨基酸和微量元素分析及其化学成分研究[J].解放军药学学报, 2012(5):396-399.
[3] 王瑶,钟希文,张文霞.鳄嘴花的化学成分及药理作用研究进展[J].中国药房, 2016(1):108-111.
[4] P’NG X W,AKOWUAH G A,CHIN J H. Acute oral toxicity stu-dy ofClinacanthusnutansin mice[J].IJPSR,2012,3(11):4202.
[5] P’NG X W,AKOWUAH G A,CHIN J H. Evaluation of the sub-acute oral toxic effect of methanol extract ofClinacanthusnutansleaves in rats[J]. Journal of Acute Disease,2013,2(1):29.
[6] CHIN J H ,AKOWUAH G A,SABU M C,et al. Sub-acute(28days) toxicity study of methanol leaves extract ofClinacanthusnutansin rats[J].Int J Pharm,2014,4(2):61.
[7] SALLEEM M,KAUR S,KWEON M H,et al. Lupeol,a fruit and vegetable based triterpene,induces apoptotic death of human pancreatic adenocarcinoma cell via inhibition of Ras signaling pathway[J].Life Sci Med,2005,26( 11): 1956-1964.
[8] GALLO M B C,SARACHINE M J.Biolocial activities of lupeol[J].International Jouranl of Biomedical and Pharmaceutical Sciences, 20093 (specisl issue 1): 46-66.
[9] 吴新安,赵毅民.天然碳苷黄酮及其研究进展[J].解放军药学学报, 2005,21(2): 135-138.
[10] 刘明生.黎药学概论[M].北京:人民卫生出版社,2008:165-197.
[11] 胡嘉琪,崔鸿宾,席以珍,等.国产爵床科鳞花草族1属、穿心莲族2属和爵床族8属植物的花粉形态[J].植物分类学报, 2005,43(2):151-162.
[12] 刘旭,郭文洁,黄丹民,等.鳄嘴花正丁醇提取物对小鼠Heps肝癌的抑制作用[J].江苏大学学报(医学版), 2014,24(3),211-215.
[13] 刘厚诚.新兴野菜鳄嘴花[J].植物杂志, 2001(2):12-14.
[14] 贾瑞丰,杨曾奖,徐大平,等.干旱胁迫对降香黄檀幼苗生长及内源激素含量的影响[J].生态环境学报, 2013(7):1136-1140.
[15] 何萍,金继运,林葆.氮肥用量对春玉米叶片衰老的影响及其机理研究[J]. 中国农业科学, 2008,31(3):66-71.
[16] 冯汉青,管东东,焦青松,等.光照下菜豆叶片抗氰呼吸与光合作用关系的分析[J].植物生态学报, 2015(1):104-109.
[17] 王慧英.影响植物愈伤组织形成的因素研究[J]. 聊城大学学报(自然科学版), 2010(2):51-53.
[18] 文涛,梁莉,曾杨,等.不同光照强度对虎杖愈伤组织的影响[J].中国中药杂志, 2007,32(13):1277-1279.
[19] 陈海燕,陈延惠,李东伟,等.不同激素和黑暗处理对泰山红石榴立体叶片再生的影响[J].果树学报, 2009,26(5):725-728.
[20] 李洁.植物干旱胁迫适应机制研究进展[J].广东农业科学, 2014,19:154-159.
[21] LI Q F, MA CH C,SHANG Q L. Effects of silicon on photosynthesis and antioxidative enzymes of maize under drought stress[J].Chinese Journal of Applied Ecology, 2007,18(3):531-536.
[22] FROMME P , MELKOZERNOV A , JORDAN P ,et al. Structure and function of photosystem I:Interaction with its soluble electron carriers and external antenna systems[J].FE BS Lett, 2003,555:40-44.
[23] BEALE S . Green genes gleaned[J].Trend Plant Sci, 2005,10(7):309 -312.
[24] TANAKA R, TANAKA A. Identification of a vinyl reductase gene for chlorophyll synthesis in Arabidopsis thaliana and implications for the evolution of prochlorococcus species[J].Plant Cell , 2005,17:233 -240 .
[25] 王祥宁,熊丽,陈敏,等.不同光照条件下东方百合生长状态及生物量的分配[J].西南农业学报, 2007(5):1091-1096.
[26] 杨景宏,陈拓,王勋陵.增强紫外线B辐射对小麦叶绿体膜组分和膜流动性的影响[J].植物生态学报, 2000(1):102-105.
[27] 林文雄,梁义元,金吉雄.水稻对UV-B辐射增强的抗性遗传及其生理生化特征研究[J].应用生态学报, 1999,10(1):31-34.
[28] 刘秉华,王山鱿,杨丽.小麦株高及其与农艺性状的研究[J].北京农业科学, 1997,15(5):9-10.
