桥本甲状腺炎合并甲状腺毒症对小鼠额叶谷氨酸含量的影响
2018-04-23蔡瑶俊陈章祥贾雪梅朱德发
朱 敏,蔡瑶俊,陈章祥,樊 华,贾雪梅,朱德发
甲状腺毒症是指血循环中甲状腺激素过多引发多系统改变的一组临床综合征,包括易怒、焦虑及记忆力减退等神经精神症状[1-2]。桥本甲状腺炎(Hashimoto thyroiditis, HT)是产生甲状腺毒症的常见原因,能引起甲状腺毒症并与其合并存在。 目前有临床研究[3]显示甲状腺功能正常的HT患者即存在神经精神症状。谷氨酸作为中枢系统中最主要的兴奋性神经递质,与多种疾病引起的神经精神症状有关,其代谢较复杂,可作用于额叶、海马、扣带回等边缘系统及其周围区域[4]。其中,额叶是影响情绪活动的重要脑区。因此,该研究利用猪甲状腺球蛋白(porcine thyroglobulin, pTg)建立桥本甲状腺炎合并甲状腺毒症小鼠模型,观察其额叶谷氨酸含量及分布是否受到影响。
1 材料与方法
1.1实验动物5周龄CBA/J雌性小鼠30只,购自南京大学模式动物研究所,动物标准饲养条件下喂养,体质量15~20 g,健康状况良好。
1.2主要仪器及试剂pTg、弗氏完全佐剂(complete Freund's adjuvant, CFA)、弗氏不完全佐剂(incomplete Freund's adjuvant, IFA)(美国Sigma公司);T3、T4放射免疫试剂盒(北京北方生物技术研究所);检测仪器为 DFM-96型16管放射免疫γ计数器;甲状腺球蛋白抗体(thyroglobulin antibody, TgAb)、甲状腺过氧化物酶抗体(thyroid peroxidase antibody, TPOAb)试剂盒(美国贝克曼公司);检测仪器为贝克曼Uni Cel Dxl 800全自动化学发光免疫分析仪;大鼠来源抗谷氨酸单克隆抗体(美国novus公司);免疫组织化学染色试剂盒(北京中山金桥生物公司);光学显微镜(Olympus DP);形态学图像分析系统(Image-ProPlus 6.0)。
1.3动物造模方法CBA/J雌性小鼠适应性喂养一周后初步分为两组,即正常对照组(n=10)和模型组。待造模结束后模型组按照测定的甲状腺激素水平分为桥本组(n=10)和甲状腺毒症组(n=10)。模型组造模步骤:将pTg溶于PBS溶液中,CFA与pTg溶液1 ∶1混合于研钵中,pTg终浓度为2 mg/ml,冰浴条件下研磨至“油包水”状,固定好小鼠,行腹腔注射,每只0.1 ml。其余两组注射等量CFA。第14天将CFA替换成IFA,操作方法同前,其余两组注射等量IFA。造模周期为49 d。实验经由安徽医科大学伦理委员会审核批准。
1.4血清制备及T3、T4、TgAb、TPOAb检测乙醚吸入麻醉后打开小鼠腹腔,暴露下腔静脉,用肝素钠湿润1 ml注射器,行下腔静脉采血,室温下静置6 h,3 000 r/min离心10 min,分离血清,置于4 ℃冰箱保存待测血清T3、T4、TgAb、TPOAb。放射免疫试剂盒检测T3、T4,电化学发光免疫分析法检测TgAb、TPOAb。
1.5标本制备取血后立即断头处死,冰上迅速分离脑组织,4%多聚甲醛中固定24 h后,石蜡包埋,矢状位连续切片,片厚5 μm。连同气管分离甲状腺,于4%多聚甲醛中固定24 h后,石蜡包埋,连续切片,片厚5 μm。
1.6HE染色法切片经脱蜡、复水后,苏木精染料染色20 min,盐酸乙醇分色、蓝化后伊红染色10 s,再经脱水、透明后烘干封片。光学显微镜下拍摄图片。
1.7免疫组织化学染色法切片脱蜡、复水、微波炉抗原修复后,滴3%过氧化氢溶液温箱孵育30 min消除内源性过氧化物酶,山羊血清封闭1 h,一抗4 ℃孵育过夜(1 ∶400,阴性对照以PBS代替),山羊抗小鼠IgG/HRP聚合物37 ℃孵育30 min,DAB显色剂显微镜下显色,苏木精复染3 min,漂洗干净后脱水封片。光学显微镜下拍摄图片,利用形态学图像分析系统对图片进行分析。

2 结果
2.13组小鼠激素及抗体水平与正常对照组相比,桥本组和甲状腺毒症组TgAb、TPOAb显著升高(P<0.01);桥本组T4较正常对照组差异无统计学意义,甲状腺毒症组T4显著高于正常对照组(P<0.01),3组间T3差异无统计学意义。见表1。
2.23组小鼠甲状腺HE染色与正常对照组相比,桥本组和甲状腺毒症组小鼠甲状腺内可见明显淋巴细胞浸润及部分甲状腺滤泡的破坏。见图1。
2.33组小鼠额叶各层谷氨酸含量比较小鼠额叶按神经元形态分层:Ⅰ层为分子层,细胞结构少,有较多水平纤维;Ⅱ层为外颗粒层,神经细胞颗粒状排列较整齐、致密;Ⅲ层为外椎体细胞层,此层较宽,椎体细胞大小不等、松散分布,其中有少量星形细胞;Ⅳ层为内颗粒层,由较多星形细胞构成;Ⅴ为内椎体细胞层,主要由大量大、中型椎体细胞及少量星形细胞构成。本实验小鼠额叶切片各组各层细胞胞核均呈淡蓝色,Ⅰ层细胞极少,胞质也极少有棕黄色颗粒分布;Ⅱ~Ⅴ层细胞胞质呈棕黄色,此为谷氨酸免疫反应所产生的阳性产物。肉眼可见甲状腺毒症组棕黄色面积大于且颜色深于桥本组和正常对照组,桥本组稍强于正常对照组。见图2。
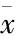
表1 3组小鼠T3、T4、TgAb及TPOAb水平(n=30,±s)
与正常对照组比较:*P<0.01
以平均光密度(average optical density, AOD)值作为分析指标,进一步量化分析各组小鼠额叶Ⅱ~Ⅴ层谷氨酸免疫反应产物,结果显示:甲状腺毒症组与正常对照组相比,各层AOD值均显著增大(P<0.01);与桥本组比较,各层AOD值差异有统计学意义(P<0.05)。桥本组与正常对照组相比,除Ⅳ外,余3层AOD值差异均有统计学意义(P<0.05)。Ⅰ层细胞结构和棕黄色颗粒极少,未纳入统计。见表2。
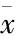
表2 3组小鼠额叶谷氨酸含量比较(n=30,±s )
与正常对照组比较:*P<0.05,**P<0.01;与桥本组比较:#P<0.05

图1 小鼠甲状腺组织HE染色 ×50(见图中▼标示)A:正常对照组;B:桥本组;C:甲状腺毒症组

图2 谷氨酸免疫产物在各组小鼠额叶的分布情况
3 讨论
本实验选用国际公认的桥本甲状腺炎造模小鼠CBA/J小鼠,利用猪甲状腺球蛋白结合弗氏完全佐剂和弗氏不完全佐剂造模[5-7]。结果显示,桥本组小鼠仅表现为TgAb和TPOAb显著升高及甲状腺病理切片呈淋巴细胞浸润等特征性形态学改变。甲状腺毒症组小鼠除上述表现外,T4增高,T3与对照组相比差异无统计学意义,但均值仍高于正常对照组,提示造模成功。
研究[8-9]显示,甲状腺功能正常时,免疫因素即可成为HT情绪改变的原因,而其产生的具体机制目前鲜有报道。本实验中,桥本组小鼠额叶Ⅱ、Ⅲ、Ⅴ层细胞内谷氨酸含量与正常对照组相比有增加。多种疾病引发的神经精神症状甚至健康人群存在的情绪改变与脑部谷氨酸代谢异常密切关联,González-Sepúlveda et al[10]的研究发现,慢性疼痛导致患者出现焦虑症状时,其额叶谷氨酸含量呈增加趋势;商进春 等[11]的动物学研究发现,尿毒症脑病致大鼠产生神经精神系统症状时,其脑组织谷氨酸浓度发生变化;Modi et al[12]在健康人群的研究中发现,焦虑情绪重者前扣带回内谷氨酸含量高于焦虑情绪轻者。结合以上研究成果,本研究结果提示HT所致的神经精神症状可能与小鼠额叶谷氨酸代谢异常有关。此外,可能因为锥体神经元在额叶活动中发挥着主要功能,Ⅳ层主要由星形神经细胞构成,使得桥本组小鼠额叶Ⅳ层相对于其它层受到影响稍小。
本实验观察各组小鼠额叶各层谷氨酸分布与含量,发现甲状腺毒症组小鼠额叶Ⅱ~Ⅴ层中细胞内谷氨酸含量较正常对照组和桥本组均增高,提示甲状腺毒症组小鼠额叶细胞内谷氨酸含量的显著升高可能是HT和甲状腺毒症共同作用的结果,HT合并的甲状腺毒症可能会影响小鼠额叶谷氨酸代谢。甲状腺毒症导致的神经精神症状的产生机制尚不十分清楚。有研究[13-14]显示,利用左甲状腺素建立的甲状腺毒症大鼠模型脑部多巴胺、去甲肾上腺素和5-羟色胺等神经递质发生变化。Zhang et al[15]在对甲状腺功能亢进症(甲亢)患者神经精神症状机制的研究中发现,甲亢患者扣带回谷氨酸含量减少。该结果与本实验结果均提示甲状腺毒症可能会导致脑部谷氨酸代谢异常,可能因为选取脑区不同、谷氨酸代谢的调节作用以及疾病病因和进程等不同因素,造成了实验结果的差异。
综上所述,HT会导致小鼠额叶细胞内谷氨酸含量增高,合并甲状腺毒症时增高更加明显,该结果可能为HT及HT合并甲状腺毒症引发神经精神症状的机制探讨提供一定参考作用。
[1] Li L, Zhi M, Hou Z, et al. Abnormal brain functional connectivity leads to impaired mood and cognition in hyperthyroidism:a resting-state functional MRI study[J]. Oncotarget, 2017, 8(4): 6283-94.
[2] 王建月, 王 茜, 孙春萍, 等. 甲状腺激素对成年大鼠额叶内synaptotagmin 1表达的影响[J]. 安徽医科大学学报, 2010, 45(6): 752-5.
[3] Yalcin M M, Altinova A E, Cavnar B, et al. Is thyroid autoimmunity itself associated with psychological well-being in euthyroid Hashimoto's thyroiditis?[J]. Endocr J, 2017, 64(4): 425-9.
[4] Krystal J H, Mathew S J, D'Souza D C, et al. Potential psychiatric applications of metabotropic glutamate receptor agonists and antagonists[J]. CNS Drugs, 2010, 24(8): 669-93.
[5] Damotte D, Colomb E, Cailleau C, et al. Analysis of susceptibility of NOD mice to spontaneous and experimentally induced thyroiditis[J]. Eur J Immunol, 1997, 27(11): 2854-62.
[6] Chen C Y, Kimura H, Landek-Salgado M A, et al. Regenerative potentials of the murine thyroid in experimental autoimmune thyroiditis:role of CD24[J]. Endocrinology, 2009, 150(1): 492-9.
[7] Wang X, Liu H, Zhang Y, et al. Effects of isolated positive maternal thyroglobulin antibodies on brain development of offspring in an experimental autoimmunet hyroiditis model[J]. Thyroid, 2015, 25(5): 551-8.
[8] Giynas Ayhan M, Uguz F, Askin R, et al. The prevalence of depression and anxiety disorders in patients with euthyroid Hashimoto's thyroiditis: a comparative study[J]. Gen Hosp Psychiatry, 2014, 36(1): 95-8.
[9] Müssig K, Künle A, Säuberlich A L, et al. Thyroid peroxidase antibody positivity is associated with symptomatic distress in patients with Hashimoto's thyroiditis[J]. Brain Behav Immun, 2012, 26(4): 559-63.
[10] González-Sepúlveda M, Pozo O J, Marcos J, et al. Chronic pain causes a persistent anxiety state leading to increased ethanol intake in CD1 mice[J]. J Psychopharmacol, 2016, 30(2): 188-203.
[11] 商进春, 刘丽秋. 尿毒症脑病大鼠脑组织谷氨酸和γ-氨基丁酸浓度变化[J]. 西部医学, 2007, 19(3): 353-5.
[12] Modi S, Rana P, Kaur P, et al. Glutamate level in anterior cingulate predicts anxiety in healthy humans:a magnetic resonance spectroscopy study[J]. Psychiatry Res, 2014, 224(1): 34-41.
[13] Hassan W A, Rahman T A, Aly M S, et al. Alterations in monoamines level in discrete brain regions and other peripheral tissues in young and adult male rats during experimental hyperthyroidism[J]. Int J Dev Neurosci, 2 013, 31(5): 311-8.
[14] Ahmed R G, Abdel-Latif M, Mahdi E A, et al. Immune stimulation improves endocrine and neural fetal outcomes in a model of maternofetal thyrot oxicosis[J]. Int Immunopharmacol, 2015, 29(2): 714-21.
[15] Zhang Q, Bai Z, Gong Y, et al. Monitoring glutamate levels in the posterior cingulate cortex of thyroid dysfunction patients with TE-averaged PRESS at 3T[J]. Magn Reson Imaging, 2015, 33(6): 774-8.
