感染电极拔除术后主动固定临时起搏与传统临时起搏的对比研究
2018-04-21郭飞董建增王龙段江波李学斌
郭飞 董建增 王龙 段江波 李学斌
起搏器应用于临床已有数十年的时间,多数起搏器植入患者提高了生活质量、改善了预后。但起搏器的广泛植入也带来了一系列的新问题,其中最严重的就是起搏系统相关感染。多数囊袋感染尤其是感染性心内膜炎的患者,必须将起搏系统整体移除,待感染完全控制后再次植入新的起搏器。在这个过程中,起搏依赖的患者必须植入临时起搏器桥接[1]。
目前,临床常使用球囊漂浮电极或电生理诊断标测导管进行临时起搏,但这种传统的临时起搏方式可保留的时间较短,且并发症发生率较高[2]。本研究选择起搏器感染且起搏依赖的患者,对比分析主动固定临时起搏与传统临时起搏的安全性及有效性。
1 对象与方法
1. 1 研究对象
2011年1月至2013年6月于北京大学人民医院心内科住院治疗的起搏器感染且起搏依赖的患者105例。其中2011年1月至2012年12月患者采用传统电生理导管的临时起搏方式,纳入传统临时起搏组,资料为回顾性分析;2013年1月至2013年6月使用主动固定临时起搏,纳入主动固定临时起搏组,资料为前瞻性分析。纳入标准:(1)囊袋感染(包括囊袋脓肿、破溃、慢性窦道形成)或感染性心内膜炎(包括血培养阳性或心腔内赘生物阳性);(2)行经静脉起搏器电极拔除术;(3)起搏器依赖,再植入永久起搏器前需行临时起搏桥接。排除标准:因起搏器拔除术后复发感染住院的患者。
起搏器依赖的标准:(1)起搏频率降至<40次/min后,无自主心律出现;(2)起搏频率降低后,患者出现明显心动过缓症状;(3)患者自身心律为室性逸搏节律;(4)患者自身节律为室上性,但室率<40次/min;(5)慢频率依赖型获得性长QT综合征[3-4]。
1. 2 观察指标
所有患者入院时均记录一般临床资料,行双侧血培养,行超声心动图检查证实有无心腔内赘生物。所有患者均行经静脉起搏器电极拔除术,术中植入临时起搏器。拔除手术成功标准:(1)完全成功,完全拔除起搏电极;(2) 临床成功,囊袋感染患者电极残端<2 cm。术后再次抽血培养,单纯囊袋感染患者血培养阴性>48 h后,在感染对侧胸壁植入新的永久起搏器。感染性心内膜炎患者起搏器拔除>14 d,且血培养阴性>72 h后,再次植入新的永久起搏器。永久起搏器植入术中拔除临时起搏电极。
记录临时起搏并发症,包括:(1)完全脱位,起搏阈值>10 V,或感知R波<2 mV,需行电极复位术;(2)微脱位,起搏阈值升高>2 V,或感知R波下降,调整脉冲发生器参数后尚可正常起搏,无需电极复位术;(3)下肢静脉血栓,经下肢静脉超声证实的下肢深静脉血栓形成;(4)临时起搏相关的再感染,临时起搏桥接过程中新出现的发热、血培养阳性,拔除临时起搏电极后24 h内体温正常、血培养转阴。
1. 3 临时起搏电极植入方法
1. 3. 1 传统临时起搏器植入方法 穿刺左侧股静脉,置4极电生理导管(Webster Catheter,Biosense Webster)至右心室心尖部,导管尾端连接临时起搏器脉冲发生器(Medtronic Model 5318),测试R波振幅及起搏阈值,未测阻抗。局部固定电生理导管,患者返回病房后绝对卧床(图1)。
1. 3. 2 主动电极植入方法 选择永久起搏器使用的心室主动固定电极(St Jude Tendril ST 1888TC)。以感染侧的颈内静脉作为首选入径,穿刺成功后置入可撕开鞘管,沿鞘管将电极导管推送至右心室间隔部,旋转电极头端的螺旋,将电极固定至右心室间隔,撕除鞘管,测试R波振幅、阻抗及起搏阈值。电极导管尾端在体外与再利用的永久起搏器脉冲发生器相连,起搏模式为VVI,双极起搏、双极感知。将起搏器脉冲发生器固定在患者颈部或肩部[5-6](图2)。

图1 后前位透视显示传统临时起搏植入 起搏器电极拔除术中,使用Needle eye’s snare抓捕心室电极,白色箭头为4极临时起搏导管
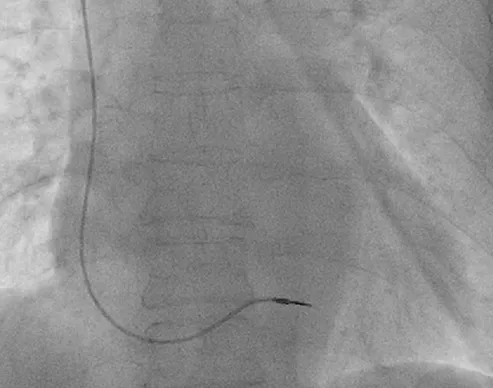
图2 后前位透视显示 主动固定临时起搏中经颈内静脉将心室主动固定电极植入右心室间隔部
1. 4 统计学分析
所有数据采用SPSS19.0统计软件进行分析。正态分布的计量资料用均数±标准差表示,组间比较采用t检验;不符合正态分布的计量资料采用中位数及四分间距表示,组间比较采用U检验。计数资料以例(百分比)表示,组间比较采用卡方检验。生存分析使用Logrank检验,以Kaplan-Meier曲线表示。以P<0.05为差异有统计学意义。
2 结果
2. 1 两组患者基本资料比较(表1)
2011年1月至2013年6月共105例患者符合纳入标准,其中传统临时起搏组70例,主动固定临时起搏组35例。两组患者的性别、年龄、植入起搏器原因、设备类型比较,差异均无统计学意义(均P>0.05)。
2. 2 两组患者起搏器拔除术结果比较(表2)
两组患者电极拔除成功率、X线曝光时间、手术并发症发生率、拔除术后血培养阳性率及院内死亡率比较,差异均无统计学意义(均P>0.05)。主动固定临时起搏组发生手术并发症4例(11.4%),包括心脏压塞1例,严重二尖瓣反流1例,肺栓塞2例;传统临时起搏组发生手术并发症5例(7.1%),包括心脏压塞3例,肺栓塞2例。
2. 3 两组患者临时起搏器参数及并发症比较(表3)
主动固定临时起搏组的起搏阈值[(0.7±0.2)V比(1.0±0.3)V,P=0.035]及临时起搏并发症发生率(0比15.8%,P=0.009)均低于传统临时起搏组,差异均有统计学意义;主动固定临时起搏组的临时起搏保留时间[2(2,7)d 比 2(2,3)d,P=0.032]高于传统临时起搏组,差异有统计学意义。两组患者感知灵敏度及住院时间比较,差异均无统计学意义(均P>0.05)。主动临时起搏组未发生临时起搏并发症;传统临时起搏组发生临时起搏并发症11例(15.8%),包括微脱位6例,完全脱位4例,下肢血栓1例。两组患者均未发生临时起搏相关的再感染。
2. 4 出院2年内的死亡率及再感染率情况比较
传统临时起搏组65例(94.2%)两年随访资料完整,主动固定临时起搏组35例患者均完成两年随访。随访期间两组各有1例起搏器复发感染;传统临时起搏组3例患者死亡,主动固定临时起搏组1例患者死亡。两组患者无感染生存率比较,差异无统计学意义(P=0.68,图3)。

表1 两组患者基本资料比较
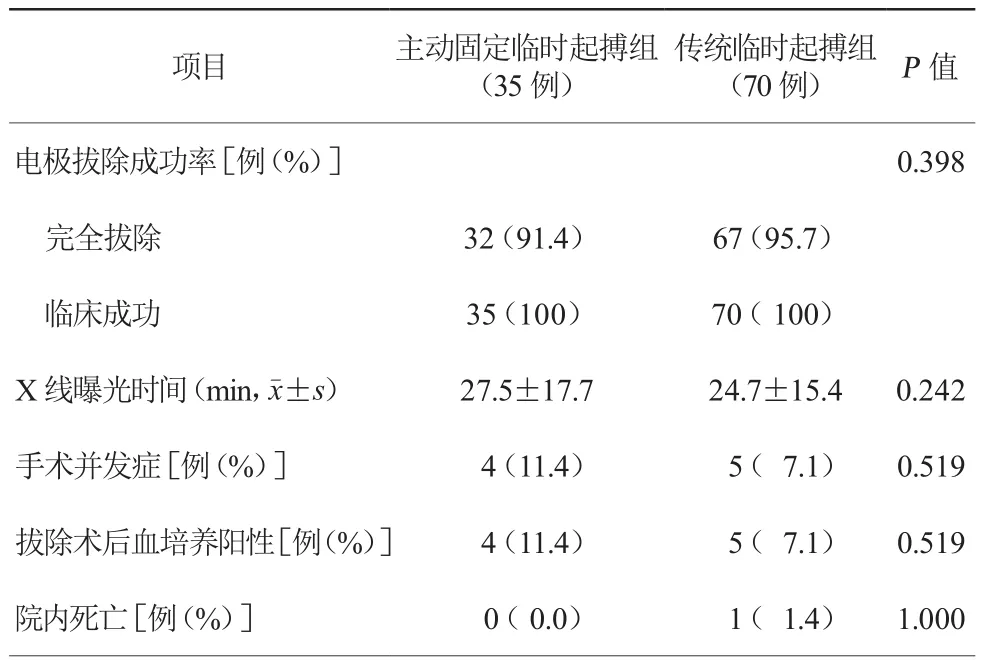
表2 两组患者起搏器拔除术结果比较

表3 两组患者临时起搏器参数及并发症比较
3 讨论
目前临床常用的临时起搏电极没有主动固定装置,脱位率较高。本研究中传统临时起搏组共出现了10例电极脱位,脱位率高达14.3%,与已有文献报道类似[2]。对于起搏器依赖的患者而言,起搏电极脱位会带来巨大风险,轻者可引起心动过缓、血流动力学不稳定,重者可能出现心搏骤停,甚至诱发室性心动过速、心室颤动而导致患者死亡。主动固定临时起搏使用心室螺旋电极,体外连接永久型心脏起搏器,保障了临时起搏系统的稳定性,可大幅降低电极脱位的风险。本研究中传统临时起搏组共出现11例(15.8%)并发症,其中6例为临时起搏电极微脱位,4例为完全脱位,其中1例患者突发阿斯综合征,心电监护示临时起搏感知不良,起搏信号落入T波易损期引发心室颤动,患者经电除颤后恢复窦性心律。1例患者出现临时起搏穿刺侧下肢浮肿,下肢静脉超声示下肢血栓形成,经内科保守治疗后好转。而主动固定临时起搏组35例患者未出现电极脱位,远远优于传统临时起搏组。
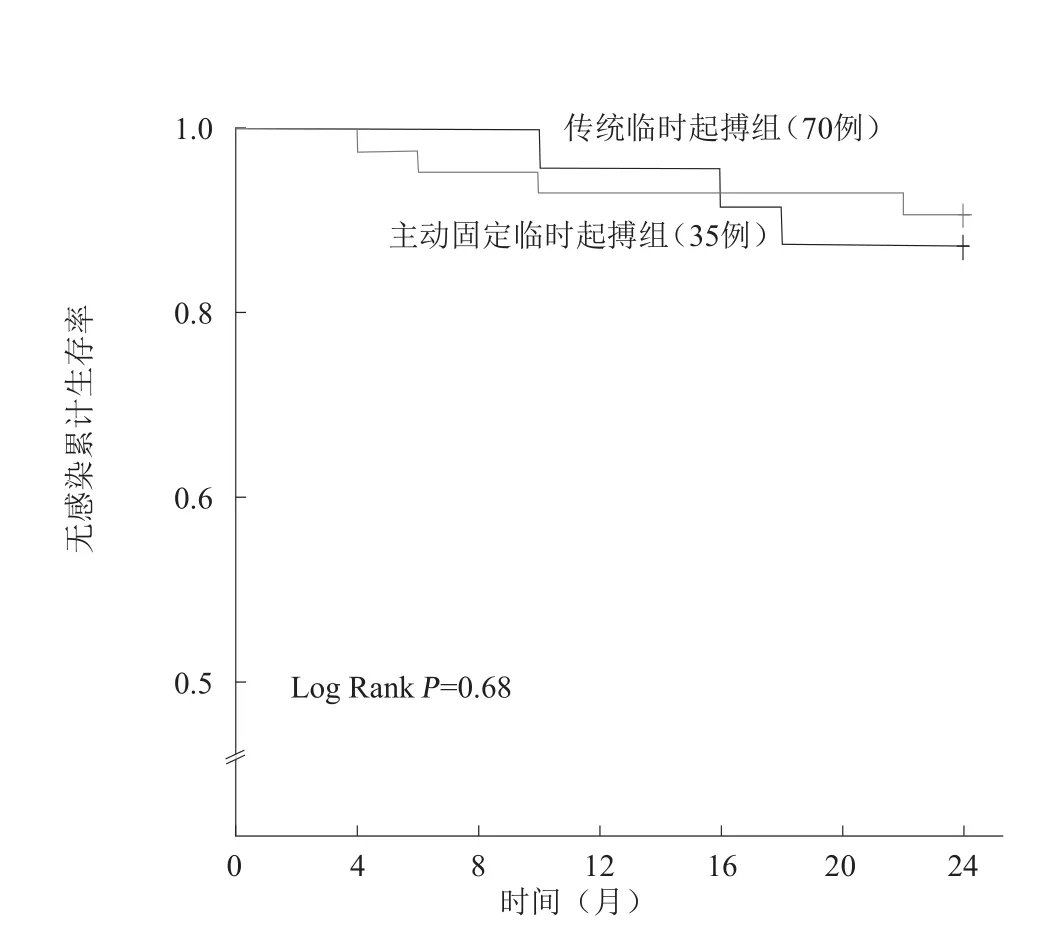
图3 两组患者无感染生存率Kaplan-Meier曲线
起搏器感染患者,特别是感染性心内膜炎患者,起搏器拔除术后需持续接受抗生素治疗,直到血培养转阴后才可再次植入永久起搏器,在这个过程中需要长时间的临时起搏桥接。有研究显示,起搏器依赖的感染性心内膜炎患者,在电极拔除术后需要平均2周左右的临时起搏桥接时间,时间最长者可长达1个月[6]。而目前传统临时起搏器原则上保留时间不能超过2周,且期间患者需要卧床。保留时间过长会导致临时起搏脱位、再感染、下肢血栓、压疮的发生率急剧增加[7-8]。而主动固定临时起搏可保留的时间更长,理论上可长达数月,且不再需要限制患者活动[9]。在北京大学人民医院,2013年前起搏依赖且伴有感染性心内膜炎的患者更倾向于外科开胸拔除电极,并植入心外膜临时起搏器。2013年后,随着经静脉电极拔除术经验的成熟及主动固定临时起搏的应用,更多感染性心内膜炎患者选择经静脉起搏电极拔除术。主动临时起搏组感染性心内膜炎患者较多,有8例患者临时起搏保留超过2周,但未见并发症发生。其中保留时间最长的1例患者达到77 d,该患者男性,72岁,心内膜赘生物29 mm×15 mm,伴肾功能衰竭、肺部感染、呼吸衰竭。患者永久起搏器拔除后持续血培养阳性,给予抗生素及透析治疗,77 d后血培养转阴,再次植入新的永久起搏器。在长达两月余的桥接时间里,主动临时起搏工作正常,且未发生电极相关的二次感染。
两种临时起搏方式在患者住院期间均未引起电极相关的再次感染。在术后2年的随访中,两种临时起搏方式并没有显示出对感染复发率及死亡率的影响。但这也可能和样本量较少、随访时间有限有关。
主动固定临时起搏虽然可显著降低并发症发生率,但也有操作复杂、费用略高等问题。故而认为其主要适用于起搏器完全依赖且需要较长时间临时起搏的患者。对于短时间临时起搏(如介入术中或外科术中的保护性临时起搏)及紧急临时起搏,传统方式仍为首选。
本研究尚存在局限性,为单中心、回顾性、非随机研究,两组患者基线资料不完全相同。但相对传统临时起搏,主动固定临时起搏可显著降低临时起搏相关的并发症发生率、延长临时起搏保留时间、增加患者的舒适性,在选择性患者中值得临床推广应用。
[1] Baddour LM, Epstein AE, Erickson CC, et al. Update on cardiovascular implantable electronic device infections and their management: a scientific statement from the American Heart Association. Circulation, 2010 , 121(3):458-477.
[2] Braun MU, Rauwolf T, Bock M, et al. Percutaneous lead implantation connected to an external device in stimulationdependent patients with systemic infection--a prospective and controlled study. Pacing Clin Electrophysiol, 2006,29(8):875-879.
[3] Occhetta E, Bortnik M, Dell’era G, et al. Evaluation of pacemaker dependence in patients on ablate and pace therapy for atrial fibrillation. Europace, 2007, 9(12):1119-1123.
[4] Sood N, Crespo E, Friedman M, et al. Predictors of pacemaker dependence and pacemaker dependence as a predictor of mortality in patients with implantable cardioverter defibrillator. Pacing Clin Electrophysiol, 2013,36(8):945-951.
[5] Lever N, Ferguson JD, Bashir Y, et al. Prolonged temporary cardiac pacing using subcutaneous tunnelled active-fixation permanent pacing leads. Heart, 2003 , 89(2):209-210.
[6] Pecha S, Aydin MA, Yildirim Y, et al. Transcutaneous lead implantation connected to an externalized pacemaker in patients with implantable cardiac defibrillator/pacemaker infection and pacemaker dependency. Europace, 2013, 15(8):1205-1209.
[7] Harvey JR, Wyman RM, McKay RG, et al. Use of balloon flotation pacing catheters for prophylactic temporary pacing during diagnostic and therapeutic catheterization procedures.Am J Cardiol, 1988 , 62(13):941-944.
[8] Austin JL, Preis LK, Crampton RS, et al. Analysis of pacemaker malfunction and complications of temporary pacing in the coronary care unit. Am J Cardiol , 1982, 49(2):301-306.
[9] Rastan AJ, Doll N, Walther T, et al. Pacemaker dependent patients with device infection--a modified approach. Eur J Cardiothorac Surg, 2005, 27(6):1116-1118.
