露水草粉碎粒度和添加水平对日本沼虾生长性能、肝胰腺消化酶活性及非特异性免疫指标的影响
2018-04-20张易祥丁志丽吴成龙明建华邵仙萍孔有琴叶金云
张易祥 丁志丽 吴成龙 明建华 杨 霞 邵仙萍 孔有琴 叶金云
(水生动物繁育与营养国家地方联合工程实验室,浙江省水生生物资源养护与开发技术研究重点实验室,中国水产科学研究院水生动物繁育与营养重点实验室,湖州师范学院生命科学学院,湖州 313000)
蜕皮激素具有类固醇激素典型的性质,对甲壳动物体内蛋白质、糖类和矿物质等的代谢具有激发、调节作用,可促进甲壳动物外骨骼生长形成,使甲壳动物快而顺利地完成蜕皮。甲壳动物的蜕皮激素如蜕皮酮(E)、20-羟基蜕皮酮(20-HE)和25-脱氧蜕皮酮(25-DE)由Y-器官合成并分泌[1]。从20世纪70年代起,研究人员开始采用注射蜕皮激素的方法对甲壳动物的蜕皮生长进行研究,Warner等[2]发现注射适量蜕皮激素(2.14 μg/g)可以刺激螯虾(Orconectesobscurus)较早地进行蜕皮,促进其生长。目前在生产和试验研究中为加快生长和提高变态速率,缩短养殖周期,常通过饲料直接摄入外源蜕皮激素,提高甲壳动物的蜕皮频率[3-6]。
露水草(CyanotisarachnoideaC.B.Clarke,C.arachnoidea)是提取蜕皮激素的优良原料植物之一,是迄今发现含蜕皮激素最多的植物,它的蜕皮激素含量为干燥全草的1.2%,其地下部分蜕皮激素含量可达干重的2.9%[7]。与化学药物添加剂相比,草药无残留或残留低,且不产生耐药性,同时兼有营养和药用双重作用[8-10]。
超微粉碎技术是通过机械设备对草药进行研磨和撞击,可将草药的粒度加工至微米级。草药经超微粉碎有助于提高细胞破壁率、比表面积、有效成分溶出度,减少用药量,节约药材,保护资源[11-13]。
日本沼虾(Macrobrachiumnipponense),又称青虾、河虾,广布我国内陆水域,其肉味鲜美,富含营养,虾肉中含蛋白质16.9%、脂肪1.3%,还有钙、磷、铁和维生素等,已成为我国淡水名优养殖品种之一[14]。长期以来,人们只知道蜕皮激素对甲壳动物的生长、发育和生殖有重要的作用[15],但对其是否影响甲壳动物的非特异性免疫并不清楚,目前仅见Wu等[16]报道蜕皮激素参与调节凡纳滨对虾(Litopenaeusvannamei)的免疫反应,20-HE可影响凡纳滨对虾胆固醇的代谢,导致神经反应变化;当外源20-HE升高时,凡纳滨对虾的免疫反应会降低。此外,将露水草制成粉体是否更有利于虾蟹类对其有效成分的吸收利用也未见报道。为了探究露水草粉碎粒度和日本沼虾对其蜕皮激素吸收利用的关系,以及蜕皮激素是否影响日本沼虾的免疫反应,本试验利用超微粉碎技术,将干燥露水草加工成不同粒度的粉体,并以不同水平加入到日本沼虾饲料中,研究日本沼虾生长性能、肝胰腺消化酶活性和非特异性免疫指标的变化,以期对研发促进日本沼虾生长、降低饲料系数且具有一定抗病性的新型高效无公害饲料添加剂提供技术支持。
1 材料与方法
1.1 试验设计及饲料配制
试验分2部分进行。试验1:将不同粉碎粒度(粉碎粒度分别为10、30、50和180 μm)的露水草添加到基础饲料中并使每千克饲料中蜕皮激素含量为10 mg,配制4种试验饲料(分别命名为1#、2#、3#、4#),并以不含露水草的基础饲料为对照(命名为0#1)。试验2:将粉碎粒度为180 μm(普通粉)的露水草以不同水平添加到基础饲料中并使每千克饲料中蜕皮激素含量分别为3.30、6.60、13.20和26.40 mg,配制4种试验饲料(分别命名为5#、6#、7#、8#),并以不含露水草的基础饲料为对照(命名为0#2)。
基础饲料组成及营养水平见表1。不同粉碎粒度的露水草由长兴清华粉体与新材料工程中心有限公司提供,粉碎粒度为10、30、50和180 μm露水草中蜕皮激素含量分别为0.74%、0.74%、0.74%和0.33%。其他饲料原料购于浙江璟宝饲料股份有限公司。按照试验设计,每100 g基础饲料中分别添加粉碎粒度为10、30、50、180 μm的露水草0.13、0.13、0.13、0.30 g,制成饲料1#、2#、3#、4#;每100 g基础饲料中分别添加粉碎粒度为180 μm的露水草0.10、0.20、0.40、0.80 g,制成饲料5#、6#、7#、8#;对照饲料0#1和0#2即基础饲料。试验饲料具体制备方法如下:将原料粉碎后过60目筛,按配方准确称取并逐级均匀混合,加入鱼油和豆油再次混匀,最后加适量水混匀,用小型饲料造粒机制成粒度为1.0 mm的颗粒饲料,风干后置-20 ℃冰箱备用。
1.2 试验动物与饲养管理
试验用日本沼虾幼虾购自浙江德清吴越水产养殖有限公司,幼虾体长(1.71±0.07) cm,体重(0.08±0.01) g,体格健壮,活动迅速。
试验用玻璃水族箱的规格为0.76 m×0.36 m×0.45 m,内悬网片供日本沼虾栖息与攀爬,试验用水为储水池曝气自来水,水温26~28 ℃,pH 7.6~8.1,溶氧浓度>6.5 mg/L,总氨氮浓度<0.01 mg/L。

表1 基础饲料组成及营养水平(风干基础)
1)每千克维生素预混料含有Contained the following per kg of vitamin premix :VA 4 200 000 IU,VC 60 g,VE 20 g,VD31 200 000 IU,VK 10 g,VB110 g,VB210 g,VB616 g,VB120.02 g,烟酸 nicotinic acid 50 g,叶酸 folic acid 4 g,肌醇 inositol 60 g,生物素 biotin 0.1 g,泛酸钙 calcium pantothenate 35 g。
2)每千克矿物质预混料含有Contained the following per kg of mineral premix:KCl 28 g,MgSO4·7H2O 100 g,NaH2PO4215 g,KH2PO4100 g,Ca(H2PO4)2·H2O 265 g,CaCO3105 g,C6H10CaO6·5H2O 165 g,FeC6H5O7·5H2O 12 g,ZnSO4·7H2O 4.76 g,MnSO4·H2O 1.07 g,AlCl3·6H2O 0.15 g,CuCl2·2H2O 0.24 g,CoCl2·6H2O 1.4 g,KI 0.23 g,α-纤维素 α-cellulose 2.15 g。
3)营养水平均为实测值。Nutrient levels were all measured values.
试验用虾驯养1周后,挑选大小均一的幼虾2 100尾,随机放入30个水族箱中,每个水族箱70尾。试验开始后,每3个水族箱的幼虾饲喂1种饲料,每天早、晚各投喂1次(早上投喂饲料的30%,晚上投喂饲料的70%),投喂量为虾体湿重的5%,投喂前用虹吸法吸取残饵和粪便。每天换水1次,换水量为水体积的1/3。养殖试验持续时间为60 d。
1.3 样品采集
试验进行至第60天时停饲1 d,各组试验虾计数、称重,用于生长指标的分析和统计成活率。用1 mL无菌注射器每个重复采集20尾试验虾的血淋巴,与抗凝剂(由30 mmol/L枸椽酸钠、0.34 mol/L氯化钠、10 mmol/L乙二胺四乙酸、0.115 mol/L葡萄糖组成,pH 7.55)1∶2混合制成抗凝血。一部分抗凝血直接用于计数血细胞总数(THC)和测定血淋巴吞噬活性(HPA);另一部分离心10 min(700×g、4 ℃),所得的血浆于-80 ℃超低温冰箱中保存,用于超氧化物歧化酶(SOD)和碱性磷酸酶(AKP)活性的测定。
将采血后的虾置于冰盘内于玻璃平皿上解剖,取肝胰腺剪开,预冷超纯水(4 ℃、pH 7.0)清洗其内容物,滤纸吸干后称重,用于分析肝胰腺指数。称重后的肝胰腺于-80 ℃超低温保存,用于测定胃蛋白酶、类胰蛋白酶和淀粉酶活性。
1.4 指标测定
1.4.1 生长性能指标的测定
特定生长率(SGR,%/d)=100×
(ln末均重-ln初均重)/饲养天数;增重率(WGR,%)=100×(末均重-初均重)/初均重;肝胰腺指数(HSI,%)=100×肝胰腺均湿重/虾体均湿重;成活率(SR,%)=100 × 试验结束时存活虾尾数/试验开始时投放虾尾数;饲料系数(FCR)=摄食饵料重/
(末均重-初均重)。
1.4.2 非特异性免疫指标的测定
利用血球计数板在光学显微镜(200×)下直接计数,计算出每毫升血淋巴中THC。
HPA的测定参考吞噬中性红法[17-18],计算公式如下:
HPA=100×吸光度值/1010个血细胞。
SOD和AKP活性的测定参照南京建成生物工程研究所试剂盒说明书进行。SOD以反应体系中SOD抑制率达50%时所对应的酶量为1个活性单位(U)。AKP以100 mL血浆在37 ℃与基质作用15 min产生1 mg酚为1个活性单位(U)。
1.4.3 消化酶活性的测定
将肝胰腺按其质量分别加入10倍体积的预冷超纯水,用玻璃匀浆器在冰浴中匀浆,3 000 r/min离心10 min,用考马斯亮兰法测定上清液中蛋白质含量。所有消化酶活性的测定均按试剂盒(南京建成生物研究所生产)说明书进行。
1.5 免疫保护试验
攻毒用嗜水气单胞菌TPS-30株由浙江省淡水水产研究所提供。预试验确定日本沼虾的的半致死浓度(LD50,7 d)为1×108CFU/mL。试验进行至第61天时,从采样后剩余虾中每个重复随机选取20尾,在其第2~3腹节间肌肉注射1×108CFU/mL嗜水气单胞菌TPS-30株,注射量为0.02 mL/尾。攻毒后12 h恢复投喂试验饲料,观察并记录7 d累积死亡结果,计算累积死亡率。
1.6 数据分析
所测数据以3个重复数据的平均值±标准误(mean±SE)表示,使用SPSS 15.0软件进行数据统计分析,采用单因素方差分析(one-way ANOVA)检验显著性,并采用Duncan氏法进行组间多重比较,显著性水平设为P<0.05。
2 结 果
2.1 相同蜕皮激素含量下不同粉碎粒度露水草对日本沼虾生长性能、肝胰腺消化酶活性及非特异性免疫指标的影响
相同蜕皮激素含量下不同粉碎粒度露水草对日本沼虾生长性能、肝胰腺消化酶活性及非特异性免疫指标的影响见表2和表3。在饲料中蜕皮激素含量均为10 mg/kg的条件下,与不添加露水草的对照组相比,添加不同粉碎粒度露水草组(10 μm组、30 μm组、50 μm组和180 μm组)的WGR和SGR显著升高(P<0.05),FCR显著降低(P<0.05),HSI和SR变化不显著(P>0.05),肝胰腺中胃蛋白酶、类胰蛋白酶和淀粉酶活性差异不显著(P>0.05),非特异性免疫指标THC、HPA与血浆SOD和AKP活性差异不显著(P>0.05)。添加不同粉碎粒度露水草组(10 μm组、30 μm组、50 μm组、180 μm组)之间上述生长性能指标、肝胰腺消化酶活性及非特异性免疫指标的差异均不显著(P>0.05)。

表2 相同蜕皮激素含量下不同粉碎粒度露水草对日本沼虾生长性能及肝胰腺消化酶活性的影响
同行数据肩标无字母或相同字母表示差异不显著(P>0.05),不同字母表示差异显著(P<0.05)。下表同。
In the same row, values with no letter or the same letter superscripts mean no significant difference (P>0.05), while with different letter superscripts mean significant difference (P<0.05). The same as below.
2.2 相同粉碎粒度下不同蜕皮激素含量露水草对日本沼虾生长性能、肝胰腺消化酶活性及非特异性免疫指标的影响
相同粉碎粒度下不同蜕皮激素含量露水草对日本沼虾生长性能、肝胰腺消化酶活性及非特异性免疫指标的影响见表4和表5。在露水草粉碎粒度均为180 μm的条件下,与不添加露水草的对照组相比,6.60 mg/kg蜕皮激素组和13.20 mg/kg蜕皮激素组的WGR和SGR显著升高(P<0.05),FCR显著降低(P<0.05);26.40 mg/kg蜕皮激素组的WGR、SGR、SR和HPA显著低于不添加露水草的对照组(P<0.05),其WGR和SGR也显著低于其他添加露水草组(P<0.05);3.30 mg/kg蜕皮激素组、6.60 mg/kg蜕皮激素组、13.20 mg/kg蜕皮激素组之间的WGR和SGR差异不显著(P>0.05)。各组日本沼虾的HSI,肝胰腺胃蛋白酶、类胰蛋白酶和淀粉酶活性,THC以及血浆SOD、AKP活性的差异均不显著(P>0.05)。
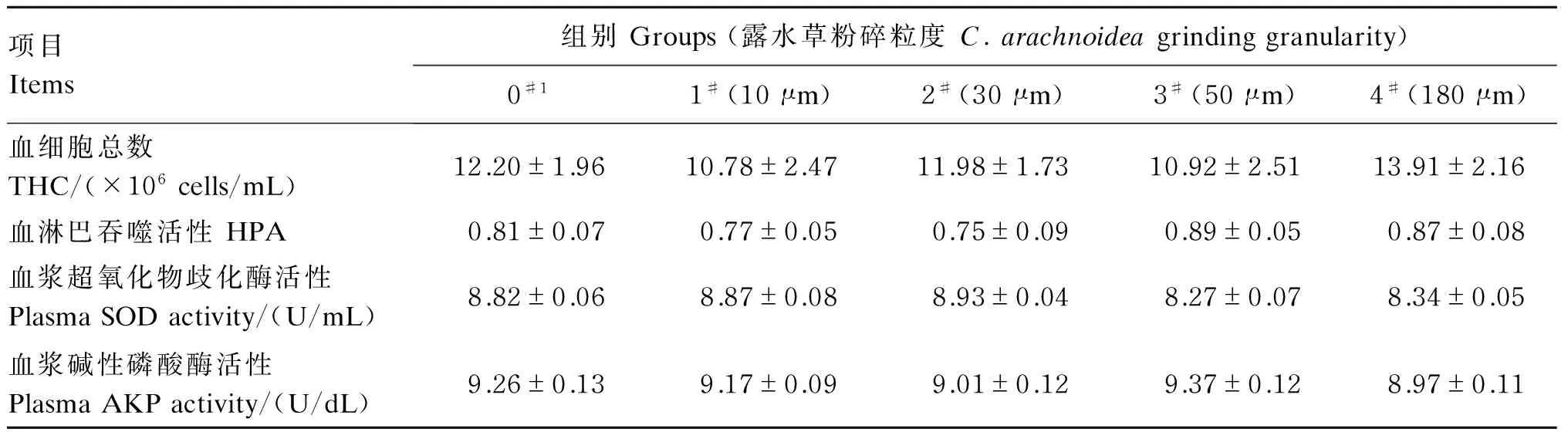
表3 相同蜕皮激素含量下不同粉碎粒度露水草对日本沼虾非特异性免疫指标的影响

表4 相同粉碎粒度下不同蜕皮激素含量露水草对日本沼虾生长性能及肝胰腺消化酶活性的影响
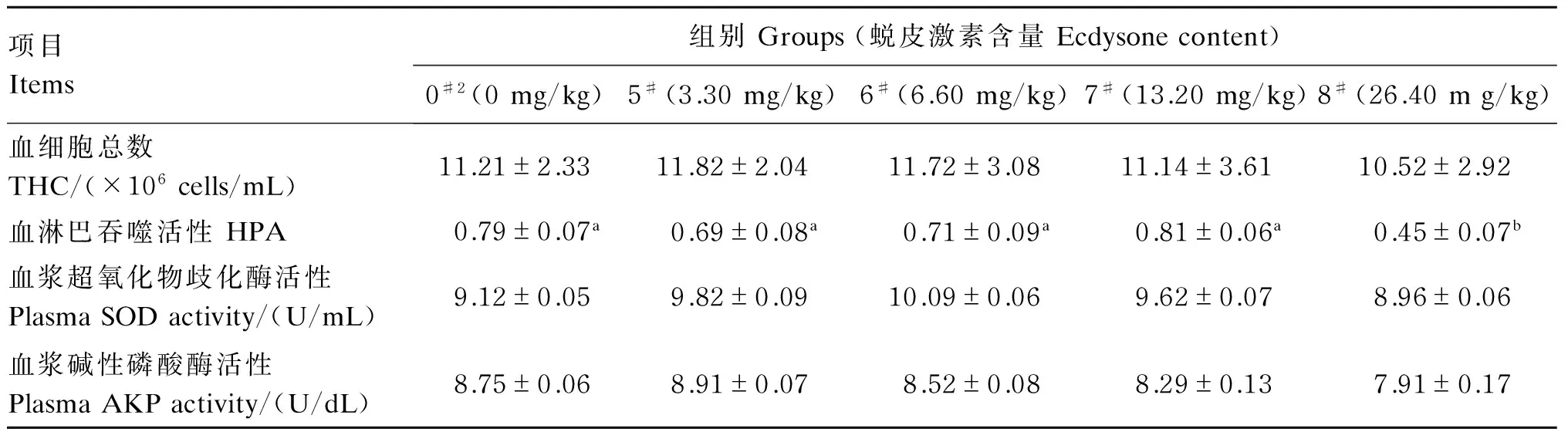
表5 相同粉碎粒度下不同蜕皮激素含量露水草对日本沼虾非特异性免疫指标的影响
2.3 不同粉碎粒度或不同蜕皮激素含量露水草对日本沼虾的免疫保护作用
由表6可知,试验1中,攻毒后的累积死亡率各组之间均无显著差异(P>0.05)。由表7可知,试验2中,26.4 mg/kg蜕皮激素组攻毒后的累积死亡率和其他组相比显著升高(P<0.05),3.30 mg/kg蜕皮激素组、6.60 mg/kg蜕皮激素组、13.20 mg/kg蜕皮激素组以及对照组之间攻毒后的累积死亡率差异不显著(P>0.05)。

表6 试验1中各组日本沼虾经嗜水气单胞菌处理后的累积死亡率

表7 试验2中各组日本沼虾经嗜水气单胞菌处理后的累积死亡率
3 讨 论
本试验所用粉碎粒度10、30、50 μm的露水草是通过超微粉碎技术得到的粉体。经超微粉碎后的草药不但有效成分溶出量、浸出率明显提高[11-13],而且粒度越小动物吸收效果越好[19-20]。已有研究结果表明,超微粉碎后的露水草蜕皮激素检测值比普通粉(粉碎粒度180 μm)平均高1倍多,但粉碎粒度为10、30、50 μm的3种粉体之间无显著差异[21]。李艳玲等[20]对黄连解毒散经超微粉碎后和普通粉相比,发现鸡对其有效成分小璧碱超微粉的吸收没有增加,但对桅子苷超微粉吸收利用度增加了约44%,差异显著。在本试验1中,添加露水草粉组之间、粉体组与普通粉组之间日本沼虾的生长性能、肝胰腺消化酶活性的差异并不显著,说明日本沼虾对蜕皮激素的吸收和露水草粉碎粒度的大小无相关性,并不是粒度越小吸收效果越好。由此可见,对每一种草药应通过试验综合确定其被动物吸收的最佳粒度,不能笼统认为所有草药的超微粉在动物体内的吸收都会增加。由于露水草的根茎纤细,超微粉的制作和普通粉相比成本高、收率低,所以日本沼虾饲料中露水草粉碎粒度以普通粉为佳。
饲料中添加一定量的蜕皮激素或脱壳促生长素可促进中国对虾[3-4]、罗氏沼虾[5]、克氏原螯虾[6]的蜕皮及生长。初始平均体重分别为1.95和3.30 g的中国对虾饲料中添加蜕皮激素5.33~10.67 mg/kg[3]、初始平均体重为0. 3 g的罗氏沼虾饲料中添加植物蜕皮激素2 mg/kg[5]、初始平均体重为8.31 g的克氏原螯虾饲料中添加蜕皮激素0.50 mg/kg[6]均有明显的促蜕皮和促生长作用。中国对虾无节幼体饲料中添加类固醇激素17α-甲基睾丸酮300 mg/kg时,其幼体提前2 d全部进入仔虾期,幼体的体长增长比对照组的增加了45.5%[4]。在本研究中,试验1饲料中添加的10 mg/kg蜕皮激素和试验2饲料中添加的6.60、13.20 mg/kg蜕皮激素对日本沼虾均有显著促生长作用,但肝胰腺中消化酶活性并没有显著改变,说明适量蜕皮激素对日本沼虾的促生长作用是通过缩短脱壳时间、提高脱壳率来实现的;在饲料中蜕皮激素含量为26.4 mg/kg时,日本沼虾的生长性能指标和免疫保护力明显降低,其原因可能是过量蜕皮激素损害了日本沼虾的正常脱壳生理。Hubschman等[22]研究了蜕皮激素对成年小长臂虾的影响,注射剂量在0.25~5.00 μg/g时,对小长臂虾有明显的毒性作用。罗日祥等[3]的研究表明,中国对虾饲料中蜕皮激素含量为60 mg/kg时会抑制其蜕皮、生长,乃至中毒。
许多草药含调节水产动物免疫性能的有效成分,如有机酸类、生物碱、聚糖类、挥发油、蜡、甙、鞣质物质及一些未知免疫活性因子等,因而常常具有免疫增强作用[16,23-24]。Deng等[25]研究表明,冬虫夏草中的多糖对凡纳滨对虾生长、免疫(酚氧化酶、碱性磷酸酶、酸性磷酸酶、溶菌酶活性)和抗氧化指标(SOD活性、还原型谷胱甘肽含量、活性氧水平、总抗氧化能力)有显著的影响。露水草含甾酮、甾醇类物质[26],这些物质对哺乳动物的免疫具明显的调节作用,蜕皮甾酮可抑制抗免疫球蛋白E(IgE)诱导的组胺在大鼠肥大细胞中的释放,并显著降低刀豆蛋白A(ConA)引起的肥大细胞组胺释放[27]。在本研究中,露水草对甲壳动物日本沼虾的非特异性免疫指标(THC、HPA以及血浆SOD和AKP活性)和对细菌的抵抗力并无显著增强作用,这可能和露水草所含甾酮、甾醇类物质量少有关[26]。
甲壳动物的血细胞又称血淋巴细胞,和免疫反应有重要的关系,参与病原微生物的吞噬、凝集、包囊,血细胞吞入病原微生物后可通过氧化性杀菌机制和非氧化性杀菌机制杀死病原微生物[28]。在果蝇中,20-HE可促进血细胞的分化和增强造血功能,影响血细胞的数量,调节蜕皮激素激活通路[29];但在凡纳滨对虾中,20-HE可使肝胰腺THC显著降低[16]。在本研究中,露水草中的蜕皮激素对日本沼虾的THC和HPA不但无显著增强作用,而且过高含量(26.4 mg/kg)的蜕皮激素还使其HPA显著降低。
AKP是甲壳动物溶酶体酶的重要组成部分[30]。SOD是一种重要的抗氧化酶,能催化超氧阴离子自由基(O2-·)发生歧化反应形成过氧化氢(H2O2),对于增强吞噬细胞的防御能力和整个机体的免疫功能有重大作用[30]。Wu等[16]研究表明,用20-HE处理凡纳滨对虾,肝胰腺中SOD活性显著升高;高浓度20-HE抑制凡纳滨对虾O2-·的产生,低浓度20-HE促进O2-·的产生,作者认为可能是低浓度20-HE提高了烟酰胺腺嘌呤二核苷酸磷酸(NADPH)氧化酶活性,产生活性氧,高浓度的作用相反。本试验与上述凡纳滨对虾的研究结果并不相同,饲料中不同含量(3.30~26.40 mg/kg)的蜕皮激素对日本沼虾的血浆AKP和SOD活性无显著影响。
4 结 论
① 饲料中添加适量露水草(使饲料中蜕皮激素含量为6.60~13.20 mg/kg)对日本沼虾具有显著的促生长作用,日本沼虾对蜕皮激素的吸收和露水草粉碎粒度无相关性。由于露水草超微粉的制作与普通粉相比成本高、收率低,因此认为日本沼虾饲料中露水草以普通粉形式添加为佳。
② 露水草主要药用成分蜕皮激素对日本沼虾无免疫增强作用,且露水草蜕皮激素过量(饲料中蜕皮激素含量为26.4 mg/kg)还将导致日本沼虾成活率和抗菌能力降低。
参考文献:
[1] LACHAISE F,MEISTER M F,HÉTRU C,et al.Studies on the biosynthesis of ecdysone by the Y-organs ofCarcinusmaenas[J].Molecular and Cellular Endocrinology,1986,45(2/3):253-261.
[2] WARNER A C,STEVENSON J R.The influence of ecdysones and eyestalk removal on the molt cycle of the crayfishOrconectesobscurus[J].General and Comparative Endocrinology,1972,18(3):454-462.
[3] 罗日祥,王玉英.β-蜕皮激素和水龙骨素B的混合物对促进对虾蜕皮生长的作用[J].海洋学报,1990,12(3):355-358.
[4] 康现江,王所安,秦树臻.外源类固醇激素对中国对虾幼体蜕皮和生长影响的初步研究[J].河北大学学报(自然科学版),1995,15(3):44-47.
[5] 王宁珠,弘耑.植物蜕皮激素对罗氏沼虾的影响[J].饲料研究,1991(10):8-9.
[6] 陈树桥,陈勇,周国勤,等.蜕皮激素对克氏原螯虾蜕皮和生长的影响[J].南京师大学报(自然科学版),2012,35(1):80-83.
[7] 聂瑞麟,徐祥誉,何敏,等.露水草植物中蜕皮激素的分离和鉴定[J].化学学报,1978,36(2):137-141.
[8] MURALISANKAR T,BHAVAN P S,RADHAKRISHNAN S,et al.Growth performance,muscle biochemical constituents,amino acid and fatty acid compositions of the giant freshwater prawn,Macrobrachiumrosenbergii,fed with herb-incorporated diet[J].Aquaculture Nutrition,2017,23(4):766-776.
[9] RAO Y V,CHAKRABARTI R.Stimulation of immunity in Indian major carpCatlacatlawith herbal feed ingredients[J].Fish & Shellfish Immunology,2005,18(4):327-334.
[10] BINDHU F,VELMURUGAN S,DONIO M B S,et al.Influence ofAgathigrandifloraactive principles inhibit viral multiplication and stimulate immune system in Indian white shrimpFenneropenaeusindicusagainst white spot syndrome virus infection[J].Fish & Shellfish Immunology,2014,41(2):482-492.
[11] 邓雯,杨泽锐,程翔燕,等.不同粒径黄芪超微粉理化性质的研究[J].中国现代中药,2017,19(8):1187-1192.
[12] 叶英响,冯超,翁夏蒙,等.六味地黄丸粉体粒径与其破壁率和溶出度的相关性研究[J].中草药,2016,47(12):2108-2112.
[13] 王森,欧水平,赵萍,等.超微粉碎对虎杖膏透皮吸收和流变性的影响[J].中草药,2017,48(12):2425-2430.
[14] FU H T,JIANG S F,XIONG Y W.Current status and prospects of farming the giant river prawn (Macrobrachiumrosenbergii) and the oriental river prawn (Macrobrachiumnipponense) in China[J].Aquaculture Research,2012,43(7):993-998.
[15] HUBERMAN A.Shrimp endocrinology.A review[J] Aquaculture,2000,191(1/2/3):191-208.
[16] WU Y S,CHANG C H,NAN F H.Steroid hormone “cortisone” and “20-hydroxyecdysone” involved in the non-specific immune responses of white shrimp (Litopenaeusvannamei)[J].Fish & Shellfish Immunology,2016,56:272-277.
[17] LONG F,WANG Y,LIU L,et al.Rapid nongenomic inhibitory effects of glucocorticoids on phagocytosis and superoxide anion produetion by macrophages[J].Steroids,2005,70(1):55-61.
[18] 王斌,赵文,范薇,等.复方中药制剂对草鱼免疫细胞功能及抗病力影响的初步研究[J].大连水产学院学报,2007,22(3):203-206.
[19] 陈旭.三七超微粉碎对生物体内吸收影响的初步试验[J].西北药学杂志,2002,17(5):203-204.
[20] 李艳玲,刘永录,于瑞,等.超微粉碎对黄连解毒散中成分吸收的影响试验[J].中国兽医杂志,2014,50(12):47-50.
[21] 朱国栋,张易祥,叶金云,等.露水草加工粒径和其β-蜕皮激素释放的关系[J].安徽农业科学,2011,39(29):17760-17761.
[22] HUBSCHMAN J H,ARMSTRONG P W.Influence of ecdysterone on molting inPalaemonetes[J].General and Comparative Endocrinology,1972,18(3):435-438.
[23] RADHAKRISHNAN S,SARAVANA BHAVAN P,SEENIVASAN C,et al.Effects of native medicinal herbs (Alternantherasessilis,EcliptaalbaandCissusquadrangularis) on growth performance,digestive enzymes and biochemical constituents of the monsoon river prawnMacrobrachiummalcolmsonii[J].Aquaculture Nutrition,2015,21(4):496-506.
[24] AFTABUDDIN S,SIDDIQUE M A M,ROMKEY S S,et al.Antibacterial function of herbal extracts on growth,survival and immunoprotection in the black tiger shrimpPenaeusmonodon[J].Fish & Shellfish Immunology,2017,65:52-58.
[25] DENG B,WANG Z P,TAO W J,et al.Effects of polysaccharides from mycelia ofCordycepssinensison growth performance,immunity and antioxidant indicators of the white shrimpLitopenaeusvannamei[J].Aquaculture Nutrition,2015,21(2):173-179.
[26] 谭成玉,王金辉,李铣,等.露水草的化学成分[J].药学学报,2003,38(10):760-762.
[27] TAKEI M,ENDO K,NISHIMOTO N,et al.Effect of ecdysterone on histamine release from rat peritoneal mast cells[J].Journal of Pharmaceutical Sciences,1991,80(4):309-310.
[28] JOHANSSON M W,KEYSER P,SRITUNYALUCKSANA K,et al.Crustacean haemocytes and haematopoiesis[J].Aquaculture,2000,191(1/2/3):45-52.
[29] SORRENTINO R P,CARTON Y,GOVIND S.Cellular immune response to parasite infection in theDrosophilalymph gland is developmentally regulated[J].Developmental Biology,2002,243(1):65-80.
[30] 肖克宇.水产动物免疫与应用[M].北京:科学出版社,2007:120-121.
