胃肠道褪黑素分泌及其生理功能
2018-04-20谭碧娥任文凯印遇龙
谭碧娥 任文凯 印遇龙
(中国科学院亚热带农业生态研究所,中国科学院亚热带农业生态过程重点实验室,畜禽养殖污染控制与资源化技术国家工程实验室,动物营养代谢过程与生理调控实验室,长沙 410125)
褪黑素(N-乙酰基-5-甲氧基色胺)主要在大脑的松果体产生,被称为机体睡眠觉醒周期的调节器,涉及生物节律、代谢和繁殖等生理调节过程[1]。最近研究证实,褪黑素在消化系统中发挥更重要的调节作用。胃肠道是除松果体外最重要的褪黑素来源,由胃肠道的肠内分泌细胞中产生。褪黑素具有很强的清除自由基和抗氧化能力,也是胃肠道炎症和运动性的重要调节因子,因而可能对许多肠道相关疾病尤其是肠道炎症控制发挥积极的作用[2-4]。本文旨在概述褪黑素在胃肠道的合成分泌及其发挥的生理功能,为其在调控肠道健康和疾病控制中的应用提供参考。
1 胃肠道褪黑素的合成和分泌
肠道是除松果体外褪黑素生产的主要场所,褪黑素及其受体广泛存在于胃肠道[5],在肠道中的量比松果体高400倍,比血浆中的浓度高10~100倍[6]。褪黑素在胃肠道各段分布具有区域差异性,在直肠和结肠中浓度最高,空肠和回肠中最低。添加外源性褪黑素后,在结肠和直肠中观察到最明显的褪黑素积累。此外,肠道中的褪黑素浓度随年龄变化。在大鼠中,胃肠道褪黑素水平在出生时达到峰值,然后在出生后第21天时降至稳定水平。但是,在生命后期褪黑素水平增加。与2~5月龄小鼠相比,22~24月龄老年小鼠回肠和结肠后段黏膜中的褪黑素浓度高出126%[7]。研究显示,胃肠道褪黑素的释放也遵循昼夜节律,但与松果体褪黑素的典型分泌模式不同[1,8]。最近在虹鳟鱼中的研究显示,胃肠道中褪黑素节奏性地合成,参与褪黑素合成的主要酶mRNA也呈节律表达[9]。在大鼠胰腺、肾脏、脾脏和十二指肠中都发现有褪黑素浓度的昼夜节律变化,但结肠中褪黑素水平在夜间并没有出现特征性的增加[10]。
肠嗜铬细胞是胃肠道褪黑素的主要来源[11],褪黑素的分布与肠嗜铬细胞的密度相关。L-色氨酸是肠道褪黑素合成的关键前体。色氨酸经色氨酸羟化酶(tryptophan hydroxylase,TPH)、芳香族L-氨基酸脱羧酶(aromaticL-amino acid decarboxylase,AADC)、5-羟色胺-N-乙酰转移酶(serotonin N-acetyltransferase,SNAT)和N-乙酰血清素-O-甲基转移酶(N-acetylserotonin O-methyltransferase,ASMT)4种酶依次催化生成5-羟基色氨酸、5-羟色胺(5-hydroxytryptamine,5-HT)、乙酰5-羟色胺和褪黑素(图1)[12]。

TPH:色氨酸羟化酶 tryptophan hydroxylase;AADC:芳香族L-氨基酸脱羧酶 aromaticL-amino acid decarboxylase;ASMT:N-乙酰血清素-O-甲基转移酶 N-acetylserotonin O-methyltransferase;SNAT:5-羟色胺-N-乙酰转移酶 serotonin N-acetyltransferase。
图1褪黑素合成途径
Fig.1 The pathway of melatonin synthesis[12]
在肠道中检测到的一些褪黑素来源于松果体,但其水平与松果体产生无关,因为大鼠松果体切除术对肠道褪黑素浓度没有影响。胃肠道组织中褪黑素的合成和分泌受采食和食物组成的调节。采食后,胃肠道和血液循环中褪黑素水平急剧增加[13]。在人和动物试验中发现,口服药理学剂量的L-色氨酸,显著增加了血液循环中褪黑素浓度,与夜间褪黑素峰值相当[7,13]。胃肠道褪黑素的合成受中枢调节。因此,在体外灌注液中添加L-色氨酸或其代谢物并不能促进胃肠道褪黑素的合成[13]。肠道菌群也可调节肠嗜铬细胞释放5-HT,代谢产生褪黑素[14]。
2 胃肠道褪黑素受体
褪黑素膜受体根据其药理学特性,可分为褪黑素受体(melatonin receptor,MT)1、MT2和MT3。3种受体均可胃肠道中表达,亚细胞分布在核表达最高,其次是微粒体和线粒体,胞质中最低[15]。MT1和MT2受体均为G蛋白偶联受体家族的成员,共享7个跨膜结构,在氨基酸水平上显示高同源性,具有55%的整体同源性和跨膜结构域内70%的同源性[5]。luzindole作为MT1和MT2受体的拮抗剂,用于许多研究;4-P-PDOT是MT2的选择性拮抗剂,尚未报道MT1受体的高选择性拮抗剂。MT3属于还醌类还原酶家族,具有很强的抗氧化性能,可被哌唑嗪(prazosin)阻断[16]。褪黑素受体的表达呈现组织和细胞差异性。在大鼠中,十二指肠中MT1 mRNA表达最高,而在空肠和回肠中表达较低;而在结肠中发现最高丰度的MT2蛋白,主要在平滑肌层中[17-18]。在鸭肠中,肠道不同区域的2-125碘(125I)褪黑素结合位点的密度表现为:回肠、空肠>十二指肠、结肠>盲肠>食管[15]。在人胃肠道中,MT1和MT2在肠上皮、黏膜下层、肌间神经丛和胃肠道血管均有表达,在大肠上皮中表达最高;在其他类型细胞中MT2表达水平显著高于MT1,在肠嗜铬细胞中表达有高水平的MT2[19]。研究报道在中枢神经系统MT表达呈昼夜变化,但在肠道中没有明显的节性变化[20]。在12 h∶12 h的光线∶黑暗循环中,大鼠远端结肠上皮层中的MT1表达没有显示明显的昼夜节律[20],在鸭肠道中结合的2-(125I)碘代褪黑素也没有显示每日节律[15]。营养状态似乎控制褪黑素释放。短期禁食增加大鼠小肠和大肠上皮层MT1的表达,在长期禁食期间,MT1表达仅在远端结肠中持续增加,在小肠中MT1表达恢复正常水平[20],MT2的表达也不随食物摄取而变化[18]。
褪黑素通过活化特定的受体发挥生理作用。膜受体通过G蛋白偶联的第二信使介导其功能。MT1与介导腺苷酸环化酶抑制和磷脂酶C激活的G蛋白偶联,MT2与磷酸肌醇生成、腺苷酸环化酶的抑制以及可溶性鸟苷酸环化酶途径的抑制等转导途径相结合[1]。而核褪黑素信号传导通过转录因子——视黄酸Z受体/视黄酸相关孤核受体(retinoid Z receptor/retinoid acid receptor-related orphan receptor,RZR/ROR)介导(图2)[1,21]。RZR/ROR α亚型广泛分布,其表达决定褪黑素对转录调控的作用,RZR/ROR已被证实涉及褪黑素的免疫调节作用[21]。
3 褪黑素在肠道中的生理功能
3.1 调节胃肠道运动和分泌
褪黑素具有高亲脂性,可能通过黏膜和黏膜下层扩散到更深层,最终作用于肌层黏膜或肌间神经丛,从而调节胃肠道运动。体外和体内试验表明,褪黑素能抑制胃肠道的肌肉活动,抑制作用的程度与胃、十二指肠、小肠和大肠收缩强度成正比[1]。松果体切除术抑制迁移肌电复合体的常规期,外源性褪黑素处理可以恢复大鼠回肠中的正常迁移肌电复合体活动期[22]。这些变化可能取决于褪黑素对胃肠神经元的作用。在胃中,褪黑素通过激活交感神经元部分抑制胃动力[3]。褪黑素因剂量不同对肠道产生兴奋和抑制作用。高浓度的褪黑素抑制胃、回肠、空肠和结肠肌肉的自发性和5-HT诱导的蠕动。相反,低剂量的褪黑素对肠道肌肉组织产生刺激作用,肠道蠕动加快[22-23]。褪黑素抑制5-HT、氯化钾和卡巴胆碱(胆碱受体激动剂)等多种药物刺激的胃肠道的运动活性[13]。因此,褪黑素对肌肉收缩的抑制作用涉及多种机制。在胃肠道平滑肌细胞中最可能的褪黑素作用位点是膜结合的褪黑素受体。研究发现,大鼠胃、结肠和十二指肠肌肉黏膜和肌肉层均有MT2免疫反应[18],表明MT2受体参与褪黑素对胃肠道运动的调节。褪黑素作用的其他可能位点是5-HT受体。Kasimay等[3]研究表明褪黑素对胃排空的延迟作用是由5-HT3和缩胆囊素(cholecystokinin, CCK2)受体介导。在褪黑素注射前15 min用5-HT3受体(ramosetrone,50 μg/kg)或CCK2(L-365,260;1 mg/kg)阻断剂处理,可消除褪黑素诱导的胃排空延迟效应,而交感神经节(甲苯磺酸苯甲酸酯,15 mg/kg)的阻断显著减少了胃排空的延迟。褪黑素的作用可能与褪黑素阻断烟碱乙酰胆碱受体有关,或调节细胞膜中钙离子(Ca2+)通道和Ca2+活化的钾离子(K+)通道的活性[24-25]。

cAMP:环磷酸腺苷 cyclic adenosine monophosphate;IP3:三磷酸肌醇 inositol trisphosphate;MT1/MT2:褪黑素受体1/褪黑素受体2 melatonin receptor 1/melatonin receptor 2;PLC:磷酸酶C phospholipase C;PKA:蛋白激酶A protein kinase A;PKC:蛋白激酶C protein kinase C;RZR/ROR:视黄酸Z受体/视黄酸相关孤核受体 retinoid Z receptor/retinoid acid receptor-related orphan receptor。
图2褪黑素受体介导的细胞内褪黑素信号传导途径
Fig.2 The intracellular melatonin signaling transduction pathway mediated by melatonin receptor[1,21]

3.2 抗氧化作用
褪黑素的抗氧化作用已经在很多体内和体外的研究中得到证实,其对胃肠道损伤的保护作用很大程度上归因于抗氧化功能[27-28]。褪黑素同时具备脂溶性和水溶性,使其能自由通过任何生理屏障,因此与其他抗氧化剂相比更具有优势,可以直接到达线粒体。褪黑素可直接清除自由基。褪黑素利用吲哚环上的5-甲氧基直接清除羟基自由基(·OH)、脂质过氧化物、过氧化氢以及超氧负离子(O2·-)等氧自由基和活性产物。褪黑素淬灭1分子·OH后失去电子变成毒性很低的吲哚阳离子,随后又清除1分子O2·-,级联反应转变成N1-乙酰基-N2-甲酰基-5-甲氧基犬尿氨酸(N1-acetyl-N2-formyl-5-methoxyknuramine,AFMK)、N1-乙酰基-5-甲氧基-犬尿氨酸(N-acetyl-5-methoxyknuramine,AMK)以及其他代谢物,均能有效清除自由基,且与褪黑素有协同作用(图3)。通过这种方式,1个褪黑素分子具有清除多达10个活性氧(reactive oxygen species,ROS)的能力[2,9,29]。褪黑素与ROS相互作用的级联反应放大了其作为强效抗氧化剂的能力,在与ROS和一氧化氮合成酶(NOS)相互作用后的产物(或代谢物)保留清除自由基的能力,褪黑素中和·OH的能力是谷胱甘肽(glutathione,GSH)的5倍[29]。
除了抗氧化清除级联反应外,褪黑素作为抗氧化剂的另一个重要特征是其通过适度的氧化应激或不利的环境条件引起的[9]。氧化应激可以改变褪黑素与其氧化代谢物的比例,其产生的信号可能通过基因表达,导致N-乙酰转移酶(N-acetyltransferase,NAT)和/或羟基吲哚-O-甲基转移酶(hydroxyindole-O-methyltransferase,HIOMT)的阳性诱导,从而促进褪黑素的产生。褪黑素也可能被严重的氧化应激耗尽,自由基导致的褪黑素降解可能比其产生快得多。因此,在氧化应激相关疾病中,褪黑素水平低于健康人群[2,29]。
褪黑素可以快速进入线粒体膜间隙和基质,也可以在线粒体中合成,作为线粒体靶向抗氧化剂。褪黑素的抗氧化性质与线粒体生理学有关,重要的特征是抑制线粒体iNOS活性,其代谢物AMK比褪黑素具有更强的抑制线粒体iNOS活性和清除一氧化氮(NO)的特性[30]。褪黑素提高电子传递链(线粒体复合体Ⅰ、Ⅱ、Ⅲ和Ⅳ)的效率,并改善三磷酸腺苷(adenosine triphosphate,ATP)产生。Mei等[31]研究发现,褪黑素处理显着降低双氯芬酸诱导的小鼠肠黏膜通透性、病理评分、丙二醛和髓过氧化物酶(myeloperoxidase,MPO)水平以及肠黏膜溃疡,在线粒体水平修复了ATP酶和琥珀酸脱氢酶的活性。
此外,褪黑素可通过增强抗氧化酶活性和基因表达间接发挥抗氧化作用。研究已证实褪黑素可增强谷胱甘肽过氧化物酶(glutathion peroxidase,GPx)、超氧化物歧化酶(super oxide dismutase,SOD)和过氧化氢酶(catalase,CAT)等抗氧化酶的活性[9,28-29,32]。褪黑素刺激β-谷氨酰半胱氨酸合成酶,从而提高GSH水平,并提高谷胱甘肽还原酶(glutathione reductase,GSR)的活性,将氧化型谷胱甘肽(GSSG)转化为还原形式GSH[32]。褪黑素还能通过钙调蛋白抑制体内NOS的活性,从而抑制体内NO的过度生成及其他活性氮分子的产生[33]。
3.3 抗凋亡作用
在体内和体外已经证实了褪黑素调节凋亡的能力,褪黑素的抗凋亡作用归因于其抗氧化和自由基清除活性[34-35]。褪黑素能阻止线粒体氧化应激的发展和线粒体凋亡途径的激活。在氧化应激和疾病感染中产生的·OH通过线粒体死亡途径促进细胞凋亡,而褪黑素能有效地清除·OH,保护细胞和组织免受氧化损伤[36]。促凋亡和抗凋亡因子均可被褪黑素调节,在线粒体中上调抗细胞凋亡蛋白和下调促细胞凋亡蛋白表达,减少对脂质、蛋白质和DNA的氧化损伤[32]。褪黑素抑制B淋巴细胞瘤-2相关蛋白X(B-cell lymphoma-2 associated protein X,Bax)和Bak表达的上调以及B淋巴细胞瘤(B-cell lymphoma,Bcl)-2和Bcl-xL表达的下调,防止吲哚美辛诱导的线粒体Bax易位和线粒体膜电位的崩解,通过阻止细胞色素C的释放减少吲哚美辛诱导的半胱天冬酶(caspase)-9和caspase-3的活化[4]。在C2C12细胞中,褪黑素提高Bcl-2表达,降低Bax表达及Bax/Bcl-2相对比例,保护细胞免于凋亡和自噬[37]。褪黑素还可通过磷酸化蛋白激酶B(phosphorylated Protein kinase B,p-Akt)、Bcl-2、CAT和锰超氧化物歧化酶(Mn-SOD)表达的增加抑制NO诱导的细胞凋亡[36]。褪黑素也可直接抑制线粒体膜通透性转换孔(mitochondrial permeability transition pore,mtPTP)发挥抗凋亡作用[38],褪黑素调节解偶联蛋白以维持最佳的线粒体内膜电位,防止mtPTP的开放,限制了线粒体被ROS损伤时的细胞色素C逃逸[32]。
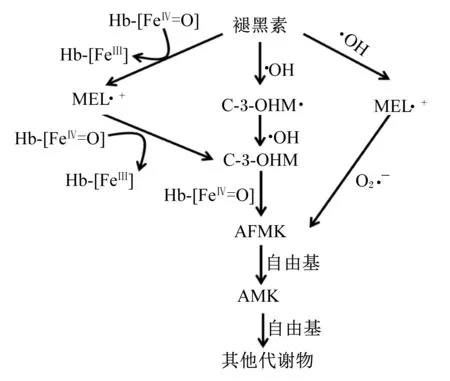
AFMK:N1-乙酰基-N2-甲酰基-5-甲氧基犬尿氨酸 N1-acetyl-N2-formyl-5-methoxyknuramine;AMK:N1-乙酰基-5-甲氧基-犬尿氨酸 N-acetyl-5-methoxyknuramine;C-3-OHM:环3-羟基褪黑素 cyclic 3-hydroxymelatonin;MEL:褪黑素 melatonin;Hb-[FeⅢ]:高铁血红蛋白 hemiglobin;Hb-[FeⅡ]:血红蛋白 hemoglobin;Hb-[FeⅡ=O]:氧合血红蛋白 oxyhemoglobin。
图3褪黑素清除自由基的级联反应
Fig.3 The free radical scavenging cascade reaction of melatonin[29]
3.4 免疫调节作用
褪黑素的免疫调节性质是众所周知的。T细胞表达有褪黑素结合的膜受体和核结合位点,因此,褪黑素影响T细胞的发育、活化、分化和记忆[39]。在免疫抑制条件下,褪黑素通过促进效应T细胞的功能发挥刺激功能。Haldar等[40]研究发现,褪黑素处理增加了胸腺皮质中的胸腺细胞密度,抵抗地塞米松诱导的免疫抑制。相反,褪黑素通过降低效应T细胞反应和增强调节性T细胞(Treg细胞)反应来抑制免疫应激[39]。Capelli等[41]在植物血凝素刺激的人淋巴细胞中,观察到褪黑素的抗增殖作用。褪黑素可增加辅助性T细胞2(T helper cell 2,Th2细胞)介导的免疫应答[42],褪黑素处理抗原致敏小鼠5 d,通过增加白细胞介素(interleukin,IL)-10和减少肿瘤坏死因子(tumor necrosis factor alpha,TNF)-α的产生诱导了Th2细胞反应[43]。褪黑素参与T细胞和B细胞的凋亡调控。通过抑制白细胞分化抗原(cluster of differentiation,CD)95配体mRNA和蛋白质上调响应T细胞抗原受体(T cell receptor,TCR)/CD3刺激,保护CD4+T细胞免于细胞凋亡[40]。Yu等[44]发现,口服褪黑素抑制了小鼠骨髓前体B细胞的凋亡,促进新形成的B细胞的存活。褪黑素对免疫系统的另一个作用是通过调控免疫调节因子基因表达和细胞因子产生。褪黑素能增强小鼠脾脏巨噬细胞到T细胞的抗原呈递,并促进主要组织相容性复合体(major histocompatibility complex,MHC)Ⅱ类分子和IL-1的表达[45]。调节人CD4+T细胞释放的几种细胞因子[包括IL-2、IL-2R和干扰素(interferon,IFN)-γ)]的基因表达[46]。Liu等[47]研究发现,褪黑素上调了腹膜浆细胞中转化生长因子(transforming growth factor,TGF)-β、巨噬细胞集落刺激因子(macrophage colony-stimulating factor,M-CSF)、TNF-α和干细胞因子(stem cell factor,SCF)以及脾细胞中IL-1β、M-CSF、TNF-α、IFN-γ和SCF的基因表达水平。此外,褪黑素也影响非特异性反应。Currier等[48]发现,褪黑素给药增加了小鼠骨髓中自然杀伤(natural killer,NK)细胞和单核细胞数量,诱导NK细胞活性增强。
褪黑素在动物模型免疫调节中起着关键作用,但是其免疫调节的研究结果并不完全一致。在感染克氏锥虫的大鼠中,褪黑素促进了Th1淋巴细胞的免疫应答,抑制脾细胞增殖,降低血清IL-4、IL-10和TGF-β1水平[49]。然而,Brazão等[50]研究发现,褪黑素处理对慢性感染克氏锥虫大鼠CD4+和CD8+T淋巴细胞亚群的百分比无显著影响,促进了胸腺细胞增殖,血清IL-2和IL-10水平升高。尽管已证实褪黑素能干扰免疫系统的一些调节途径,但并没有产生免疫的独特途径,可能在不同剂量或不同抗原刺激情况下,涉及调节免疫的途径不同[51]。
褪黑素的免疫调节作用由位于免疫活性细胞上的褪黑素受体介导。Carrillo-Vico等[52]发现MT2受体的拮抗剂可降低人淋巴细胞IL-2的产生,证明MT2结合位点参与IL-2的产生。最近的研究表明,褪黑素在肠道调节中的作用也可能由其诱导α7烟碱型乙酰胆碱受体(α nicotinic acetylcholine receptor,a7nAChR)介导。褪黑素是a7nAChR的重要正调节因子,a7nAChr通过氧化的线粒体脱氧核糖核酸(mtDNA)抑制NOD样受体3(NOD-like receptors,NLRP3)激活[53]。
4 褪黑素在抗肠道炎症中的应用研究
褪黑素已证实在多种肠道炎症动物模型和临床研究中发挥重要调控作用,减少肠炎病变,改善肠炎症状,减少促炎细胞因子分泌等[30,54-60]。药理剂量的褪黑素在慢性炎症模型中发挥明确的剂量依赖性抗炎活性,与标准抗炎剂吡罗昔康的效果相当[57]。褪黑素用于治疗结肠炎的剂量和给药时间的临床报道差异比较大,剂量为0.15~100.00 mg/kg BW,持续给药4 d至7周[54-56,59]。
褪黑素的抗炎作用与许多转录因子,如核因子活化B细胞κ轻链增强子(nuclear factor kappa-light-chain-enhancer of activated B cells,NF-κB)、缺氧诱导因子(hypoxia-inducible factor,HIF)、核转录因子E2相关因子2(nuclear factor-erythroid 2-related factor-2,Nrf2)等的调节有关。NF-κB是iNOS基因表达的关键转录因子,褪黑素对肠道炎症的治疗作用至少部分依赖于NF-κB活化的抑制,导致促炎细胞因子基因表达的抑制。已经证明,褪黑素能抑制iNOS和COX-2的表达[61-62]。在用乙酸和二硝基苯磺酸(dinitro-benzene-sulfonic acid,DNBS)灌肠诱导的结肠炎大鼠中,结肠iNOS和COX-2的表达以及NO和PGE2的含量显著升高,而5.0和10.0 mg/kg剂量的褪黑素处理结肠iNOS和COX-2表达显著下调[54]。同样,三硝基苯磺酸(trinitro-benzene-sulfonic acid,TNBS)灌肠诱导的大鼠结肠炎模型中,褪黑素通过下调由NF-κB抑制介导的促炎因子和阻断核因子κB抑制因子α(IκBα)降解来降低结肠炎性损伤[56]。iNOS的抑制和NF-κB的下调等都将导致炎性因子指标的改变。试验和临床资料显示,褪黑素可以限制NO、前列腺素、白三烯以及炎性过程的其他介质如细胞因子、趋化因子和黏附分子[30,61-62]。阻断这些细胞因子的作用可缓解肠道炎症的发展,抑制炎症和肠道损伤。褪黑素降低了脂多糖诱导的促炎性细胞因子、趋化因子和正急性蛋白,包括TNF-α、IL-1β、IL-6、GM-CSF、C反应蛋白等,而提高了抗炎细胞因子白介素1受体拮抗剂(interleukin-1 receptor antagonist,IL-1Ra)和负急性蛋白纤维蛋白原的表达[63]。TNBS和乙醇诱导的结肠炎大鼠中,褪黑素可节巨噬细胞活性,从而降低IL-1、TNF-α和NO活性[64]。
褪黑素抵抗肠道炎症可能通过抗氧化、抗凋亡和免疫调节多效作用参与(图4)。褪黑素可通过维持内源性抗氧化剂GSH的储备,抑制MPO活性,防止溶酶体酶破坏和释放,从而降低结肠损伤的程度[59]。褪黑素可以缓解TNBS诱导的结肠损伤和脂质过氧化,其减少结肠损伤的能力与基质金属蛋白酶(matrix metallo preteinases,MMP)-9和MMP-2活性和表达的降低有关[55]。褪黑素也可以通过抑制内质网应激来减少炎症,显著抑制炎性细胞因子和内质网应激相关分子的表达[53]。在DNBS诱导的大鼠结肠炎中,结肠损伤与促凋亡蛋白Bax表达增加和抗凋亡蛋白Bcl-2表达降低相关,而褪黑素通过抑制NF-κB而抑制细胞凋亡,降低Bax的表达,防止Bcl-2蛋白的丢失[65]。褪黑素也可抑制凋亡相关因子配体(FasL)基因的活化,从而抑制以释放IL-1β、巨噬细胞炎症蛋白(macrophage inflammation protein,MIP)-1a、MIP-1b和MIP-2为特征的促炎反应[65]。此外,褪黑素可通过减少细菌易位而对结肠炎症发挥保护作用,减少细菌移位和凋亡[60,66]。
5 肠道微生物与褪黑素生理功能调控
肠道微生物菌群在褪黑素调控正常生理功能和在疾病中的作用逐渐成为研究热点。褪黑素可能改变肠道微生物菌群,包括促进厚壁菌门(Firmicutes)与拟杆菌门(Bacteroidetes)比例的降低,增加嗜黏蛋白阿克曼氏菌(Akkermansia)的相对丰度,从而有利于防止肥胖、胰岛素抵抗、肝脏脂肪变性和轻微炎症[68]。褪黑素通过肠道微生物群体影响体重增加、肠道形态结构和产肠毒素大肠杆菌(ETEC)在肠道的定植[69]。肠道微生物可产生乙酸、丙酸、丁酸等短链脂肪酸以及儿茶酚胺类、γ-氨基丁酸、5-HT、褪黑素等神经信号调节肠道内分泌,作用于免疫系统和神经系统,与宿主互作调节各种生理功能和疾病的发生发展。肠道微生物菌群通过调节肠道内分泌细胞脑肠肽等激素的分泌,作用于脑,实现脑和肠之间的信息交流[70]。
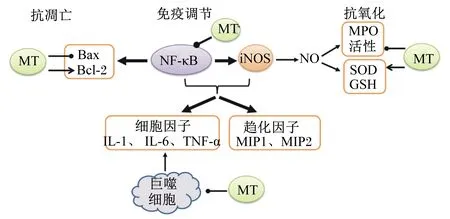
MT:褪黑素 melatonin;Bax:B淋巴细胞瘤-2相关X蛋白 B-cell lymphoma-2 associated X protein;Bcl-2:B淋巴细胞瘤-2 B-cell lymphoma-2;GSH:谷胱甘肽 glutathione;IL:白细胞介素 interleukin;iNOS:诱导型一氧化氮合成酶 inducible nitric oxide synthase;MIP:巨噬细胞炎症蛋白 macrophage inflammatory protein;MPO:髓过氧化物酶 myeloperoxidase;NF-κB:核因子活化B细胞κ轻链增强子 nuclear factor kappa-light-chain-enhancer of activated B cells;NO:一氧化氮 nitric oxide;SOD:超氧化物歧化酶 superoxide dismutase;TNF-α:肿瘤坏死因子-α tumor necrosis factor alpha。
图3褪黑素调节肠道炎症可能的作用机制
Fig.3 Possible regulatory mechanisms of melatonin on intestinal inflammation[58,67]
6 小结和展望
胃肠道褪黑素由肠内分泌细胞产生,具备调节胃肠道运动和分泌、抗氧化、抗凋亡和免疫调节等作用。通过这些多效作用参与,可减少肠炎病变,改善肠炎症状,减少促炎细胞因子分泌等,在多种肠道炎症动物模型和临床研究中发挥积极的作用。褪黑素调控肠道健康研究还可以从能量平衡和摄食调节、改善整个肠道的微循环、促进上皮再生等方面系统开展。此外,肠道微生物与褪黑素代谢可能互作调控肠道生理功能,由于肠道微生物菌群的复杂性,微生物如何介导肠道感应褪黑素信号及其反馈调节肠道生理功能的机制,需要进一步研究。
参考文献:
[1] CHEN C Q,FICHNA J,BASHASHATI M,et al.Distribution,function and physiological role of melatonin in the lower gut[J].World Journal of Gastroenterology,2011,17(34):3888-3898.
[2] BONNEFONT-ROUSSELOT D,COLLIN F.Melatonin:action as antioxidant and potential applications in human disease and aging[J].Toxicology,2010,278(1):55-67.
[3] KASIMAY O,CAKIR B,DEVERSEN E,et al.Exogenous melatonin delays gastric emptying rate in rats:role of CCK2 and 5-HT3 receptors[J].Journal of Physiology and Pharmacology,2005,56(4):543-553.
[4] KIM J B,JUNG J Y,AHN J C,et al.Antioxidant and anti-apoptotic effect of melatonin on the vestibular hair cells of rat utricles[J].Clinical and Experimental Otorhinolaryngology,2009,2(1):6-12.
[5] DOBOCOVICH M L,MANKOWSHA M.Functimal MT1and MT2melatonin receptors in mammals[J].Endocrine,2005,27(2):101-110.
[6] BUBENIK G A.Localization,physiological significance and possible clinical implication of gastrointestinal melatonin[J].Biological Signals and Receptors,2001,10(6):350-366.
[7] BERTRAND P P,BERTRAND R L,CAMELLO P J,et al.Simultaneous measurement of serotonin and melatonin from the intestine of old mice:the effects of daily melatonin supple-mentation[J].Journal of Pineal Research,2010,49(1):23-34.
[8] MOTILVA V,CABEZA J,DE LA LASTRA C A.New issues about melatonin and its effects on the digestive system[J].Current Pharmaceutical Design,2001,7(10):909-931.
[11] HUETHER G.Melatonin synthesis in the gastrointestinal tract and the impact of nutritional factors on circulating melatonin[J].Annals of the New York Academy of Sciences,1994,719:146-158.
[12] TAN D X,MANCHESTER L C,ESTEBAN-ZUBERO E,et al.Melatonin as a potent and inducible endogenous antioxidant:synthesis and metabolism[J].Molecules,2015,20(10):18886-18906.
[13] KVETNOY I M,INGEL I E,KVETNAIA T V,et al.Gastrointestinal melatonin:cellular identification and biological role[J].Neuro Endocrinology Letters,2002,23(2):121-132.
[14] YANO J M,YU K,DONALDSON G P,et al.Indigenous bacteria from the gut microbiota regulate host serotonin biosynthesis[J].Cell,2015,161(2):264-276.
[15] LEE P P,PANG S F.Melatonin and its receptors in the gastrointestinal tract[J].Neurosignals,1993,2(4):181-193.
[16] NOSJEAN O,FERROM,COGE F,et al.Identification of the melatonin binding siteMT3 as the Quinone reductase 2[J].Journal of Biological Chemistry,2000,275(40):31311-31317.
[17] SALLINEN P,SAARELA S,ILVES M,et al.The expression of MT1and MT2melatonin receptor mRNA in several rat tissues[J].Life Science,2005,76(10):1123-1134.
[19] SÖDERQUIST F,HELLSTRÖM P M,CUNNINGHAM J L.Human gastroenteropancreatic expression of melatonin and its receptors MT1and MT2[J].PLoS One,2015,10(3):e0120195.
[21] WIESENBERG I,MISSBACH M,CARLBERG C.The potential role of the transcription factor RZR/ROR as a mediator of nuclear melatonin signaling[J].Restorative Neurology and Neuroscience,1998,12(2/3):143-150.
[22] MERLE A,DELAGRANGE P,RENARD P,et al.Effect of melatonin on motility pattern of small intestine in rats and its inhibition by melatonin receptor antagonist S 22153[J].Journal of Pineal Research,2000,29(2):116-124.
[23] DRAGO F,MACAUDA S,SALEHI S.Small doses of melatonin increase intestinal motility in rats[J].Digestive Diseases and Sciences,2002,47(9):1969-1974.

[25] SONG G H,LENG P H,GWEE K A,et al.Melatonin improves abdominal pain in irritable bowel syndrome patients who have sleep disturbances:a randomized,double blind,placebo controlled study[J].Gut,2005,54(10):1402-1407.
[26] SJÖBLOM M.The duodenal mucosal bicarbonate secretion[J].Upsala Journal of Medical Sciences,2005,110(2):115-149.
[27] REITER R J.Melatonin:lowering the high price of free radicals[J].News in Physiological Sciences,2000,15(5):246-250.
[28] REITER R J,PAREDES S D,MANCHESTER L C,et al.Reducing oxidative/nitrosative stress:a newly-discovered genre for melatonin[J].Critical Reviews in Biochemistry and Molecular Biology,2009,44(4):175-200.
[29] TAN D X,REITER R J,MANCHESTER L C,et al.Chemical and physical properties and potential mechanisms:melatonin as a broad spectrum antioxidant and free radical scavenger[J].Current Topics in Medicinal Chemistry,2002,2(2):181-197.
[30] ESPOSITO E,CUZZOCREA S.Antiinflammatory activity of melatonin in central nervous system[J].Current Neuropharmacology,2010,8(3):228-242.
[31] MEI Q,DIAO L,XU J M,et al.A protective effect of melatonin on intestinal permeability is induced by diclofenacviaregulation of mitochondrial function in mice[J].Acta Pharmacologica Sinica,2011,32(4):495-502.
[32] REITER R J,ROSALES-CORRAL S,TAN D X,et al.Melatonin as a mitochondria-targeted antioxidant:one of evolution’s best ideas[J].Cellular and Molecular Life Sciences,2017,74(21):3863-3881.
[33] TAMURA E K,SILVA C L M,MARKUS R P.Melatonin inhibits endothelial nitric oxide productioninvitro[J].Journal of Pineal Research,2006,41(3):267-274.
[35] CHETSAWANG B,PUTTHAPRASART C,PHANSUWAN-PUJITO P,et al.Melatonin protects against hydrogen peroxide-induced cell death signaling in SH-SY5Y cultured cells:involvement of nuclear factor kappa B,Bax and Bcl-2[J].Journal of Pineal Research,2006,41(2):116-123.
[36] GUHA M,MAITY P,CHOUBEY V,et al.Melatonin inhibits free radical-mediated mitochondrial-dependent hepatocyteapoptosis and liver damage induced during malarial infection[J].Journal of Pineal Research,2007,43(4):372-381.
[37] KIM C H,KIM K H,YOO Y M.Melatonin protects against apoptotic and autophagic cell death in C2C12 murine myoblast cells[J].Journal of Pineal Research,2011,50(3):241-249.
[38] ANDRABI S A,SAYEED I,SIEMEN D,et al.Direct inhibition of the mitochondrial permeability transition pore:a possible mechanism responsible for anti-apoptotic effects of melatonin[J].FASEB Journal,2004,18(7):869-871.
[39] REN W K,LIU G,CHEN S,et al.Melatonin signaling in T cells:functions and applications[J].Journal of Pineal Research,2017,62(3):e12394.
[40] HALDAR C,RAI S,SINGH R.Melatonin blocks dexamethasone-induced immunosuppression in a seasonally breeding rodent Indian palm squirrel,Funambuluspennanti[J].Steroids,2004,69(6):367-377.
[41] CAPELLI E,CAMPO I,PANELLI S,et al.Evaluation of gene expression in human lymphocytes activated in the presence of melatonin[J].International Immunopharmacology,2002,2(7):885-892.
[42] MUXEL S M,PIRES-LAPA M A,MONTEIRO A W,et al.NF-κB drives the synthesis of melatonin in RAW 264.7 macrophages by inducing the transcription of the arylalkylamine-N-acetyltransferase (AA-NAT) gene[J].PLoS One,2012,7(12):e52010.
[43] RAGHAVENDRA V,SINGH V,KULKARNI S K,et al.Melatonin enhances Th2 cell mediated immune responses:lack of sensitivity to reversal by naltrexone or benzodiazepine receptor antagonists[J].Molecular and Cellular Biochemistry,2001,221(1/2):57-62.
[44] YU Q N,MILLER S C,OSMOND D G.Melatonin inhibits apoptosis during early B-cell development in mouse bone marrow[J].Journal of Pineal Research,2000,29(2):86-93.
[45] CARRILLO-VICO A,LARDONE P J,LVAREZ-SNCHEZ N,et al.Melatonin:buffering the immune system[J].International Journal of Molecular Sciences,2013,14(4):8638-8683.
[46] TIAN Y M,ZHANG G Y,DAI Y R.Melatonin rejuvenates degenerated thymus and redresses peripheral immune functions in aged mice[J].Immunology Letters,2003,88(2):101-104.
[47] LIU F,NG T B,FUNG M C.Pineal indoles stimulate the gene expression of immunomodulating cytokines[J].Journal of Neural Transmission,2001,108(4):397-405.
[48] CURRIER N L,SUN L Z Y,MILLER S C.Exogenous melatonin:quantitative enhancementinvivoof cells mediating non-specific immunity[J].Journal of Neuroimmunology,2000,104(2):101-108.
[49] SANTELLO F H,FRARE E O,DOS SANTOS C D,et al.Suppressive action of melatonin on the TH-2 immune response in rats infected withTrypanosomacruzi[J].Journal of Pineal Research,2008,45(3):291-296.
[51] POHANKA M.Impact of melatonin on immunity:a review[J].Central European Journal of Medicine,2013,8(4):369-376.
[52] CARRILLO-VICO A,LARDONE P J,FERNNDEZ-SANTOS J M,et al.Human lymphocyte-synthesized melatonin is involved in the regulation of the interleukin-2/interleukin-2 receptor system[J].Journal of Clinical Endocrinology and Metabolism,2005,90(2):992-1000.
[53] CHEN Y,ZHANG J,ZHAO Q,et al.Melatonin induces anti-inflammatory effects to play a protective role via endoplasmic reticulum stress in acute pancreatitis[J].Cellular Physiology and Biochemistry,2016,40(5):1094-1104.
[54] DONG W G,MEI Q,YU J P,et al.Effects of melatonin on the expression ofiNOSandCOX-2 in rat models of colitis[J].World Journal of Gastroenterology,2003,9(6):1307-1311.
[55] ESPOSITO E,MAZZON E,RICCARDI L,et al.Matrix metalloproteinase-9 and metalloproteinase-2 activity and expression is reduced by melatonin during experimental colitis[J].Journal of Pineal Research,2008,45(2):166-173.
[56] LI J H,YU J P,YU H G,et al.Melatonin reduces inflammatory injury through inhibiting NF-κB activation in rats with colitis[J].Mediators of Inflammation,2005,2005(4):185-193.
[57] MAHMOOD N M A,JUMMA K M,HUSSAIN S A.Dose-dependent anti-inflammatory activity of melatonin in experimental animal model of chronic inflammation[J].Global Journal of Pharmacology,2010,4(2):66-70.
[58] MOZAFFARI S,ABDOLLAHI M.Melatonin,a promising supplement in inflammatory bowel disease:a comprehensive review of evidences[J].Current Pharmaceutical Design,2011,17(38):4372-4378.
[60] TRIANTAFILLIDIS A,TRIANTAFILLIDIS J K.Melatonin:a potent antioxidant agent with anti-inflammatory and anti-apoptotic effects that might be useful in the treatment of IBD patients[J].Annals of Gastroenterology,2009,22(1):10-12.
[61] GITTO E,MARSEGLIA L,MANTI S,et al.Protective role of melatonin in neonatal diseases[J].Oxidative Medicine and Cellular Longevity,2013,2013:980374.
[62] MAURIZ J L,COLLADO P S,VENEROSO C,et al.A review of the molecular aspects of melatonin’s anti-inflammatory actions:recent insights and new perspectives[J].Journal of Pineal Research,2013,54(1):1-14.
[63] YU G M,KUBOTA H,OKITA M,et al.The anti-inflammatory and antioxidant effects of melatonin on LPS-stimulated bovine mammary epithelial cells[J].PLoS One,2017,12(5):e0178525.
[64] MEI Q,YU J P,XU J M,et al.Melatonin reduces colon immunological injury in rats by regulating activity of macrophages[J].Acta Pharmacologica Sinica,2002,23(10):882-886.
[65] MAZZON E,ESPOSITO E,CRISAFULLI C,et al.Melatonin modulates signal transduction pathways and apoptosis in experimental colitis[J].Journal of Pineal Research,2006,41(4):363-373.
[66] SUN X C,SHAO Y Y,JIN Y,et al.Melatonin reduces bacterial translocation by preventing damage to the intestinal mucosa in an experimental severe acute pancreatitis rat model[J].Experimental and Therapeutic Medicine,2013,6(6):1343-1349.
[67] LIU T,ZHANG L Y,JOO D,et al.NF-κB signaling in inflammation[J].Signal Transduction and Targeted Therapy,2017,2:17023.
[68] XU P,WANG J,HONG F,et al.Melatonin prevents obesity through modulation of gut microbiota in mice[J].Journal of Pineal Research,2017,62(4):e12399.
[69] REN W K,WANG P,YAN J M,et al.Melatonin alleviates weanling stress in mice:involvement of intestinal microbiota[J].Journal of Pineal Research,2017,doi:10.1111/jpi.12448.
[70] ANDERSON G,MAES M.The gut-brain axis:the role of melatonin in linking psychiatric,inflammatory and neurodegenerative conditions[J].Advances in Integrative Medicine,2015,2(1):31-37.
