人溶菌酶基因密码子优化及其在小鼠乳腺中的表达
2018-04-20杨雪珍叶亚琼何兰花张绮琼
杨雪珍,叶亚琼,何兰花,张绮琼,王 晔,刘 燊*
(佛山科学技术学院动物科学系,广东佛山528000)
溶菌酶(lysozyme),又称胞壁质酶,根据其来源可分为动物型、植物型、细菌型和T4噬菌体型,其中动物型又分为C型、G型和I型。与蛋清溶菌酶类似,人溶菌酶(human lysozyme,hLZ)属于动物型的C型。在人体内,人溶菌酶作为一种非特异性免疫因子,是免疫系统和乳汁构成(0.4 mg/mL)的重要成员之一,发挥着杀菌消炎、免疫调节、改善胃肠道菌群等作用。然而,溶菌酶在其它动物乳汁中的表达却很低,如牛乳 0.13 μg/mL、山羊乳 0.25 μg/mL、猪乳 0.065 μg/mL[1-2],且其生物活性也明显低于人溶菌酶,如蛋清溶菌酶活性只有人溶菌酶的1/3[3],其中的原因值得进一步探究。人溶菌酶由130个氨基酸组成,分子量为14.7 kD,等电点为11。人溶菌酶基因位于12号染色体长臂上(12q15),序列全长6 807 bp(GenBank序列号:X14008),含有4个外显子和3个内含子。人溶菌酶作用机理主要为水解细菌细胞壁肽聚糖N-乙酰葡萄糖胺与N-乙酰氨基葡萄糖乳酸之间的β-1,4糖苷键,从而破坏细菌的细胞壁。同时,人溶菌酶还能螯合脂多糖和脂磷壁酸从而抑制炎症反应[4],以及对中性粒细胞的免疫调节作用,减少促炎症因子的产生[5]。
利用转基因动物,以动物乳腺为“生产车间”表达外源蛋白,是新一代的动物乳腺生物反应器技术。与微生物发酵和动物细胞培养相比,它具有生物活性高、易分离提纯、产量高等突出特点。人溶菌酶乳腺生物反应器的尝试最早为美国加州大学戴维斯分校Murray实验室,他们使用20 kb αS1酪蛋白启动子和人溶菌酶cDNA序列构建了乳腺表达载体,表达量在250~710 μg/mL间[6],之后使用该表达载体获得了转基因羊,表达量为270 μg/mL[7]。中国农业大学研究人员利用商业化载体pBC1(4.1 kb山羊β-酪蛋白启动子)和人溶菌酶基因组DNA构建了表达载体,获得转基因小鼠的最高表达量为1.4 mg/mL[8],但转基因牛的表达量却低至25.96 μg/mL[9]。之后,改造和利用人乳铁蛋白基因座作为控制元件,调控人溶菌酶基因组DNA,获得转基因小鼠乳汁的表达量为1.76 mg/mL[10],获得了转基因牛乳的表达量为3.1 mg/mL[11],实现了高效表达。但是,伴随着转基因舆论压力的增大和基因编辑技术(zinc-finger nucleases,ZFN;transcription activator like effector nucleases,TALENs 和 clustered regularly interspaced short palindromic repeats,CRISPR/Cas)日益成熟的情况下,原有的人溶菌酶乳腺生物反应器获得生物安全证书审批通过的可能性益加漫长,需要整合新的生物技术,制备外源基因定点整合、重组蛋白高效表达的人溶菌酶转基因动物[12]。为此,西北农林科技大学研究人员设计了锌指核糖核酸酶(ZFN)打靶体系,利用内源的αS2酪蛋白调控序列,指导人溶菌酶基因cDNA的表达,表现为微量表达(23~31 μg/mL)[13],需要继续提高表达量才有产业化价值,而密码子优化策略是提高外源基因表达量的方法之一,目前尚没有关于人溶菌酶优化密码子乳腺表达研究的报道。
基于不同物种或同一物种的不同器官/组织对密码子的使用频率不同,密码子优化策略可以显著提高其表达量[14]。本研究根据牛乳主要蛋白的密码子使用偏好,优化了人溶菌酶基因cDNA序列,连入已验证好的乳腺表达载体中(pMWAP-Zeo,包含8.5 kb 5’和 8.0 kb 3’小鼠乳清酸蛋白基因座调控序列)[15],制备了转基因小鼠,并验证了优化的人溶菌酶密码子表达效率,以为外源基因定点整合的人溶菌酶转基因动物的高效表达研究奠定基础。
1 材料与方法
1.1 实验材料
乳腺表达载体pMWAP-Zeo:由本实验室构建和保存;密码子优化设计的hLZ cDNA序列、PCR引物:由生工生物工程(上海)股份有限公司合成;实验动物:昆明白小鼠购自国家计划生育研究所动物部;分子生物学试剂(包括:pMD19-T载体、各种DNA内切酶、连接酶、聚合酶等;以及dNTP混合物、DNA分子量标记、感受态细胞等):购于大连TaKaRa公司;标准人溶菌酶纯品:购自Sigma-Aldrich公司;人溶菌酶多克隆抗体:购自US Biological Inc.公司。
1.2 pMWAP-hLZ-OP乳腺表达载体的构建
经密码子优化后的人溶菌酶cDNA序列(hLZ-OP)由全基因合成获得,并且在序列两端各加上一个NotⅠ酶切位点,以及在5′端的酶切位点与ATG之间加上ACC碱基以使起始序列符合Kozak规则[16]。pMWAP-Zeo由本实验室构建和保存,含有小鼠乳清酸蛋白(mWAP)基因座的8.5 kb 5’端,8.0 kb 3’端调控序列,以及新霉素(Zeocin)基因(替代mWAP基因)及其两端的NotⅠ酶切位点。通过NotⅠ酶切位点,将hLZ-OP DNA序列与pMWAP-Zeo载体相连,构建pMWAP-hLZ-OP乳腺表达载体。
1.3 转基因小鼠的PCR检测
表达载体pMWAP-hLZ-OP经PvuI和SalI酶切后,去除了原核序列骨架,回收得到线性化的目标片段。通过显微注射,将回收片段注射到受精卵的雄原核内,并将此受精卵移植到假孕受体鼠的输卵管内,出生小鼠。
取2~3周龄小鼠的尾巴组织样,提取DNA,使用3对引物鉴定小鼠的转基因阳性和插入基因的完整性(图 3A)。P1 引物,F:5′GAT CCA CAG GAC GGG TGT 3′,R:5′CTC CAG CCC ACT ATT TAG ACA 3′,产物长度 538 bp;PcDNA 引物,F:5′ACC ATG AAG GCC CTG ATC GTG 3′,R:5′TTA CAC TCC ACA TCC CTG CAC 3′,产物长度 450 bp;P2 引物,F:5′CCG AGT GAA TAA ATT AGA CA 3′,R:5′ACG GAA ATG TTG AAT ACT CAT 3′,产物长度 568 bp。
1.4 转基因小鼠乳汁的Western blot检测
在转基因小鼠生出仔鼠后的第7 d,按照文献方法采集转基因小鼠的乳汁[14]。将乳汁离心去除乳脂,调节pH值至4.0左右去除酪蛋白,再将pH值调至8.0,终稀释浓度为1∶10。之后进行蛋白电泳,乳清上样量为10 μL,转移至纤维素膜,然后用兔抗人溶菌酶多克隆抗体和羊抗兔二抗进行Western blot检测重组溶菌酶的表达。
2 结果与分析
2.1 人溶菌酶密码子优化
对牛乳主要的蛋白质(α-乳清蛋白、β-乳球蛋白、以及5种酪蛋白等)密码子的使用偏好性进行分析,发现牛乳蛋白质基因偏好以CG结尾(未发表数据),而野生型(WT)人溶菌酶基因偏好以CT结尾。基于密码子使用规则,在不改变编码氨基酸序列的基础上对447 bp的人溶菌酶基因密码子进行了偏好CG结尾的优化设计(图1)。相比野生型(WT),优化后的hLZ基因(hLZ-OP)共改变了95个碱基,约占hLZ基因碱基总数的21.3%,G+C含量由46.9%上升至57.9%。

图1 人溶菌酶基因的密码子优化
2.2 乳腺表达载体pMWAP-hLZ-OP构建
全基因合成的447 bp hLZ-OP首先连入pMD 19-T载体,测序验证cDNA序列和酶切位点正确后,命名为pMD19-hLZ-OP载体。乳腺表达载体pMWAP-Zeo由本实验室构建和保存,含有mWAP基因座的8.5 kb 5’端调控序列,两端为NotⅠ酶切位点的Zeocin基因和8.0 kb 3’端调控序列。使用NotⅠ内切酶分别酶切pMD19-hLZ-OP和pMWAP-Zeo载体,胶回收hLZ-OP和pMWAP目标片段。将两段回收的目标片段通过NotⅠ酶切位点连接,转入大肠杆菌DH5α感受态细胞中,挑选单克隆菌落测序并验证出正确的插入方向后,即构建完pMWAP-hLZ-OP乳腺表达载体(图2)。
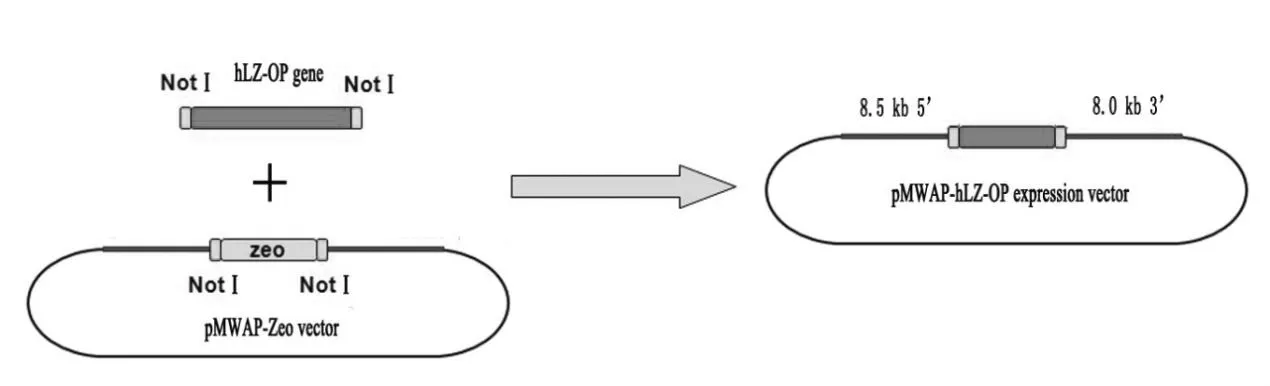
图2 人溶菌酶基因的密码子优化
2.3 转基因小鼠制备和PCR鉴定
乳腺表达载体pMWAP-hLZ-OP经PvuI和SalI酶切线性化后,去除原核骨架序列,再通过显微注射技术,注入小鼠受精卵的雄原核内。移植约500枚受精卵到12只受体鼠的输卵管内,共出生21只仔鼠。
采集鼠尾组织,提取基因组,进行PCR鉴定。使用3对引物鉴定转基因阳性和插入载体的完整性。引物P1位于表达载体的5′端,产物长度538 bp;引物P2位于表达载体的3′端,产物长度568 bp;引物PcDNA扩增的是hLZ cDNA序列,产物长度450 bp(图3A)。结果显示,共有4只仔鼠(编号为:4、6、9和19)为转基因阳性小鼠,阳性率19.04%,且插入的表达载体均具备完整性(图3B)。
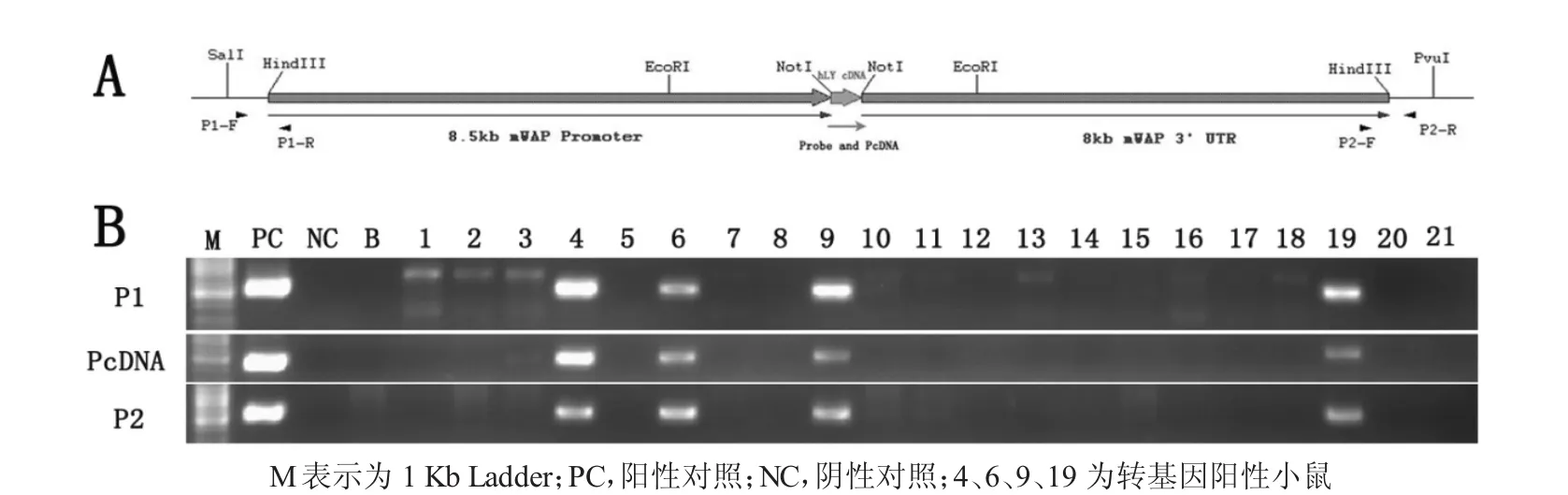
图3 人溶菌酶转基因小鼠的PCR鉴定
2.4 重组人溶菌酶在乳腺中的表达
转基因小鼠配种并生出仔鼠后,采集乳汁,进行Western blot检测重组人溶菌酶在乳汁中的表达。结果如图4所示,4只转基因小鼠的乳清样品均获得了阳性杂交信号,但又明显低于阳性对照(PC,30 ng/mL的人溶菌酶标准品)信号。因此,4、6、9、19转基因小鼠乳汁中均有微量的重组人溶菌酶表达。
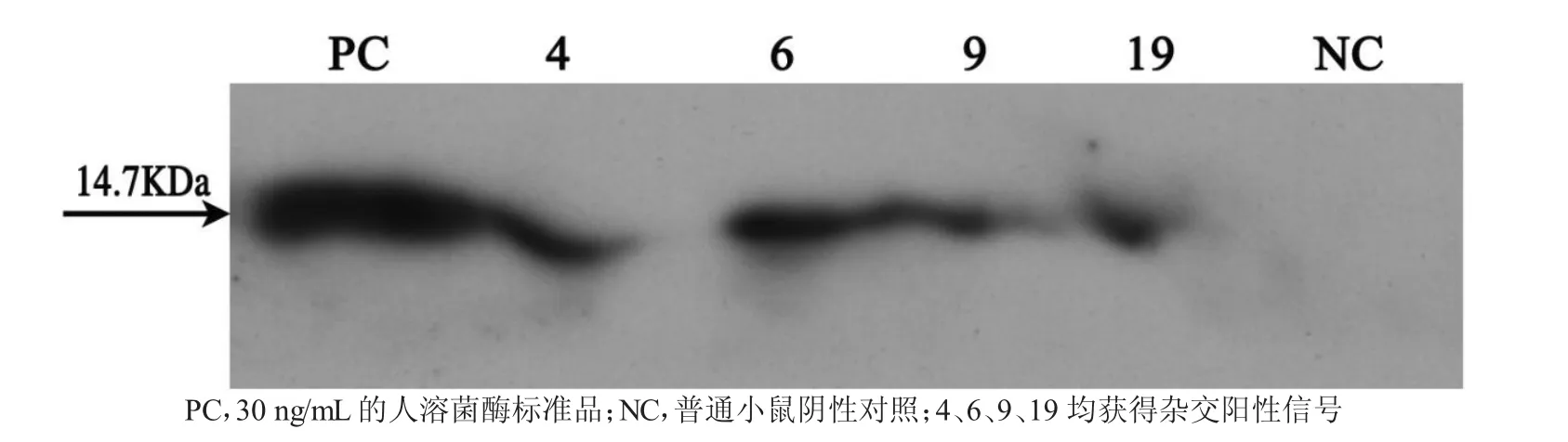
图4 Western blot检测鼠乳中rhLZ的表达
2.5 外源基因的遗传检测
4只原代转基因小鼠与非转基因公鼠配种后,共出生42只后代,其中20只经PCR鉴定为转基因阳性后代,阳性率为47.6%,基本符合孟德尔遗传规律。这表明,转基因小鼠的外源基因均可以稳定遗传给下一代。

表1 表达载体pMWAP-hLZ-OP获得的转基因小鼠情况
3 讨论
利用动物乳腺生物反应器大规模生产药用/保健蛋白,已是一项技术成熟且正在产业化的生物技术,且越来越表现独特的技术优势[17]。人溶菌酶是人乳蛋白的主要成分之一,在医药保健产品市场,特别是在婴幼儿奶粉方面,具有巨大的潜在价值。传统的细菌、酵母和细胞发酵等方法表达重组人溶菌酶存在着许多缺陷,无法进行产业化应用。而市场上销售的鸡蛋清溶菌酶,因为致敏性也极少能够应用于人类的保健产品。因此,利用动物乳腺生物反应器来生产重组人溶菌酶,制备“人乳化”牛奶一直是科学家的梦想[18]。
目前,美国加州大学戴维斯分校和中国农业大学已分别获得了具备产业化潜能的人溶菌酶转基因羊和转基因奶牛[6,10],西北农林科技大学研究人员利用内源的αS2酪蛋白启动子,指导人溶菌酶基因cDNA的表达,但是只有微量表达13,密码子优化策略是提高外源基因表达量的方法之一。
本研究主要根据牛乳主要蛋白偏好以CG结尾的特征,对野生型人溶菌酶基因进行了偏好CG结尾的优化设计,使用经验证过的乳腺表达载体pMWAP-Zeo,来验证密码子优化后的人溶菌酶基因的乳腺表达效率。原核注射后获得4只转基因小鼠,能按照孟德尔遗传规律将将外源基因传递给下一代,Western blot检测显示小鼠乳汁中有微量重组人溶菌酶的表达。因此,密码子优化后的人溶菌酶基因可以在小鼠乳腺中获得有效表达。由于影响外源基因表达的因素很多,诸如“位置效应”[20]、启动子的强弱、使用基因组DNA或cNDA、起始位点序列[16]等,这需要进一步的研究才能得到最优的结果。本研究可为外源基因定点整合的人溶菌酶转基因动物的高效表达研究奠定基础。
参考文献:
[1]COOPER C A,MAGA E A,MURRAY J D.Production of human lactoferrin and lysozyme in the milk of transgenic dairy animals:past,present,and future[J].Transgenic Res,2015,24(4):605-14.
[2]TONG J,WEI H,LIU X,et al.Production of recombinant human lysozyme in the milk of transgenic pigs[J].Transgenic Res,2011,20(2):417-9.
[3]王佃亮.重组人溶菌酶研究进展[J].中国生物工程杂志,2003(9):59-63.
[4]OHNON,MORRISONDC.Lipopolysaccharideinteractionswithlysozymedifferentiallyaffectlipopolysaccharideimmunostimulatory activity[J].Eur J Biochem,1989,186(3):629-36.
[5]GORDONLI,DOUGLAS S D,KAY N E,et al.Modulation ofneutrophil function bylysozyme[J].Potential negative feedback systemofinflammation.ed.;1979(64):26-32.
[6]MAGA E A,ANDERSON G B,MURRAY J D.The effect ofmammary gland expression ofhuman lysozyme on the properties of milk fromtransgenic mice[J].J DairySci,1995,78(12):2645-52.
[7]MAGA E A,SHOEMAKER C F,ROWE J D,et al.Production and processing of milk from transgenic goats expressing human lysozyme in the mammarygland[J].J DairySci,2006,89(2):518-24.
[8]YU Z,MENG Q,YU H,et al.Expression and bioactivity of recombinant human lysozyme in the milk of transgenic mice[J].J DairySci,2006,89(8):2911-8.
[9]YANG B,WANG J,TANG B,et al.Characterization of bioactive recombinant human lysozyme expressed in milk of cloned transgenic cattle[J].PLoSOne,2011,6(3):e17593.
[10]LIU S,LI X,LU D,et al.High-level expression ofbioactive recombinant human lysozyme in the milk oftransgenic mice using a modified human lactoferrin BAC[J].Transgenic Res,2012,21(2):407-14.
[11]LU D,LIU S,DING F,et al.Large-scale production of functional human lysozyme from marker-free transgenic cloned cows[J].Sci Rep,2016,6:22947.
[12]刘燊,鲁丹,林树茂,等.重组人溶菌酶动物生物反应器研究进展[J].农业生物技术学报,2017(4):659-667.
[13]LIU X,WANG Y,TIAN Y,et al.Generation of mastitis resistance in cows by targeting human lysozyme gene to beta-casein locus usingzinc-finger nucleases[J].Proc Biol Sci,2014,281(1780):20133368.
[14]KIMC H,OH Y,LEE T H.Codon optimization for high-level expression of human erythropoietin(EPO)in mammalian cells[J].Gene,1997,199(1-2):293-301.
[15]WU X,LIN Y,XI Y,et al.The development of transgenic mice for the expression of large amounts of human lysozyme in milk[J].Biotechnol Lett,2014,36(6):1197-202.
[16]KOZAK M.An analysis of vertebrate mRNA sequences:intimations of translational control[J].J Cell Biol,1991,115,(4),887-903.
[17]梁振鑫,尹富强,刘庆友,等.转基因动物乳腺生物反应器相关技术及研究进展[J].中国生物工程杂志,2015,35(2):92-98.
[18]于政权,樊宝良,戴蕴平,等.转基因小鼠乳腺表达重组人溶菌酶[J].科学通报,2003,48(20):2149-2153.
[19]CLARK A J,BISSINGER P,BULLOCK D W,et al.Chromosomal position effects and the modulation of transgene expression[J].Reprod Fertil Dev,1994,6(5):589-598.
