血浆儿茶酚抑素水平对心房颤动发生作用及机制研究
2018-04-20王慧莹徐爱茹赵楚敏宋月霞
许 涛,王慧莹,徐爱茹,赵楚敏,宋月霞,李 莉
0 引言
心房颤动是临床上最常见的心律失常类型之一,流行病学调查显示,总体人群中房颤发病率约为0.4%~1%,且近年来房颤发生率呈逐渐升高趋势[1];尽管针对房颤的具体发生及维持机制已有诸多研究,但房颤的具体机制尚不清楚;部分研究证实房颤是多因素作用的共同结果,其中较为热议的观点多集中在对交感神经活动的机制研究中[2]。儿茶酚抑素(Catestatin,CST)是Simon等[3-4]在1988年发现的由嗜铬颗粒A(Chromogranin A,CHGA)经蛋白酶水解产生的一种新型内源性血管活性多肽,其前体嗜铬颗粒A与儿茶酚胺共同储存与释放,能显著抑制烟酸诱导儿茶酚胺的释放,降低交感神经活性,提升副交感神经活性[5]。目前,国内外有多中心研究探讨儿茶酚抑素对心脏的调节功能,但极少有临床研究探讨儿茶酚抑素在心房颤动发生过程中可能的作用。本研究通过回顾性观察不同类型房颤及房颤发作与否等不同阶段患者血浆儿茶酚抑素水平,分析儿茶酚抑素在房颤发生及维持过程中可能的作用,为临床房颤机制的研究提供基础。
1 资料与方法
1.1 研究对象 选取2015年6月至2016年12月期间在我院心内科住院治疗的心房颤动患者78例,其中男47例,女31例;年龄49~70岁,平均(59.5±3.7)岁;分组依据2011年美国ACCF/AHA/HRS相关指南[6],将心房颤动组分为阵发性房颤组(PAF组,49例)及慢性房颤组(CAF组,29例)。慢性心房颤动包括持续性心房颤动(房颤发作持续时间超过7 d,非自限性)、长期持续性房颤(持续时间≥1年,患者有转复意愿)及永久性心房颤动(房颤发作持续时间≥1年,不能终止或终止后有复发,无转复意愿);阵发性心房颤动指房颤发作持续时间≤7 d(常≤48 h),能自行终止;同时选取我院同期住院治疗的无房颤病史、合并疾病相似的50例窦性心律患者作为对照组。排除标准:①目前或既往心脏瓣膜病、心肌梗死以及心肌病等器质性心脏病;②心功能NYHA评级≥2级;③既往或目前患有甲状腺功能亢进、嗜铬细胞瘤及原发性醛固酮增多症等内分泌激素失调性疾病;④患有结核、恶性肿瘤、感染等疾病;⑤患有肝肾功能不全或自身免疫病;⑥妊娠期妇女;⑦脑血管病急性期及近3个月有外伤及大手术病史。
1.2 研究方法
1.2.1 一般资料 记录患者年龄、性别、身高、体重、血压(入院后连续3 d 8∶00与16∶00坐位血压均值)等。
1.2.2 实验室检查 采集晨起空腹肘静脉血2 mL,测定患者空腹血糖(FBG)、三酰甘油(TG)、总胆固醇(TC)、丙氨酸氨基转移酶(ALT)、肌酐(Cre)、肌钙蛋白T(cTnT)、N末端脑钠肽前体(NT-proBNP)水平。
1.2.3 血浆儿茶酚抑素检测 78例房颤患者采集血标本时均为房颤发作时(49例阵发性房颤患者房颤发作时间在6~80 h,平均为34.5 h),治疗1个月后,三组患者均采集晨起空腹肘静脉血标本。血标本4 ℃离心(3 000 r/min)10 min,收取血浆检测CST水平,使用酶联免疫吸附测定(ELISA)试剂盒及CST试剂盒(美国RD公司)进行检测。
1.2.4 心脏超声心动图 应用7500超声仪(飞利浦公司)对所有受试者进行心脏超声检测,检查时患者采取平卧位,探头频率为2~4 MHz,放置探头在心脏周围多部位,记录患者左心室舒张末期内径(LVDd)、左心室射血分数(LVEF)、左心房内径(LAD)及室间隔厚度(IVST),反复多次检测,取3个心动周期的均值。

2 结果
2.1 入选患者一般资料比较 与对照组比较,入院时房颤组患者心率加快、收缩压及LVEF降低、LAD增大,NT-proBNP升高,差异有统计学意义(P<0.05)。两组患者年龄、血压、日常用药、实验室及超声心动图检测指标等比较差异无统计学意义(P>0.05)。见表1。
2.2 各组血浆儿茶酚抑素表达水平比较 房颤组血浆儿茶酚抑素水平明显低于对照组,差异有统计学意义(P<0.05),CAF组、PAF组血浆CST水平均低于对照组,差异有统计学意义(P<0.05);与PAF组比较,CAF组血浆CST水平降低,但差异无统计学意义(P>0.05)。见表2。
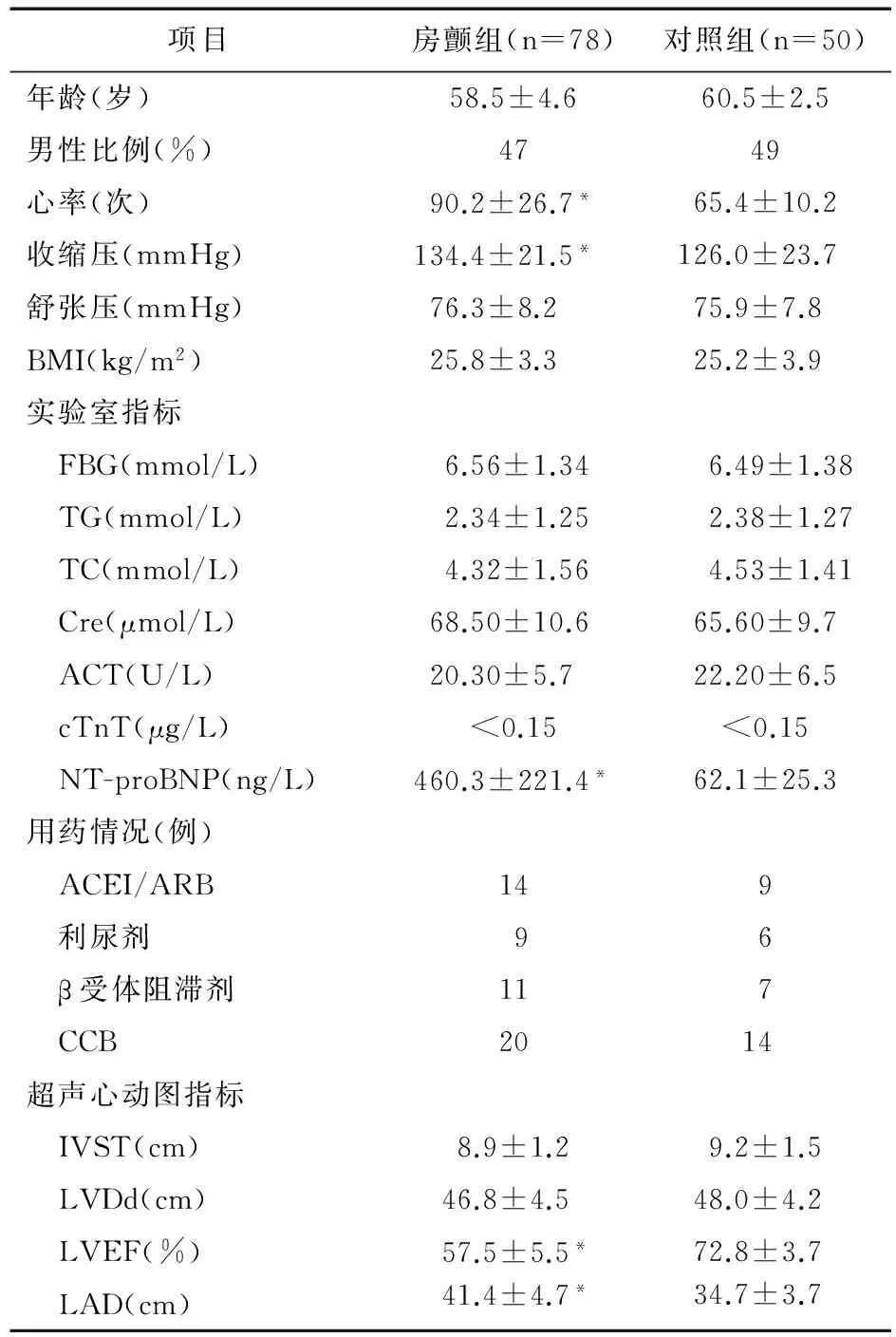
表1 房颤组与对照组一般资料比较
注:与对照组比较,*P<0.05

表2 各组血浆儿茶酚抑素表达水平比较
注:与对照组比较,*P<0.05
2.3 治疗1个月后各组间指标比较 与对照组比较,转复组、发作组血浆CST水平均明显降低,差异有统计学意义(P<0.05);房颤组组内比较,血浆CST水平差异无统计学意义(P>0.05)。与对照组比较,房颤发作组LVEF明显降低,差异有统计学意义(P<0.05),转复组偏低,但差异无统计学意义(P>0.05)。房颤组内比较,转复组LVEF明显升高(P<0.05)。见表3。

表3 各组治疗1个月后随访各指标变化比较
注:与对照组比较,*P<0.05;与发作组比较,#P<0.05
2.4 不良反应 原数据纳入132例患者,治疗期间出现1例药物过敏事件,1例退出终点事件及2例失访事件,均不纳入上述数据分析中,128例患者均圆满完成观察随访治疗。
3 讨论
心房颤动作为心律失常的常见类型,可明显增加心血管疾病的发病率和病死率,目前其具体机制尚不清楚,既往研究证明,心房重构、分子遗传机制、炎性反应等均参与房颤触发和维持,其中交感神经活动发挥着重要作用[7]。Tisdale等[8]通过在实验犬上建立心力衰竭模型,发现合并心房颤动的实验犬血浆去甲肾上腺素(Norepinephrine,NE)水平显著高于单纯心力衰竭犬,同时,血浆NE升高出现在房颤发生之前,推测交感神经活动对心力衰竭犬心房颤动发生具有一定的促进作用。有研究在实验犬上通过心房快速起搏建立房颤模型,阻断其交感神经的传入及传出后发现,房颤的持续和发生明显受到抑制,进一步证明交感神经活动与房颤发生的相关性。
血浆儿茶酚抑素是大鼠嗜铬蛋白A(CHGA)经内切酶降解生成的一种新型的具有心血管活性的内源性神经内分泌活性肽,主要以自分泌形式作用于烟碱型乙酰胆碱受体(nAChRs),负反馈调节儿茶酚胺的释放,降低儿茶酚胺的分泌量[9],抑制心脏交感神经活性,影响房颤的发生与维持。同时,血浆CST还可以以旁分泌的方式刺激肥大细胞释放组胺[10],扩张血管,降低血压,以调节心脏功能。既往研究证明,有高血压家族史、现患高血压及心力衰竭者血浆儿茶酚胺抑素水平明显降低[10-12];并且有研究发现,急性心肌梗死(AMI)患者血浆CST水平与血浆NE水平呈反比关系,表现为先降后升的趋势变化,在发病最初4 h内伴随血浆NE水平升高而逐渐下降,在36 h内血浆NE水平下降时出现上升的趋势,同时呈现一定比例关系[13]。心肌梗死、高血压等心血管疾病发病时出现血浆CST下降,抑制CA释放作用减弱,交感神经活性增强现象。然而有研究显示,心血管疾病过程中血浆CST可出现明显上升趋势,考虑是因为部分心血管疾病发生过程中交感神经过度兴奋,为拮抗交感神经活性而大量表达血浆CST,一定程度上间接反映了交感神经兴奋或自主神经失衡的程度[14]。多种心血管疾病发生与维持均有血浆CST水平的变化,提示血浆CST与心血管疾病的发生与维持具有密切关联。
既往研究表明,血浆CST可通过抑制心室肌细胞L型Ca2+离子通道,而降低心律失常的发生率[15]。本研究显示,房颤组患者血浆CST明显低于对照组,结果与刘园梅等[9]的研究结果相一致。血浆CST作为一种内源性儿茶酚胺释放抑制剂,血浆表达水平降低时,作用于神经元烟酸乙酰胆碱受体亚型形成的负反馈调节机制减弱,交感神经兴奋性增高,导致房颤的发生及维持。同时,当交感神经系统兴奋过度时,也可通过代偿性大量表达血浆CST来发挥其负反馈调节作用,抑制其兴奋性。房颤发作时,由于心脏节律的改变,左心室射血分数降低,机体通过神经-体液调节,反应性提高交感神经兴奋性,也可减少血浆CST含量,但本研究表明,不同类型房颤患者血浆CST水平差异无统计学意义,虽然CAF组较PAF组血浆CST有下降的趋势,但差异无统计学意义,治疗1个月后转复组左室射血分数明显上升,患者血浆CST仍处于一种低表达状态,考虑血浆CST表达的下降与左室射血分数关系不大,提示交感神经激活可能并非仅参与心房颤动的发生,而是完全贯穿于心房颤动的整个疾病过程。
临床工作中房颤的治疗多依赖心电图诊断后给予药物转复及射频消融等治疗,虽可恢复其窦性心律,但极易反复;目前阶段的医疗技术手段对于心血管衰老、发病是不能消除的,但是可以通过预防性干预而延缓其发病时间,降低其时间发病率。心房颤动是心脏器质性病变及心血管不良事件的主要危险因素之一,高效地控制房颤的发生可显著降低不良心血管事件的发生。
综上所述,血浆CST水平变化可能与心房颤动的发生与维持存在着密切的关系,且其关系与左室射血分数变化无明显关联性;血浆CST水平的降低可能是心房颤动发生的独立预测因素,针对临床上心电图无明显房颤律、而血浆CST明显降低的心悸患者,应充分考虑房颤高发或阵发性房颤发作间歇期可能,积极给予相关药物预防房颤发作。本研究为单中心小样本研究,存在一定局限性,仍需扩大样本量、细化患者分类等进一步论证研究。
参考文献:
[1] Yu L,Scherlag BJ,Li S,et al.Low-level transcutaneous electrical stimulation of the auricular branch of the vagus nerve:a noninvasive approach to treat the initial phase of atrial fibrillation[J].Heart Rhythm,2013,10(3):428-435.
[2] Workman AJ.Cardiac adrenergic control and atrial fibrillation[J].Naunyn Schmiedebergs Arch Pharmacol,2010,381(3):235-249.
[3] Simon JP,Bader MF,Aunis D.Secretion from chromaffin cells is controlled by chromogranin A-derived peptides[J].Proc Natl Acad Sci USA,1988,85(5):1712-1716.
[4] Liu L,Ding W,Zhao F,et al.Plasma levels and potential roles of catestatin in patients with coronary heart disease[J].Scand Cardiovasc J,2013,47(4):217-224.
[5] Hoq MI,Niyonsaba F,Ushio H,et al.Human catestatin enhances migration and proliferation of normal human epidermal keratinocytes[J].J Dermatol Sci,2011,64(2):108-118.
[6] Lippi D,Mascia G,Padeletti L.Sir James Mackenzie:from auricular paralysis and nodal rhythm to auricular fibrillation[J].J Interv Card Electrophysiol,2011,31(3):263-266.
[7] Kanaporis G,Blatter LA.Alternans in atria:mechanisms and clinical relevance[J].Medicina (Kaunas),2017,53(3):139-149.
[8] Tisdale JE,Borzak S,Sabbah HN,et al.Hemodynamic and neurohormonal predictors and consequences of the development of atrial fibrillation in dogs with chronic heart failure[J].J Card Fail,2006,12(9):747-751.
[9] 刘园梅,朱丹,何榕,等.心房颤动患者血浆儿茶酚抑素水平及其与心房颤动类型的关系[J].中国心血管杂志,2015,20(2):85-89.
[10]陈斌,孙黎明.儿茶酚抑素—一种新的心血管活性肽[J].中华高血压杂志,2011,19(2):112-115.
[11]Liu L,Ding W,Li R,et al.Plasma levels and diagnostic value of catestatin in patients with heart failure[J].Peptides,2013,46:20-25.
[12]O′Connor DT,Kailasam MT,Kennedy BP,et al.Early decline in the catecholamine release-inhibitory peptide catestatin in humans at genetic risk of hypertension[J].J Hypertens,2002,20(7):1335-1345.
[13]Zhu D,Xie H,Wang X,et al.Correlation of plasma catestatin level and the prognosis of patients with acute myocardial infarction[J].PLoS One,2015,10(4):e0122993.
[14]Meng L,Wang J,Ding WH,et al.Plasma catestatin level in patients with acute myocardial infarction and its correlation with ventricular remodelling[J].Postgrad Med J,2013,89(1050):193-196.
[15]李华波,陈世健,胡建华.儿茶酚抑素对慢性心力衰竭大鼠室性心律失常的影响[J].中国病理生理杂志,2013,29(12):2128-2132.
