miR-34a调控PAX6的表达增强视网膜母细胞瘤的侵袭和迁移
2018-04-20黄玉婵
黄玉婵 吴 峰
(湖北科技学院眼科,咸宁 437100)
视网膜母细胞瘤(Retinoblastoma,RB)是儿童眼科恶性肿瘤中发病率和致盲率最高的肿瘤,在儿童中发病率约为0.5‰。不仅影响患儿的视力甚至可能致残致死[1]。RB也是儿童肿瘤中发现的第一种与抑癌基因表达相关的眼科肿瘤。虽然目前可以通过手术加放疗提高一定的治愈率,但仅局限于早期病变[2]。所以,RB早期发现和诊断有重大临床意义,甚至可以大幅度提高治愈率。所以研究RB侵袭转移的机制,寻找早期诊断的相关分子靶点成为RB研究的重点。
越来越多的证据表明,通过微小RNA(miRNA)介导的基因表达调控在控制细胞增殖和肿瘤发生中起重要作用[3]。miRNA是一类小的非编码RNA,其在进化过程中呈现高度保守状态,最近已经被证明可作为基因表达的有效调节剂。肿瘤抑制miRNA下调致癌miRNA过表达在肿瘤发生中起关键作用[4]。Katsura等[5]证明膀胱癌组织中miR-34a的表达水平异常,可影响肿瘤细胞增殖侵袭等行为。最近的一些研究表明,miR-34a水平在前列腺癌中下调,对胃癌和胰腺癌也有一定的调控作用[6,7]。
PAX6基因是PAX基因家族成员之一,可以编码转录基因,在机体发育和疾病进展过程中扮演重要角色[8]。PAX6同时也是一种干细胞因子,在乳腺癌、胃肠恶性肿瘤中表达水平升高[9,10],这表明PAX6可能影响肿瘤的发展过程。而且大部分肿瘤的发生过程中都存在一定程度的癌基因变异情况,许多相关因子也参与其过程,因此研究这些相关基因的功能及机制是恶性肿瘤的一种重要治疗方向。本研究旨在揭示miR-34a和PAX6在RB中的表达及对细胞系的侵袭、迁移能力的影响,并初步探讨其作用的可能机制。
1 材料与方法
1.1材料
1.1.1临床标本采集及处理 收集2015年1月~2016年1月在我院手术切除并且经病理检查确诊为RB组织50例,同时取正常视网膜组织50例。RB患者术前未进行放疗。肿瘤组织离体后,去除血迹,放入4%多聚甲醛固定。所有组织标本的收取均获得患者本人的同意并签署知情同意书,并通过医院伦理委员会的同意。
1.1.2细胞系和主要试剂 人RB细胞系(Y79、Rb50、Rb44、SM-106)购于中国科学院上海生命科学研究院生物化学与细胞生物学研究所。细胞均呈贴壁生长状态,所用培养基为含10%胎牛血清的高糖培养基。PAX6、p-JAK、p-STAT一抗均购自 Abcam(ab233654、ab65524、ab75622)。miR-34a mimic购自上海吉凯制药技术有限公司,Transwell小室购自美国Millipore公司。
1.2方法
1.2.1免疫组织化学 将病理组织切片在60℃烤箱中孵育2 h。取出后在梯度酒精中水化15 min,滴加0.3%的H2O2溶液孵育15 min,使用PBS充分冲洗5 min; 滴加0.3% Triton-100,孵育15 min,增加细胞膜的通透性,使用PBS充分冲洗5 min; 加入配置好的一抗,4℃存放孵育过夜;吸去抗体,使用PBS充分冲洗5 min; 加入配置好的二抗,37℃孵育15 min,使用PBS充分冲洗5 min; 按照顺序加入免疫组化ABC增强液,均在37℃下孵育15 min,加入DAB显色液,进行免疫组织化学显色,在显微镜下进行观察,最后使用梯度酒精脱水后,中性树脂封片保存,阳性细胞百分比对应值免疫组化结果阳性标准:阳性细胞百分比对应的值:将阳性的细胞数<5% 算为0分,5%~25% 1分,25%~50%为2分,50%~75%为3分,>75%为4分。然后将染色强度伊阳性细胞百分比对应的值作为评分,0~1为阴性,2~4为弱阳性,5~8为中阳性,9~12为强阳性。
1.2.2PCR 荧光定量PCR检测miR-34a的表达 使用miRNA提取试剂盒进行miR-34a抽提,实验过程按照试剂盒使用说明进行,抽提之后,使用核酸浓度检测仪检测RNA浓度和纯度,最后将其浓度稀释至50 μg/ml,使用特异性反转录引物进行cDNA合成,反应条件按照cDNA合成试剂盒使用说明进行设置,均使用U6作为内参。反应条件:95℃预变性10 min、95℃变性15 s、60℃退火32 s,循环50次后检测其溶解曲线,检测完成后,通过计算机系统自动分析各样本Ct值,然后采用2-ΔΔCt计算miRNA的相对表达量。实验重复3次。miR-34a引物序列:5′-CACTCTATATAGTGTATCTTTC-3′(正向)和5′-GGCTTTTAGTGTACGTCGTAATG-3′(反向),U6内参引物序列:5′-CCTAGGGAGATTGAGGGGCA-3′(正向)和5′-GGCTATTAGCTTGGAAACGA-3′(反向)。
1.2.3慢病毒载体感染Rb50细胞 将RB Rb50细胞置于含有10%胎牛血清DMEM培养基中,在37℃、5%CO2培养箱中培育,取生长对数期的Rb50细胞,通过慢病毒转染获得过表达miR-34a的细胞,分别将编码miR-34a-mimic的慢病毒感染到Rb50细胞中,以获得过表达miR-XXX的细胞。并根据制造商提供的说明书使用Lipofectamine 2000(Invitrogen,Carlsbad,CA)将其转染入细胞48 h,获得具有稳定表达的miR-34a克隆细胞株。
1.2.4双荧光素酶报告基因实验 将miR-34a DNA片段克隆到ph-TK载体(肾脏荧光素酶)中,同时使用pGL-3.0(荧光素酶)作为内部对照。根据 siPORTneoFX使用方法操作,在转染后48 h制备裂解物。 然后根据制造商提供的说明书,使用双荧光素酶测定系统(Promega,San Luis Obispo,CA)进行荧光素酶分析。实验重复3次。
1.2.5Transwell侵袭实验检测RB细胞迁移能力 通过Transwell对细胞侵袭能力测定。将癌细胞在含有0.1%FBS的培养基中培养。 24 h后,将细胞接种在有基质胶的小室中,将具有10%FBS的培养基置于下腔中。在37℃下孵育24 h后,小心地去除上膜表面的细胞。用95%乙醇固定20 min后,用0.5%结晶紫溶液染色10 min,自来水冲洗干净过后,于倒置显微镜下计数。实验重复3次。
1.2.6划痕实验检测RB细胞迁移能力 划痕实验:将Rb44细胞转染绿色荧光,划痕时易于观察细胞迁移状况,将细胞接种在6孔板中并培养80%~90%汇合度。用无菌的200 ml移液管尖端刮擦细胞单层,产生宽度约1 mm的“伤口” (无细胞区域)。 将用无菌洗涤液洗涤2次。除去松散的细胞碎片,并用新鲜培养基更换。 处理前在相差显微镜下拍摄伤口的限定区域。 24、48及72 h后,再次拍摄相同的区域,并通过图像确定剩余的伤口面积。采用伤口实验期间的初始和最终伤口面积确定伤口闭合率,计算伤口闭合计算伤口闭合率=[(初始距离)-(最终距离)/(初始距离)]×100%。 实验重复3次。

2 结果
2.1RB中miR-34a和PAX6的差异性表达 免疫组化结果显示:PAX6定位在细胞膜和细胞浆,在RB组织中表达水平较高。miR-34a在RB组织中表达明显低于正常视网膜组织。50例RB组织中,41例(82%)PAX6表达阳性;50例正常视网膜组织中,11例(22%)PAX6表达阳性(图1)。表明RB组织中PAX6的表达明显高于正常视网膜组织,差异具有统计学意义(P<0.05)。
2.2miR-34a和PAX6之间的表达相关性 PAX6在RB患者和正常人之间的表达差异明显,具有统计学意义(P<0.05)。miR-34a和PAX6在RB患者和正常人之间的表达阳性率差异明显,具有统计学意义(P<0.05,表1)。
2.3PAX6在不同RB细胞株中的表达 Western blot实验结果显示:相比Rb50、Y79、SM-106细胞株,PAX6蛋白在Rb44细胞株中表达最低(图2),所以后续实验选取Rb44 RB细胞作为实验细胞株。
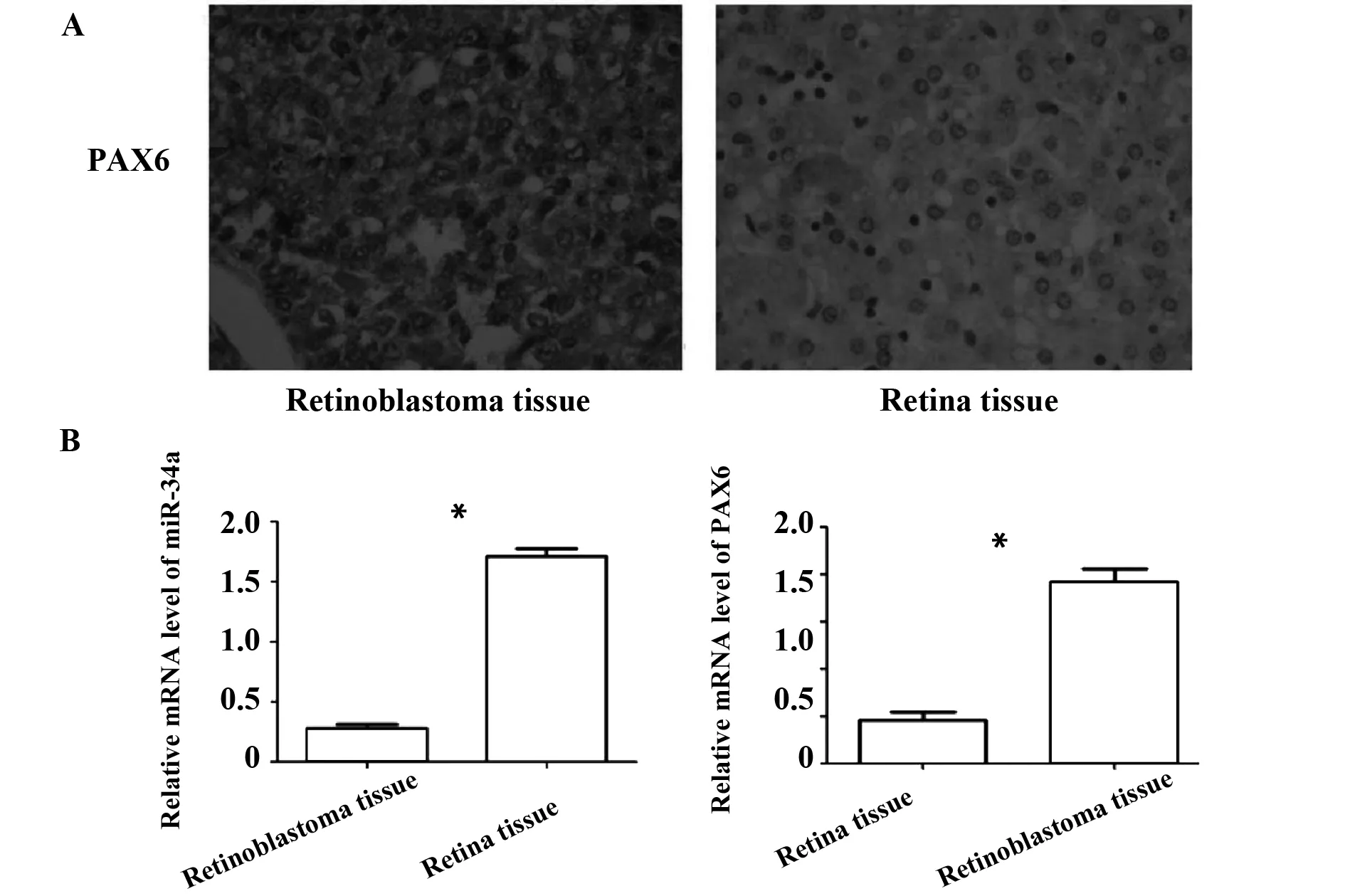
图1 视网膜母细胞瘤中miR-34a和PAX6的差异性表达Fig.1 Differential expression of miR-34a and PAX6 in retinoblastomaNote: A.Immunohistochemical staining(×20);B.PCR.*.P<0.05.
2.4双荧光素酶报告基因实验验证miR-34a与PAX6的靶向关系 通过生物信息学进行预测(targetscan),miR-34a与PAX6蛋白的3′UTR端有相似的结合位点(图3A)。结果发现,和对照组比较,RB Rb44转染miR-34a-mimic后,PAX6的mRNA水平明显降低(图3B)。双荧光素酶实验检测发现PAX6是miR-34a的直接靶点。这提示miR-34a是调控PAX6的一个关键因子。
2.5Transwell实验检测过表达miR-34a后视网膜母细胞瘤细胞的侵袭能力变化 Transwell实验结果显示如图4示:miR-34a-mimic组穿透过基质胶的细胞数量明显少于NC组[(186.25±7.75)% vs (47.75±5.76)%,P<0.05],差异有统计学意义。该结果表明,过表达miR-34a的表达后可以有效抑制视网膜母细胞瘤Rb44细胞的侵袭能力。
2.6划痕实验检测过表达miR-34a后视网膜母细胞瘤细胞的迁移能力变化 划痕实验结果表明(图5):与NC组相比,在24、48、72 h时,miR-34a-mimic组迁移率明显降低[24 h (18.68±1.21)% vs(36.61±4.21)%,P<0.05;48 h (35.99±5.61)%vs (62.69±8.61)%,P<0.05;72 h (58.61±6.94)% vs (89.51±10.32)%,P<0.05],差异有统计学意义。划痕实验表明过表达miR-34a可以抑制Rb44细胞的迁移能力。
2.7过表达miR-34a后JAK1-STAT3信号蛋白因子的表达变化 Western blot实验结果显示:与NC组相比,miR-34a-mimic组中p-JAK1和p-STAT3蛋白表达水平明显降低[(68.15±6.75)% vs (11.52±4.34)%,(75.15±5.32)% vs (14.39±6.51)%,P<0.05],非磷酸化JAK1和STAT3的表达无明显变化,PAX6的蛋白表达水平也相应降低[(71.54±6.75)% vs (19.65±4.34)%];说明miR-34a的过表达可以有效下调信号通路p-JAK1和p-STAT3蛋白的表达。
表1视网膜母细胞瘤与正常视网膜组织中PAX6和miR-34a的表达相关性
Tab.1CorrelationbetweenmRNAofPAX6andmiR-34ainretinoblastomaandnormalretinatissues
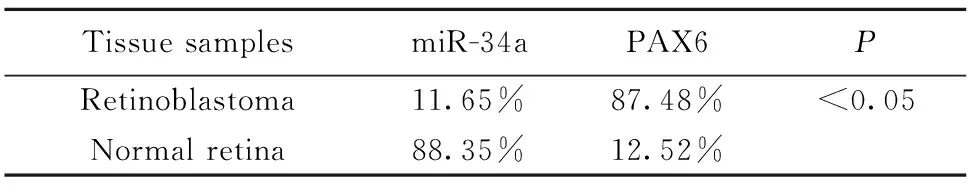
TissuesamplesmiR-34aPAX6PRetinoblastoma11.65%87.48%<0.05Normalretina88.35%12.52%

图2 PAX6在不同视网膜母细胞瘤细胞株中的表达Fig.2 Expression of PAX6 in different retinoblastoma cell linesNote: RB50 group compared with other cell lines,*.P<0.05.
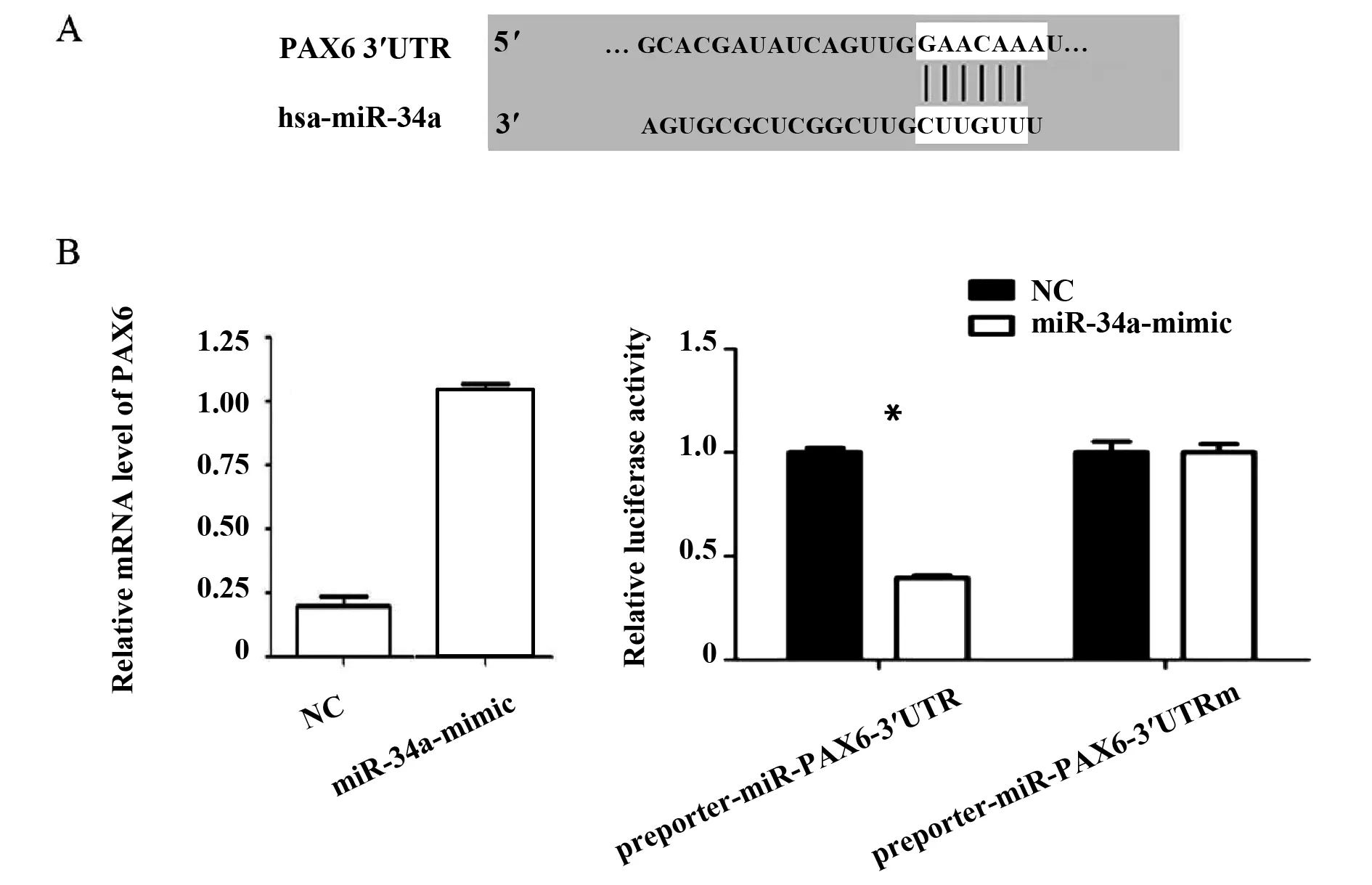
图3 双荧光素酶报告基因实验验证miR-34a 与PAX6 的靶向关系Fig.3 Dual luciferase reporter assays verify targeting relationship between miR-34a and PAX6Note: A.Mutation sites between miR-34a and PAX6;B.PAX6 was regulated through miR-34a.Error bars represent standard error.*.P<0.05.
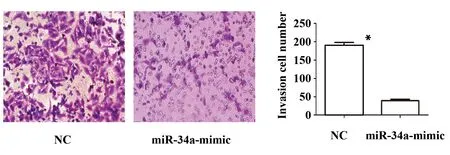
图4 Transwell实验检测miR-34a的表达对Rb44细胞侵袭行为的作用(结晶紫染色,×40)Fig.4 Transwell assay to detect effect of miR-34a expression on Rb44 cell invasion(Crystal violet staining,×40)Note: *.P<0.05.
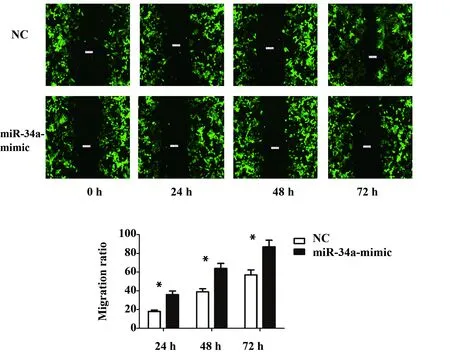
图5 划痕实验检测miR-34a的表达对RB44细胞迁移行为的作用Fig.5 Scratch experiment effect of miR-34a expression on migration of RB44 cells was examinedNote: *.P<0.05.
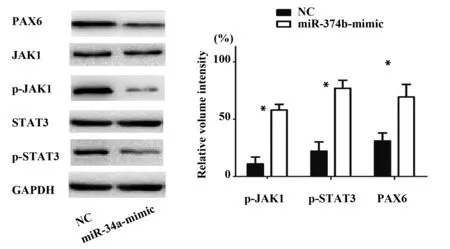
图6 过表达miR-34a后p-JAK1和p-STAT3通路蛋白表达水平降低Fig.6 Expression of p-JAK1 and p-STAT3 pathway protein was down-regulation after overexpression of miR-34aNote: *.P<0.05.
3 讨论
miRNA参与不同的生物学过程,如转录调节、细胞分化和肿瘤发生。 miRNA也被称为细胞增殖的重要调节因子,最近报道miR-34a是一种肿瘤抑制因子[11-13]。miR-34a可能通过调节PI3K/Akt(磷脂酰肌醇3-激酶/Akt)和MAPK(丝裂原活化蛋白激酶)信号通路,诱导肿瘤细胞生长的协同抑制[14,15]。最近,在鼻咽癌和结肠直肠癌中已经发现miR-34a表达异常[16,17]。然而,miR-34a在调节RB进展中的作用不是很清楚。第一部分的实验结果显示 miR-34a在视RB细胞中呈现出较低的表达水平,提示miR-34a的低表达可能与RB细胞的维持和自我更新有一定的关系。
PAX6是配对体基因家族的成员之一,其可以作为转录因子参与多种细胞的发育过程[18]。 PAX6首先在1991年被发现,是由422个氨基酸的多肽产物组成,其具有N-末端配对结构域(PD),中间的同源结构域(HD)和富含丝氨酸/苏氨酸的C-末端结构域,所有结构基序具有转录因子的特征[19]。 PAX6的功能研究发现其与垂体腺,神经内分泌细胞和胰腺胰岛细胞的发育相关[20]。作为早期分化标记,PAX6也用于鉴定目前干细胞研究中神经元和神经内分泌细胞的前体构成[21]。PAX6在不同肿瘤中通过作用于不同信号通路发挥不同的作用,在视网膜母细胞瘤中PAX6的具体作用和作用机制尚未有研究详细阐述。
JAK1和STAT3是属于JAK/STAT家族中的转录活化因子蛋白,当 STAT3发生磷酸化的时候形成二聚体,并转移进细胞核与染色体上靶基因启动子进行结合,诱导位于其下游的基因即靶基因转录激活[22]。同时磷酸化的STAT3可以调控细胞G1/S期及G2/M 期的调控因子使细胞生存周期延长,进而促进细胞的恶性转变[23]。STAT3和 P-STAT3在多种恶性肿瘤如肝癌、肺癌、卵巢癌、宫颈癌中均有异常表达,且持续高水平的 STAT3表达可引发其下游肿瘤相关基因的激活及表达,促进细胞增殖、新生血管形成及新陈代谢以及抑制抗肿瘤免疫反应的发生[24,25]。
本实验是研究在体外环境下miR-34a靶向PAX6在视网膜母细胞瘤的作用。体外实验表明miR-34a可以靶向PAX6调控视网膜母细胞瘤的生物学行为,且miR-34a 可能通过PAX6的表达而起到对视网膜母细胞瘤的抑制作用。而后面继续通过Western blot验证过表达miR-34a后JAK/STAT信号通路蛋白水平的变化显示,miR-34a过表达后可能通过降低PAX6的表达下调p-JAK1和p-STAT3的蛋白水平,进而影响视网膜母细胞瘤的侵袭和迁移。
本研究表明miR-34a在视网膜母细胞瘤组织中表达降低,而PAX6在视网膜母细胞瘤组织中表达明显增高,同时发现miR-34a可以靶向调控PAX6的表达,通过JAK1/STAT3信号通路调控视网膜母细胞瘤细胞的侵袭和迁移。提示miR-34a和PAX6可能参与视网膜母细胞瘤的发展过程,有可能成为预测视网膜母细胞瘤的发生和进展的标志物。
参考文献:
[1] Youn JI,Kumar V,Collazo M,etal.Epigenetic silencing of retinoblastoma gene regulates pathologic differentiation of myeloid cells in cancer[J].Nat Immunol,2013,14(3):211-220.
[2] Villanueva MT.Tumorigenesis:Establishing the origin of retinoblastoma[J].Nat Rev Cancer,2014,14(11):706-707.
[3] Martin J,Bryar P,Mets M,etal.Differentially expressed miRNAs in retinoblastoma[J].Gene,2013,512(2):294-299.
[4] Veija T,Sahi H,Koljonen V,etal.miRNA-34a underexpressed in Merkel cell polyomavirus-negative Merkel cell carcinoma[J].Virchows Archiv,2015,466(3):289-295.
[5] Katsura A,Morishita A,Iwama H,etal.MicroRNA profiles following metformin treatment in a mouse model of non-alcoholic steatohepatitis[J].Int J Mol Med,2015,35(4):877-884.
[6] Gaur S,Wen Y,Song JH,etal.Chitosan nanoparticle-mediated delivery of miRNA-34a decreases prostate tumor growth in the bone and its expression induces non-canonical autophagy[J].Oncotarget,2015,6(30):29161.
[7] Lou W,Chen Q,Ma L,etal.Oncolytic adenovirus co-expressing miRNA-34a and IL-24 induces superior antitumor activity in experimental tumor model[J].J Mol Med,2013,91(6):715-725.
[8] Bhatia S,Bengani H,Fish M,etal.Disruption of autoregulatory feedback by a mutation in a remote,ultraconserved PAX6 enhancer causes aniridia[J].Am J Human Gene,2013,93(6):1126-1134.
[9] Mi D,Carr CB,Georgala PA,etal.Pax6 exerts regional control of cortical progenitor proliferation via direct repression of Cdk6 and hypophosphorylation of pRb[J].Neuron,2013,78(2):269-284.
[10] Xia X,Yin W,Zhang X,etal.PAX6 overexpression is associated with the poor prognosis of invasive ductal breast cancer[J].Oncol Letters,2015,10(3):1501-1506.
[11] Castro R E,Ferreira DMS,Afonso MB,etal.miR-34a/SIRT1/p53 is suppressed by ursodeoxycholic acid in the rat liver and activated by disease severity in human non-alcoholic fatty liver disease[J].J Hepatol,2013,58(1):119-125.
[12] Yang P,Li Q J,Feng Y,etal.TGF-β-miR-34a-CCL22 signaling-induced Treg cell recruitment promotes venous metastases of HBV-positive hepatocellular carcinoma[J].Cancer Cell,2012,22(3):291-303.
[13] Xia J,Duan Q,Ahmad A,etal.Genistein inhibits cell growth and induces apoptosis through up-regulation of miR-34a in pancreatic cancer cells[J].Curr Drug Target,2012,13(14):1750-1756.
[14] Corcoran C,Rani S,O′Driscoll L.miR-34a is an intracellular and exosomal predictive biomarker for response to docetaxel with clinical relevance to prostate cancer progression[J].Prostate,2014,74(13):1320-1334.
[15] Zhang S,Chen P,Huang Z,etal.Sirt7 promotes gastric cancer growth and inhibits apoptosis by epigenetically inhibiting miR-34a[J].Sci Rep,2015,5:9787.
[16] Tomosugi M,Sowa Y,Yasuda S,etal.Retinoblastoma gene-independent G1 phase arrest by flavone,phosphatidylinositol 3-kinase inhibitor,and histone deacetylase inhibitor[J].Cancer Sci,2012,103(12):2139-2143.
[17] Malik AI,Williams A,Lemieux CL,etal.Hepatic mRNA,microRNA,and miR-34a-Target responses in mice after 28 days exposure to doses of benzo (a) pyrene that elicit DNA damage and mutation[J].Environ Mol Mutagen,2012,53(1):10-21.
[18] Gregory-Evans CY,Wang X,Wasan KM,etal.Postnatal manipulation of Pax6 dosage reverses congenital tissue malformation defects[J].J Clin Invest,2014,124(1):111-116.
[19] Tylkowski MA,Yang K,Hoyer-Fender S,etal.Pax6 controls centriole maturation in cortical progenitors through Odf2[J].Cell Mol Life Sci,2015,72(9):1795-1809.
[20] Cavodeassi F,Bovolenta P.New functions for old genes:Pax6 and Mitf in eye pigment biogenesis[J].Pigment Cell Melanoma Res,2014,27(6):1005-1007.
[21] Huang B S,Luo Q Z,Han Y,etal.microRNA-223 promotes the growth and invasion of glioblastoma cells by targeting tumor suppressor PAX6[J].Oncol Rep,2013,30(5):2263-2269.
[22] Swiatek-Machado K,Mieczkowski J,Ellert-Miklaszewska A,etal.Novel small molecular inhibitors disrupt the JAK/STAT3 and FAK signaling pathways and exhibit a potent antitumor activity in glioma cells[J].Cancer Biol Therapy,2012,13(8):657-670.
[23] Chen Q,Zhang H,Yang H.Expression of interleukin 6,signal transducer and activator of transcription 3 and vascular endothelial growth factor in human glioma and their relationship[J].Chin J Exp Surg,2006,23:1457-1459.
[24] Inoue K,Sugiyama H,Ogawa H,etal.Expression of the interleukin-6 (IL-6),IL-6 receptor,and gp130 genes in acute leukemia[J].Blood,2014,84(8):2672-2680.
[25] Knüpfer H,Preiss R.Lack of knowledge:breast cancer and the soluble interleukin-6 receptor[J].Breast Care,2010,5(3):177-180.