金复康优化方联合吉非替尼对非小细胞肺癌细胞H1975的影响及作用机制
2018-04-20*
*
1.安徽中医药大学,安微 合肥 230031;2 江苏省中医药研究院,江苏 南京 210028
肺癌是全球发病率最高的恶性肿瘤之一,在我国,其发病率与死亡率亦居各种恶性肿瘤的首位。其中非小细胞肺癌(Non-small Cell Lung Cancer,NSCLC)作为肺癌的主要类型之一,占肺癌患者的85%以上,并且多数患者确诊时已处于晚期,丧失了手术治疗的机会[1],而引起非小细胞肺癌的主要原因是由于EGFR(Epidermal Growth Factor Receptor,表皮生长因子受体)突变,尤其是二次突变T790M[2]和c-Met的扩增[3]。非小细胞肺癌细胞H1975含有T790M和L858R双突变,作为由T790M突变导致的EGFR-TKI获得性耐药研究模型得到广泛应用[4],H1975细胞对吉非替尼的耐药性为PC9细胞的100倍以上,其机制可能与调控T790M突变亚群细胞中的基因参与EGFR-TKI耐药机制有关[5]。
随着表皮生长因子受体酪氨酸激酶抑制剂( EGFR Tyrosine Kinase Inhibitors,EGFR-TKIs)的出现,显著延长了患者的生存期,改善了患者的生活质量,从而改变了肺癌的标准治疗模式[4]。第一代可逆性表皮生长因子受体酪氨酸激酶抑制剂吉非替尼的产生对于EGFR突变的肺癌患者有显著的临床疗效,并得到了广泛的使用,其主要作用机制是竞争性结合EGFR胞内域上的结合位点,阻止EGFR受体憐酸化,从而阻止EGFR产生的信号向下游传递,抑制其下游PI3K/AKT/mTOR通路激酶的活性,阻碍肿瘤生长、转移、血管生成且诱导肿瘤细胞凋亡[6]。但随着患者用药时间的延长,产生了严重的耐药反应,抗肿瘤作用明显下降,限制了吉非替尼在临床上的应用[7]。因此,研究如何防治吉非替尼耐药成为治疗非小细胞肺癌的关键。
近年来,中药与吉非替尼联用已经成为治疗肺癌的热点。例如,大黄素联合吉非替尼可明显抑制HCC827·GR细胞株p-EGFR,p-ERK1·2,p-Met的表达[8];姜黄素联合吉非替尼用于PC-9·G2,其细胞存活率比单用吉非替尼组降低13%~22%[9]。金复康处方为全国中医肿瘤治疗中心的刘嘉湘教授经30余年的临床实践归纳所得,金复康与化疗药并用,有助于提高化疗效果,改善免疫功能,减轻化疗引起的白细胞下降。金复康优化方(ALG-X-012)是由江苏省中医药研究院在对金复康二次开发的基础上,针对金复康处方中组分结构进行优化研究而成,使其处方更加简单有效地发挥抗癌作用,本研究拟通过MTT比色法,细胞划痕实验,流式细胞术,蛋白质印迹法考察了优化方ALG-X-012联用吉非替尼对非小细胞H1975的增殖影响并初步探讨了其作用机制与EGFR-PI3k-AKT信号通路可能的关系。
1 仪器与材料
1.1材料ALG-X-012(黄芪饮片:批号20160513;麦冬饮片:批号20160718;淫羊藿饮片:批号20160601;黄精饮片:批号20160625,安徽井泉中药饮片有限公司)。四甲基偶氮蓝( MTT,美国Sigma公司),DMSO(Amresco,美国),吉非替尼 ( Gefitinib,CAS: 184475-35-2, 美国 Selleck 公司)。吉非替尼用DMSO配成10 mmol/L储备液,-20 ℃保存。RPMI1640 培养液、0.25% Tripsin(南京凯基生物),细胞培养皿(Corning,美国),PBS(Hyclone,美国),DMEM(Corning,美国),FBS(ExCell,美国),6 well cell culture plate(Corning,美国),乙醇(国药),Annexin V-APC·7-AAD细胞凋亡检测试剂盒(凯基生物),细胞周期检测试剂盒、全蛋白抽提试剂盒、Braford蛋白含量检测试剂盒、5×SDS-PAGE蛋白上样缓冲液、SDS-PAGE凝胶配制试剂盒、预染蛋白分子量、电转移缓冲液、丽春红染色液、ECL检测试剂盒、显影定影试剂等均购自碧云天公司,p-EGFR(博士德,Bm4115,稀释比:1∶200),p-mTOR(abcam,Ab137133,1∶1000),P-AKT(Cell signaling,#4060,1∶1000),β-actin(博士德,Bm0627,1∶500)。
1.2仪器CO2培养箱(Thermo,美国),生物安全柜(Thermo,美国),低速离心机(Thermo,美国),微量移液器(Thermo,美国),Milli-Q纯水机(Millipore,美国),全自动酶标仪(Thermo Electrom,美国),倒置显微镜(Leica,德国),流式细胞仪(Merck,德国)。
2 方法
2.1ALG-X-012的制备黄芪、黄精、麦冬以及淫羊藿按照87∶12∶77∶24的比例首次煎煮用10倍量的水,煎煮2 h后,再用8倍量的水煎煮,将两次的煎煮液合并,旋蒸浓缩至50 mL,过膜备用。
2.2细胞培养人肺腺癌细胞株H1975购于复旦大学细胞库,来源于美国物种保存中心(American Type Culture Collection,ATCC)。用含10%胎牛血清及100U·mL青霉素和链霉素的RPMI1640培养基,置于37 ℃、5% CO2饱和湿度的培养箱中常规培养,用0.25% 胰蛋白酶消化传代。
2.3MTT法测定联合用药对细胞增殖的影响取指数生长期的H1975细胞,2000 r·min-1离心2 min,弃去上清液,用培养液打匀,制成细胞悬液。用血细胞计数板计数后,稀释成浓度为4×104个细胞/mL的细胞悬液,接种于96孔板,每孔100 μL,置于培养箱培养。24 h后分别给予空白对照组(RPMI1640无血清培养),ALG-X-012(0.0625、0.125、0.25、0.5、1、2、4、8、16 mg/mL) 、吉非替尼( 0.1、1,2、3、5、10、20 μmol/L) 及ALG-X-012(1 mg/mL) 加吉非替尼( 1 μmol/L) 联合干预,每个浓度设置6个复孔。72 h后,每孔加入20 μL MTT( 5 mg/mL) ,在细胞培养箱中继续培养。4 h后弃去上清,每孔加入150 μL DMSO,振荡后置酶标仪上于570 nm处测定每孔的吸光度( OD值)。
细胞存活率( %) = (给药组OD均值- 空白组OD值) /(对照组OD均值-OD空白组值) ×100%。
2.4划痕实验检测联合用药对细胞迁移的影响收集处于对数生长期细胞,按每孔1×105个细胞接种6孔板,培养24 h后弃上清液,实验设正常细胞对照组和不同药物实验组,用10μl枪头垂直划出划痕,实验孔分别加入无血清的RPMI1640培养对照组,ALG-X-012(1 mg/mL)、吉非替尼(1 μmol/L)以及两药联合(1 mg/mL ALG-X-012与1 μmol/L吉非替尼)培养基4 mL。于0 h、12 h、24 h在显微镜下拍照,得出划痕宽度与面积。
划痕面积=划痕长度×划痕宽度。
2.5流式细胞术检测联合用药对细胞凋亡的影响取对数生长期的细胞,按照每孔1×105个接种于6孔板中,按照空白组、ALG-X-012(1 mg/mL)、吉非替尼(1 μmol/L)、联合给药组(1 mg/mL ALG-X-012与1 μmol/L吉非替尼),继续培养24 h,去除培养基,用PBS清洗3次,用胰酶消化细胞。用PBS清洗细胞两次,离心收集细胞,不少于1×105个细胞。加入500 μL的Binding Buffer悬浮细胞,加入5 μL Annexin V-APC混匀后,加入 5 μL 7-AAD染液混匀。室温下避光保存5~15 min,于流式细胞仪中检测。
2.6Western Bolt检测细胞相关蛋白细胞接种于6孔板中,常规培养24 h后,按照空白对照组、ALG-X-012(1 mg/mL)、吉非替尼(1 μmol/L)、联合给药组(1 mg/mL ALG-X-012与1 μmol/L吉非替尼),将细胞用胰酶消化后,各加入200 ul冰预冷裂解缓冲液,混匀后冰浴30 min,充分裂解,于4 ℃,13000 r·min[-1]离心10 min。将上清分装,存于-20 ℃备用。应用BCA分析试剂盒测定蛋白浓度,将蛋白在SDS-PAGE电泳分离, 转膜至PVDF膜并作好标记,用TBST洗膜 10 min 3次。加入含5%脱脂奶粉封闭2 h,一抗4 ℃摇床振荡孵育过夜,TBST洗10 min 3次。加入二抗室温反应2 h,用TBST洗膜5~10 min。将ECL化学发光液暗盒中曝光。使用Gel-Pro32软件对结果进行灰度分析。

3 结果
3.1MTT法检测联合用药对细胞增殖的影响ALG-X-012组、吉非替尼组以及两者联合用药对H1975细胞增殖比较结果如图1所示,低浓度(0.1~5 μmol·L)吉非替尼对H1975细胞的增殖没有显著的抑制作用,当吉非替尼浓度超过5 μmol/L时,对H1975细胞增殖有抑制作用,IC50=9.542±1.20 μmol/L。单独使用浓度范围在0.0625~16 mg/mL的ALG-X-012作用于耐药H1975细胞72 h,其对H1975细胞增殖没有明显抑制作用。ALG-X-012(1 mg/mL)与吉非替尼(1 μmol/L)联合后,H1975细胞增殖被明显抑制(细胞存活率为52%),比吉非替尼相比,抑制细胞增殖率提高了37%,出现ALG-X-012逆转吉非替尼耐药的现象。
3.2划痕实验检测联合用药对细胞迁移的影响各给药组对H1975细胞迁移能力的影响结果如图2所示,分别给药0 h,12 h,24 h之后,空白对照组,ALG-X-012组及吉非替尼组对于H1975细胞都有不同程度的迁移,划痕宽度以及面积明显减少。联合用药组在12 h和24 h,划痕宽度及面积与空白组比较有显著变化,其划痕宽度比空白组多22%~30%,面积多15%~28%,说明联合用药组能够抑制细胞迁移。进一步说明ALG-X-012可以增强吉非替尼给药对H1975细胞的抑制作用。
3.3流式细胞术检测联合用药对细胞凋亡的影响药物作用于H1975细胞24 h后,应用流式细胞术检测凋亡结果,如图3所示。单用吉非替尼(1 μmol/L)细胞凋亡率为(4.47±0.28)%,单用ALG-X-012(1 mg/mL)细胞凋亡率为(3.93±0.15)%。两药合用后细胞凋亡率为(11.43±0.96)%,相比较于单独用药,其凋亡率增加了2.5~2.9倍,凋亡率显著增(P<0.05)。
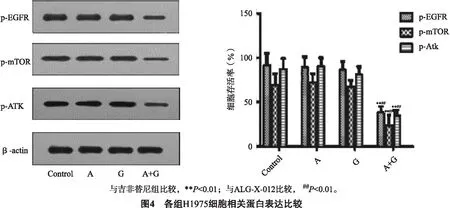
3.4Western Bolt检测细胞相关蛋白各组给药后H1975细胞EGFR-PI3k-AKT信号通路相关蛋白表达比较结果,如图4所示。ALG-X-012,吉非替尼以组对p-EGFR、p- AKT、p-mTOR无明显下调,与单独用药组相比,联合用药显著下调p-EGFR、p- AKT、p-mTOR,其可能机制与抑制p- AKT活性,EGFR活化,p-mTOR 活化从而阻断EGFR/PI3k/AKT通路有关。


4 讨论
吉非替尼(Gefitinib)是第一代可逆性治疗NSCLC分子靶向的表皮生长因子受体酪氨酸激酶抑制剂,其主要攻击的靶点是EGFR,EGFR的突变与异常表达引起PI3K/AKT信号通路异常[10],促进肿瘤细胞的快速增殖、侵袭及转移[11],是驱动肺癌发生和发展的主要病因之一,因此PI3K/AKT信号通路表达与肺癌发展密切相关。研究表明金复康口服液不仅能够抑制肺癌的远处转移,改善肺癌患者生存质量,延长生存期,与吉非替尼联用后,对PC-9R细胞的增殖抑制影响明显增强,逆转吉非替尼对PC-9R的耐药,且对p-EGFR有一定的下调[12]。ALG-X-012是在金复康原方的基础上进行优化而成,本研究探讨ALG-X-012联用吉非替尼对非小细胞肺癌细胞H1975的影响。
MTT实验结果表明,低于5 μmol/L吉非替尼对H1975细胞增殖无明显抑制作用,浓度为0.0625~16 mg/ml ALG-X-012对H1975细胞无明显抑制作用。但吉非替尼(1 μmol/L)与ALG-X-012(1 mg/mL)联合用药后,显著降低了H1975细胞的存活率,比单用1μmol/L吉非替尼组降低约37%,可以看出两药联用后,增加了吉非替尼对细胞的抑制作用;而后进一步采用划痕实验考察联合用药对细胞迁移的影响,与空白组相比,吉非替尼组,ALG-X-012组在12 h和24 h,划痕宽度与面积均无明显变化,表明单独用药组对H1975细胞迁移无明显抑制作用。联合用药组经过12 h和24 h后,与空白对照组相比,划痕的宽度与面积有显著性差异,空白组划痕宽度为(511.47±31) μm,联合用药组为(719.67±27) μm,可得看出联合用药组对于H1975细胞的迁移有明显的抑制作用;细胞凋亡检测结果显示,吉非替尼组与ALG-X-012组在24 h后对H1975细胞凋亡无明显诱导作用,但当吉非替尼联合ALG-X-012用药后,与单独用药组比,H1975细胞凋亡率显著提高约2.5~2.9倍,表明联合用药组能增加吉非替尼对H1975细胞凋亡的诱导作用。提示AL9G-X-012与吉非替尼联用后可增加H9175细胞对吉非替尼的敏感程度,增强其抗肿瘤药效。
为了探讨两者联用可能作用的机制,实验进一步应用Western blot 检测EGFR-PI3k-AKT信号通路相关蛋白的表达。p-EGFR、p-mTOR、p-AKT蛋白都是EGFR-PI3k-AKT信号通路相关的重要蛋白,p-AKT是PIK3信号通路下游的激酶,在抑制细胞凋亡和促进细胞增殖中有重要影响,p-mTOR参与肿瘤细胞的生长、分化、免疫调节,其活化与EGFR-TKI耐药有直接的关系。Western blot结果显示,空白组、吉非替尼组、ALG-X-012组对p-EGFR、p-AKT、p-mTOR蛋白并无显著下调,联合用药组相比吉非替尼组对p-EGFR、p-AKT、p-mTOR蛋白的下调显著,差异有统计学意义(P<0.01)。因此ALG-X-012与吉非替尼联用对H1975细胞的机制可能与抑制EGFR和p-mTOR的活化有关。
综上所述,EGFR-PI3k-AKT信号通路是肿瘤生长的重要通路,它的失调会促进肿瘤细胞的生长并抑制细胞凋亡。金复康优化方ALG-X-012与吉非替尼的联用对非小细胞肺癌H1975细胞有显著抑制细胞增殖,诱导肿瘤细胞凋亡,抑制肿瘤细胞迁移的作用,其机制可能是ALG-X-012阻断了EGFR-PI3k-AKT信号通路,从而增强吉非替尼抗肿瘤活性。
[1]李学真,邹文,马进安,等.EGFR-T790M突变所致吉非替尼耐药肺腺癌细胞化疗药物敏感性变化的研究[J].中国癌症杂志,2015,25(2):129-134.
[2]Huang Lihua, Fu Liwu. Mechanisms of resistance to EGFR tyrosine kinase inhibitors. Acta Pharmaceutica Sinica B (2015)[EB/OL].2015-07-001.http://dx.doi.org/10.1016/j.apsb.
[3]David Jackman.Clinical Definition of Acquired Resistance to Epidermal Growth Factor Receptor Tyrosine Kinase Inhibitors in Non-Small-Cell Lung Cancer[J] . Journal of Clinical Oncology,2010,28 (2) : 357--360.
[4]Sordella R,Bell DW,HaberDA.Gefitinib-sensitizing EGFR mutations in lung cancer activate anti-apoptotic pathways[J] . Science,2004(305):1163-1167.
[5]王永生,丁晶晶,苗立云,等.人肺腺癌吉非替尼获得性耐药株H1975细胞与敏感株PC9细胞miRNA谱表达差异[J].中国肿瘤,2013,22(9):743-747.
[6]Jiang H.Overview of gefitinib in non-small cell lung cancer:an Asian perspective[J].Jpn J Clin Oncol,2009(39):137-150.
[7]康小红,龚亚斌,王立芳,等.蟾毒灵联合吉非替尼对肺癌细胞H1975的影响及机制研究[J].中国中西医结合杂志,2013,33(8):1081-1085.
[8]欧阳学农,房文铮,吴淡森,等.大黄素逆转非小细胞肺癌EGFR-TKI耐药的机制研究[J].临床肿瘤学杂志,2014,19(11):967-971.
[9]盛琦,陈建,李菌.姜黄素逆转非小细胞肺癌吉非替尼耐药的研究[J].中国现代应用药学,2013,30(4):360-364.
[10]Mok TS, Lee K,Leung L. Targeting epidermal growth factor receptor on the managenment of lung cancer[J]. Semin Oncol, 2014, 41(1): 101-109.
[11]Zhou C, Wu Y L, Chen G, et al. Final overall survival results from a randomised, phase Ⅲstudy of erlotinib versus chemotherapy as first-linetreatment of EGFR mutation-positive advanced non-small cell lung cancer(OPTIMAL,CTONE-0802) [J]. Ann Oncol, 2015, 26(9): 1877-1883.
[12]孙玺媛,姜梅,张伟.金复康口服液对非小细胞人肺腺癌吉非替尼获得性耐药的影响[J].中药材,2014,37(7):1254-1258.
