动态增强MRI定量评估乳腺良恶性病变的效能
2018-04-20南聪慧王慧颖袁宝霖
南聪慧,张 伟,王慧颖,华 薇,袁宝霖
(中国医科大学附属盛京医院放射科,辽宁 沈阳 110004)
DOI:10.13929/j.1003-3289.201707125
动态增强MRI(dynamic contrast-enhanced MRI, DCE-MRI)筛查乳腺癌具有较高敏感度,已由美国癌症协会推荐用于检查乳腺癌高风险患者[1]。Warner等[2]研究显示DCE-MRI较乳腺X线摄影具有更高敏感度,尤其对于患乳腺癌高风险的年轻女性。但DCE-MRI特异度较低,特别是当乳腺良恶性病变的形态学与血流动力学特征重叠时,诊断较为困难[3-5]。据报道[6],在MRI发现异常后进行乳腺活检的患者中,恶性病变的检出率约29%。常规MR检查在形态学上难以区分部分病变的良恶性,而DEC-MRI血流动力学参数有助于进一步鉴别乳腺病变良恶性,从而减少不必要的活检[7]。目前基于可疑恶性病变的血流动力学模型所获得的定量参数已被应用,可提高诊断病变准确率[8-9],此外,有关背景实质强化(background parenchymal enhancement, BPE)与乳腺癌风险的相关性已见报道[10]。本研究探讨DCE-MRI中乳腺病灶和背景实质定量参数评价乳腺良恶性病变的价值。
1 资料与方法
1.1 一般资料 回顾性分析我院2016年1月—7月经手术病理证实、术前接受乳腺增强MR检查的41例患者(共45个病灶)资料,均为女性,年龄16~75岁,平均(44.3±9.8)岁。排除标准:①假体植入术后;②乳腺占位术后;③DCE-MRI图像质量不佳,无法获得有效的定量参数值。41例中,2例为双乳病灶,2例为单乳双病灶,良性病灶21个(良性组;其中腺病伴增生6个,乳腺腺病4个,乳腺纤维腺瘤4个,乳腺炎症3个,乳腺导管内乳头状瘤2个,乳腺腺病伴导管上皮非典型增生1个,乳腺纤维腺瘤样增生1个),恶性病灶24个(恶性组;其中浸润性导管癌14个,导管原位癌8个,浸润性小叶癌1个,浸润性筛状癌1个)。
1.2 仪器与方法 采用GE Signal Excite HD 3.0T超导型MR成像系统,8通道乳腺专用表面线圈。嘱患者俯卧,使双乳对称、自然悬垂于乳腺线圈内。主要扫描参数:①轴位FSE T1W序列,TR 360 ms,TE 7.4 ms,层厚5 mm,层间距0,矩阵512×512,FOV 340 mm;②轴位FSE T2W脂肪抑制序列,TR 5 080 ms,TE 100 ms,层厚5 mm,层间距0,矩阵512×512,FOV 340 mm;③多期动态增强,双侧乳腺轴位及矢状位成像,TR 7.4 ms,TE 4.2 ms,层厚2.2 mm,无间隔扫描,翻转角15°,矩阵1 024×1 024,FOV 360 mm;④3D快速梯度回波序列,采用高压注射器经肘正中静脉注射对比剂Dd-DTPA,以2~3 ml/s流速于10 s内快速团注,进行连续8个时相动态增强扫描,每个时相持续时间76.4 s,无间隔,动态增强扫描总时间10 min 11 s。
1.3 图像后处理 将动态增强图像导入GE Omni-Kinetics软件行后处理,采用Reference Region模型,选取病灶层面对侧胸大肌为参考区域,绘制ROI:①病灶ROI取病灶最大截面积层面,面积约203.06 mm2,尽量包括实性组织,避开坏死组织、空洞、囊变、液化及钙化等;②背景实质ROI选取病灶周围相对致密的纤维腺体, 面积约36.72 mm2,避开腺体边缘、脂肪、血管等结构。分别测量容量转移常数(volume transfer constant, Ktrans)、速率常数(rate constant, Kep)、血浆分数(plasma fraction, Vp),每组数据测量3次,取平均值。依据2013版ACR BI-RADS atlas[11],将乳腺纤维腺体组织(fibroglandular tissue, FGT)特征分为脂肪型、少量腺体型、不均匀致密型以及致密型;背景实质强化分为几乎没有、少量、中等、显著;将脂肪型、少量腺体型、不均匀致密型合并为非致密型;几乎没有、少量、中等强化合并为非显著强化。

2 结果
2.1 乳腺良恶性病变的定量参数值 良性组、恶性组病灶及背景实质的定量参数Ktrans、kep和Vp见表1。恶性组病灶(图1)Ktrans、Kep显著高于良性组(P均<0.05),2组Vp差异无统计学意义(P>0.05)。恶性组背景实质(图1)Ktrans、Kep高于良性组(P均<0.05);2组背景实质Vp差异无统计学意义(P>0.05)。
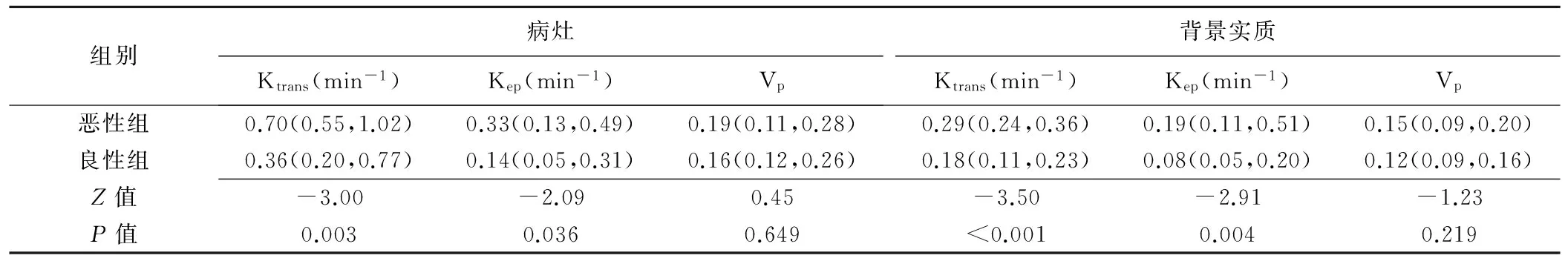
表1 乳腺病灶和背景实质的定量参数比较[中位数(上下四分位数)]

图1 患者女,47岁,右乳内18 mm×16 mm病灶,病理证实为浸润性导管癌Ⅱ级 A.DCE-MRI病灶原图; B.病灶及背景实质的ROI勾画; C. Reference Region模型的伪彩图,病灶Ktrans为1.01 min-1,Kep为0.75 min-1;背景实质Ktrans为0.29 min-1,Kep为0.19 min-1

部位临界值敏感度(%)特异度(%)AUC(95%置信区间)P值 病灶 Ktrans0.36min-110052.380.76(0.61,0.88)<0.001 Kep0.23min-166.6771.430.68(0.53,0.81)0.030 Vp0.1854.1766.670.54(0.39,0.69)0.656 背景实质 Ktrans0.22min-187.5076.190.81(0.66,0.91)<0.001 Kep0.11min-179.1771.430.75(0.60,0.87)0.001 Vp0.1841.6785.710.61(0.45,0.75)0.219 所有参数联合模型0.4095.8371.430.86(0.72,0.95)<0.001
2.2 诊断效能 背景实质Kep与病灶Vp、背景实质Ktrans、与病灶Vp、病灶Ktrans与病灶Vp的AUC比较差异均有统计学意义(Z=2.00、2.37、2.28,P=0.046、0.018、0.023),余两两比较AUC差异均无统计学意义(P均>0.05)。所有参数联合的Logistic回归模型具有最高的AUC(0.86,P<0.001),其敏感度、特异度分别为95.83%、71.43%,见表2和图2。
2.3 腺体特征 恶性组致密型腺体及背景实质显著强化所占比例与良性组比较差异均无统计学意义(P均>0.05),见表3。
3 讨论
DCE-MRI血流动力学模型所获得的定量参数包括:①Ktrans,反映对比剂从血管内到组织间隙的转运速率;②Kep,反映对比剂从血管外组织间隙重新回到血管内的速率;③Vp。定量参数反映对比剂在活体组织细胞中的动态交换过程,可据此评价组织血流灌注及微血管渗透性情况,在乳腺良恶性的诊断中发挥着重要的作用。胡益祺等[12]研究结果显示乳腺癌病灶Ktrans和Kep值明显高于良性病变,病灶Ve值无明显差异;Huang等[13]对乳腺MRI可疑病变的病灶Ktrans值进行研究,发现使用临界值可使病灶Ktrans值较低的病变免于活检,从而降低MR检查的假阳性率。本研究Reference Region模型中,恶性组病灶Ktrans和Kep值分别为0.70 min-1和0.33 min-1,良性组病灶Ktrans和Kep值分别为0.36 min-1和0.14 min-1,差异均有统计学意义(P=0.003、0.036),与既往研究[12]结果相似。由于恶性肿瘤细胞增长迅速,肿瘤生长过快,新生血管增多,血管壁相对薄弱,内皮细胞生长不完整,导致血管壁通透性增高,对比剂交换增多、速度加快,使对比剂从新生血管内扩散到血管外间隙和由血管外间隙重新回到血管内速度均加快,因此病灶Ktrans和Kep值均增大。良性病变由于新生血管较少,血管内皮细胞生长完整,相对缺乏高通透性的血管,对比剂填充缓慢,交换受阻,使病灶Ktrans和Kep值均降低。本研究显示恶性组病灶Vp值与良性组比较差异无统计学意义(P>0.05),与杨晶等[14]的研究结果相似,可能因恶性病变发展过程中Vp的变化较慢,与良性病灶Vp值存在重叠,尚需进一步探讨。

表3 2组患者腺体FGT特征[例(%)]
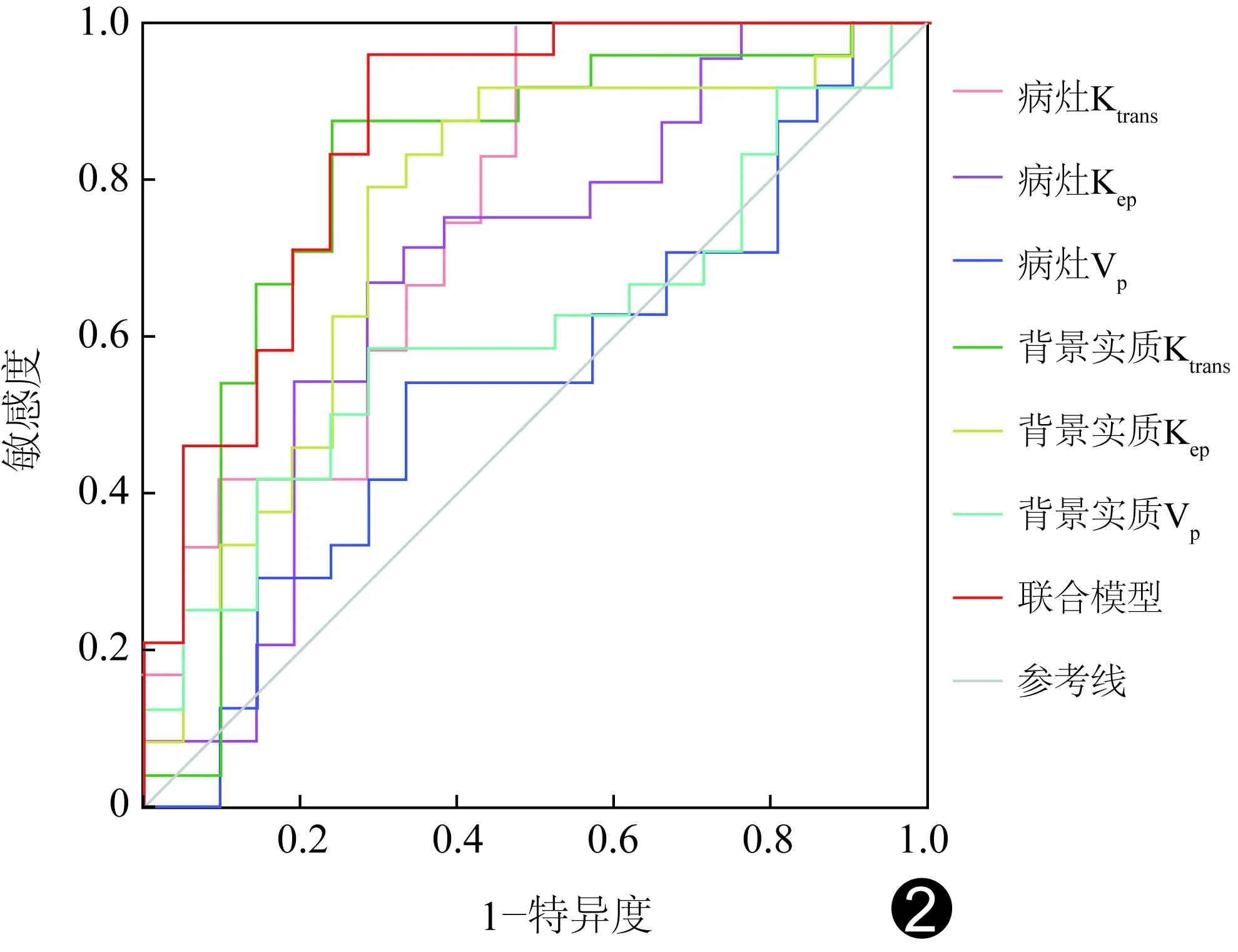
图2 各参数诊断乳腺良恶性病变的ROC曲线
此外,BPE被认为是与乳腺癌风险相关的生物标志物[10],但由于难以选择嵌入周围脂肪组织中的正常纤维腺体,即使在三维 MRI的最高空间分辨率下,量化BPE也较复杂。常规DCE-MRI对BPE的分类为无/几乎无、少量、中等和显著[15]。本研究结果表明恶性组的背景实质Ktrans和Kep高于良性组,且差异有统计学意义,提示背景实质的血管特征可能与乳腺中存在恶性病变有关。肿瘤细胞与微环境的相互作用对癌症的发生和进展至关重要。恶性细胞增殖期间,肿瘤基质发生变化,包括增加血管生成、细胞外基质的重塑以及免疫细胞浸润。
本研究显示恶性组的背景实质Vp与良性组比较差异无统计意义(P>0.05),可能与恶性组较良性组有更多显著BPE、更致密FGT有关。今后需增大样本量进一步评估背景实质Vp与FGT特征的关系。
本组背景实质Ktrans的AUC最高,其敏感度、特异度分别为87.50%、76.19%,提示乳腺背景实质的定量参数可能更有助于鉴别乳腺良性及恶性病变。此外,本研究综合所有参数联合模型诊断乳腺恶性病变的敏感度、特异度分别为95.83%、71.43%,AUC值为0.86(P<0.001),诊断效能明显高于单个参数。
本研究的局限性:月经周期的不同阶段可能导致乳腺的血流变化,从而产生不同的乳腺MRI表现[16],而本研究未对病变中女性月经情况进行探讨。另外,本研究样本量较小,有待于大样本、多中心研究进一步观察。
综上所述,通过分析乳腺良恶性病变发现,病灶Ktrans和Kep、背景实质Ktrans和Kep对鉴别乳腺良恶性病变有一定价值。定量分析DCE-MRI数据有助于鉴别良恶性病变,其背景实质的血流动力学特征有望成为无创诊断乳腺病变的新方法。
[
]
[1] Saslow D, Boetes C, Burke W, et al. American Cancer Society guidelines for breast screening with MRI as an adjunct to mammography. CA Cancer J Clin, 2007,57(2):75-89.
[2] Warner E, Messersmith H, Causer P, et al. Systematic review: Using magnetic resonance imaging to screen women at high risk for breast cancer. Ann Intern Med, 2008,148(9):671-679.
[3] Heller SL, Moy L. Imaging features and management of high-risk lesions on contrast-enhanced dynamic breast MRI. AJR Am J Roentgenol, 2012,198(2):249-255.
[4] Heller SL, Moy L, Lavianlivi S, et al. Differentiation of malignant and benign breast lesions using magnetization transfer imaging and dynamic contrast-enhanced MRI. J Magn Reson Imaging, 2013,37(1):138-145.
[5] Mahoney MC, Gatsonis C, Hanna L, et al. Positive predictive value of BI-RADS MR imaging. Radiology, 2012,264(1):51-58.
[6] Han BK, Schnall MD, Orel SG, et al. Outcome of MRI-guided breast biopsy. AJR Am J Roentgenol, 2008,191(6):1798-1804.
[7] Turnbull LW. Dynamic contrast-enhanced MRI in the diagnosis and management of breast cancer. NMR Biomed, 2009,22(1):28-39.
[8] Huang W, Li X, Morris EA, et al. The magnetic resonance shutter speed discriminates vascular properties of malignant and benign breast tumors in vivo. Proc Natl Acad Sci U S A, 2008,105(1):17943-17948 .
[9] Kim SG, Feng L, Grimm R, et al. Influence of temporal regularization and radial undersampling factor on compressed sensing reconstruction in dynamic contrast enhanced MRI of the breast. J Magn Reson Imaging, 2016,43(1):261-269.
[10] King V, Brooks JD, Bernstein JL, et al. Background parenchymal enhancement at breast MR imaging and breast cancer risk. Radiology, 2011,260(1):50-60.
[11] Morris EA, Comstock C, Lee C, et al. ACR BI-RADS®atlas, breast imaging reporting and data system. Reston: American College of Radiology, 2013:1.
[12] 胡益祺,艾涛,李嫣,等.基于CAIPIRINHA-Dixon-TWIST-VIBE技术动态增强MRI对乳腺病变的定量参数分析.影像诊断与介入放射学,2016,25(2):98-101.
[13] Huang W, Tudorica LA, Li X, et al. Discrimination of benign and malignant breast lesions by using shutter-speed dynamic contrast-enhanced MR imaging. Radiology, 2011,261(2):394-403.
[14] 杨晶,唐桂波,杨国财,等.动态增强MRI鉴别诊断不典型乳腺癌与纤维腺瘤.中国医学影像技术,2016,32(11):1683-1687.
[15] DeMartini WB, Liu F, Peacock S, et al. Background parenchymal enhancement on breast MRI: Impact on diagnostic performance. AJR Am J Roentgenol, 2012,198(4):373-380.
[16] Amarosa AR, McKellop J, Klautau LAP, et al. Evaluation of the kinetic properties of background parenchymal enhancement throughout the phases of the menstrual cycle. Radiology, 2013,268(2):356-365.
