不同处理方法对长柄扁桃种子萌发的影响
2018-04-19赵欢蕊李鲜花
赵欢蕊,李鲜花,刘 娟,田 歌
(榆林学院生命科学学院,陕西榆林 719000)
长柄扁桃(Amygdalus pedunculata)属于蔷薇科扁桃属落叶灌木,又名长梗扁桃,俗称野樱桃、毛樱桃,是我国特有的扁桃属野生种[1],主要分布于我国新疆、河北、陕西、黑龙江、内蒙古等地[2],具有极高的经济价值、生态价值和社会价值。作为木本油料灌木,其含油量高达55%~61%,其中,不饱和脂肪酸含量为94%,另外,还含有丰富的维生素和矿质元素[3-4],具有很强的抗氧化和抗衰老功能。由于长柄扁桃根系发达,萌蘖力强,耐寒耐旱,抗病虫、抗风寒等性能较强,成为荒山造林、防风固沙和退耕还林的先锋树种[5]。
有研究结果表明,长柄扁桃种壳坚硬不易打破休眠,透水性很差,通常水分很难通过未进行处理的种子,存在发芽难、出苗整齐度不理想的问题,一般要采用多种物理或化学方法处理以提高其萌发率[6-8]。张檀等[9]研究发现,长柄扁桃种子萌发对光照没有明显的要求,其种子没有显著的生理休眠,发芽的最佳温度为20~25℃,用H2SO4浸泡种子4 h,可使其发芽率提升为30%,改善种子发芽率最有效的方法是用机械破碎种壳。鲁春艳等[10]研究了植物生长调节剂对长柄扁桃种子萌发及幼苗生长的影响,结果表明,经赤霉素和双氧水浸泡的各个品种种子的发芽率、发芽势、发芽指数和活力指数都较对照组有所提高。
为了进一步探究促进长柄扁桃种子萌发的相关适宜条件,本试验分别采用 KNO3,H2O2,GA3,NAA这4种试剂处理长柄扁桃种子,对其萌发特性进行研究,以期为我国西北荒漠区开展长柄扁桃栽培繁育及群落恢复提供科学依据,从而为生态脆弱区进行系统重建和修复提供一定的理论基础。
1 材料和方法
1.1 试验材料
供试长柄扁桃种子采集于榆林市榆阳区治沙研究所,母树选择生长健壮、树冠圆满的植株,用器具除去种子果肉,清水冲洗干净后,置于室内阴干,备用。
1.2 试验方法
1.2.1 种子处理 采用沉水选择法进行选种。试验前将种子在清水中浸泡2~3 min,每组随机选取大小均匀、颗粒饱满的长柄扁桃种子25粒,经用0.3%的高锰酸钾溶液消毒30 min后,用清水多次冲洗,直至溶液变为无色。然后分别用KNO3,GA3,NAA和H2O2各浸种24h,每种试剂又分别设置4个浓度梯度,分别为:KNO30.05,0.1,0.2,0.4 mol/L;GA3250,500,750,1 000 mg/L;NAA 10,20,50,100 mg/L;H2O20.3%,0.6%,0.9%,1.2%。最后再用清水冲洗,并均用蒸馏水作为对照处理。
1.2.2 种子萌发特性测定 本试验在20~25℃的光照培养箱里进行,每组放置25粒种子,3个重复,采用培养皿沙床法,即在培养皿上铺2 cm的沙子作为发芽床,每个培养皿中放置浸泡24 h的种子,每隔24 h观察并浇水一次,统计种子的发芽数,直至不发芽为止。试验结束后计算不同处理下种子的发芽率、发芽势、活力指数、发芽指数,测量胚根长度和幼苗高度。

其中,n为规定时间内正常发芽的种子数量;N为试验种子总数;m为种子发芽数量最多时正常发芽的种子数量;Gt为在t天发芽的种子数;Dt为相对的发芽天数;Sx为试验结束后种子胚根长度。
1.2.3 种子形态观察 参考刘长江等[11]的描述方法对种子形态进行观察。
2 结果与分析
2.1 不同浓度KNO3处理对长柄扁桃种子萌发的影响
KNO3是应用最广泛的一种促进种子萌发的化学物质,并具有打破休眠,提高种子活力的作用[12]。从表1可以看出,经过KNO3处理的大多数种子均能顺利破壳萌发,随着KNO3浓度的升高,长柄扁桃种子萌发的各项指标均呈现出先增后减的变化趋势,且试验所设置的各项浓度梯度均较对照有明显提高,其中,以0.2 mol/L处理的效果最佳,测定的5项指标数值均明显高于其他处理,说明适宜浓度范围内的KNO3浸种处理可以明显促进长柄扁桃种子的萌发。

表1 不同质量浓度KNO3处理对长柄扁桃种子萌发的影响
2.2 不同质量浓度GA3处理对长柄扁桃种子萌发 的影响

表2 不同质量浓度GA3处理对长柄扁桃种子萌发的影响
赤霉素能打破一些种子的休眠,促进生长素类物质的合成,提高种子内淀粉酶的活性,加快种子的代谢活动,从而提高种子发芽力[13]。本试验对长柄扁桃种子进行了不同质量浓度的GA3处理。由表2可知,随着GA3质量浓度的上升,长柄扁桃种子萌发的各项指标均呈现出先增后降的趋势,且所有处理都比对照组高。试验结果表明,适宜浓度范围内的GA3处理可以促进长柄扁桃种子的萌发,其中以750 mg/L的GA3处理种子效果最佳。
2.3 不同质量浓度NAA处理对长柄扁桃种子萌发的影响
NAA是一种广谱性的植物生长调节剂,对种子萌发有一定影响,但是要先测出最适合的浓度,浓度偏高反而抑制生长[14]。由表3可知,当NAA质量浓度在10~100 mg/L时,发芽指标伴随着质量浓度的上升有明显的增加,仅活力指数和平均苗高的增加不太明显,因此,一定浓度的萘乙酸能够有效地促进长柄扁桃种子的萌发。其中,当NAA为10 mg/L时,种子的发芽率、发芽势显著高于其他处理,虽然其他指标不是处理组最高,但种子的发芽率和发芽势是衡量种子萌发能力的最重要的2个指标[15-16]。所以,综合分析认为,10 mg/L的NAA处理对促进长柄扁桃种子萌发的效果相对较佳。
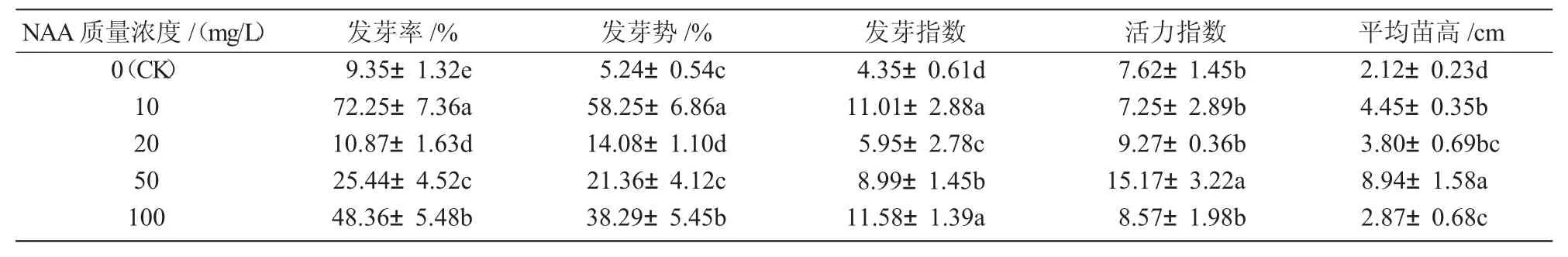
表3 不同质量浓度的NAA处理对长柄扁桃种子萌发的影响
2.4 不同浓度H2O2处理对长柄扁桃种子萌发的影响
用H2O2处理种子,会轻度地腐蚀种壳、种皮,胚轴能尽快突破种孔,进而对胚细胞的分化有促进作用[17-18]。因此,采用H2O2处理长柄扁桃种子,通过轻度腐蚀来提高种子的萌发率。由表4可知,与对照相比,经过H2O2浸泡后提高长柄扁桃种子的萌发效果较为明显。随着H2O2浓度的上升,发芽率和发芽势呈现出先增加后降低的趋势,活力指数和平均苗高均呈现出逐渐下降的趋势。当H2O2浓度达到1.2%时,发芽率、发芽势、活力指数和平均苗高均最低,表明H2O2浓度过大反而会影响长柄扁桃种子的萌发。综合分析表明,0.6%的H2O2处理相较其他处理而言,能促进长柄扁桃种子的萌发。

表4 不同浓度H2O2处理对长柄扁桃种子萌发的影响
3 结论与讨论
长柄扁桃种壳坚硬,木质化的种壳是阻碍长柄扁桃种子萌发的最主要因素,自然情况下发芽率低。由于完整去壳困难,需寻求简单易行的方法打破这道屏障,比如用激素和化学试剂,可以清除种子吸胀与萌发的障碍,促进胚的生长,加快种子的萌发,提高种子的发芽率和幼苗活力[19]。用机械破碎种壳可以显著地提高发芽势和发芽率,也可用浓硫酸预处理使得药剂相对容易透过坚硬的种皮以达到理想的效果[20-22]。本试验在温度、湿度等与外界环境一致的条件下,用不同浓度的KNO3,GA3,NAA,H2O2这4种化学试剂和激素处理长柄扁桃的种子,记录种子发芽情况,观察其对种子萌发的影响和种子的各项生理指标变化,结果表明,各试剂在合适的浓度范围均能够促进长柄扁桃种子的萌发,其萌发状况显著好于对照,表明4种试剂对消除种壳障碍有一定效果。
选用不同试剂处理种子,将会影响种子的渗透势及种子萌发过程中体内各种酶的活性,从而影响种子的萌发率,还会影响种子的最大吸水量及吸水速率,进而影响种子的萌发速率[23]。本试验结果显示,采用同一种试剂不同浓度处理长柄扁桃种子,其萌发效果存在明显差异,试验所采用的KNO3,GA3,NAA和H2O2的适宜浓度分别为0.2 mol/L,750 mg/L以及10 mg/L,0.6%。另外,不同试剂之间其处理效果也存在一定差异,在上述4种试剂中,经0.2 mol/L KNO3处理的长柄扁桃种子萌发效果最好,且KNO3这种试剂便宜易取,经济方便,因此,利用KNO3进行处理最为理想,但是只有适宜的KNO3浓度处理才能达到最理想的效果,这与周柱峰等[24]的研究结果一致。鲁春艳等[10]研究表明,GA3和H2O2处理的长柄扁桃种子,其萌芽率和发芽指数都明显高于同一品种对照组,且GA3处理的种子幼苗生长最好,H2O2处理的种子,幼苗根系和茎生长均呈细长型,幼苗生长较弱,这与本试验结果基本吻合。
另外,沙床含水量也可影响种子的萌发,沙子含水量过低或过高都会抑制种子的萌发。因此,试验中沙床含水量必须控制在一定范围内,否则影响种子的正常萌发,但沙床的最佳含水量还有待进一步的探索。
参考文献:
[1]姬钟亮,钱安东.长柄扁桃和蒙古扁桃在我国自然分布区的调查[J].中国果树,1981(2):38-39.
[2]温阳,吴喜发,王晶莹,等.几个乡土树种生物学生态学特性及育苗技术研究[J].内蒙古林业科技,2003,(3):30-34.
[3]郭春会,梅立新,张檀,等.扁桃的园艺技术[M].北京:中国标准出版社,2001:33-36.
[4]王燕,魏蔚,董发昕,等.长柄扁桃仁的营养成分分析[J].西北大学学报,2009,39(1):59-62.
[5]罗梦,郭春会,马小卫.水分胁迫对长柄扁桃叶片含水量及保护酶活性的影响[J].干旱地区农业研究,2006,24(6):103-106.
[6]张艳,袁涛.野生草本花卉种子萌发特性研究进展[J].中国农学通报,2017,33(3):67-73.
[7]陈小娜,邱黛玉,李燕君,等.温度和水分对甘草种子萌发的影响[J].中国农学通报,2015,31(34):158-162.
[8]姚艳蓉,吕俊平,刘琪,等.苯酚对红蓼种子萌发的影响[J].山西农业科学,2018,46(2):199-202.
[9]张檀,郑瑞杰,梅立新,等.长柄扁桃种子萌发特性的研究[J].西北林学院学报,2006,21(4):73-76.
[10]鲁春艳,井赵斌,冯喜兵,等.植物生长调节剂对长柄扁桃种子萌发及幼苗生长的影响 [J].西北林学院学报,2015,30(5):118-125.
[11]刘长江,林祁,贺建秀.中国植物种子形态学研究方法和术语[J].西北植物学报,2004,24(1):178-188.
[12]张菊平,张艳敏,康业斌,等.硝酸钾处理对不同贮藏年限辣椒种子发芽的影响[J].种子,2005,24(4):28-30.
[13]傅家瑞.种子生理[M].北京:科学出版社,1985:71-74.
[14]吕剑,喻景权.植物生长素的作用机制 [J].植物生理学通讯,2004,40(5):624-628.
[15]刘根喜,陈亮,崔芬芬,等.温度与光照对党参种子发芽的影响[J].山西农业科学,2018,46(2):193-195.
[16]孟祥浩,林琪,张玉梅,等.盐胁迫对小麦萌发的影响及耐盐指标的筛选[J].华北农学报,2014,29(4):175-180.
[17]郑光华.使用种子生理学[M].北京:农业出版社,1990:18-63.
[18]JIANG J L,SU M,WANG L Y,et al.Exogenous hydrogen peroxide reversibly inhibits root gravitropism and induces horizontal curvature of primary root during grass pea germination[J].Plant Physiologyand Biochemistry,2012,53:84-93.
[19]邹冬梅,蒋昌顺.我国热带牧草育种的现状与前景[J].中国草地,2002(5):65-68.
[20]侯江涛,克热木·伊力,高启明,等.不同处理对扁桃种子发芽率及幼苗生长的影响[J].种子,2005,24(12):4-5,9.
[21]斯琴巴特尔,满良.蒙古扁桃种子萌发生理研究[J].广西植物,2002,22(6):564-566.
[22]杨锋利,汪茜,杜保国.温度和不同激素及其浓度和浸种时间对美人蕉种子萌发的影响 [J].中国农学通报,2015,31(13):126-129.
[23]颜启传.种子学[M].北京:中国农业出版社,2001:91-93.
[24]周柱峰,龚佳梦,王艳红,等.KNO3处理对毛乌素沙地4物种种子萌发特性的影响[J].种子,2014,33(9):19-22.
