农杆菌介导的玉米自交系Z21遗传转化体系的研究
2018-04-19李韩帅周秒依杨凤玲白琪林
李韩帅,周秒依 ,杨凤玲,李 婷 ,白琪林 ,刘 亚
(1.山西大学生物工程学院,山西太原 030006;2.山西省农业科学院作物科学研究所,山西太原 030031;3.北京市农林科学院玉米研究中心,北京 100097)
玉米作为世界上重要的粮食作物和工业原料之一,在解决粮食安全和资源短缺问题,以及促进国民经济发展等方面意义重大。FAO统计结果显示,玉米产量自2001年以来正式超过水稻和小麦,成为世界上产量最大的作物[1]。自新中国成立以来,常规育种在玉米遗传改良中发挥了重要作用,使得玉米产量至少增加了2倍[2]。随着分子生物学的日渐成熟,转基因技术已经逐渐成为玉米品种改良的重要手段。1987年,GRIMSLEY等[3]选择农杆菌介导转化法,成功地用玉米条斑病毒的cDNA感染了玉米植株,首次证明农杆菌侵染玉米的可行性;1988年RHODES等[4]首次用基因枪法获得转基因玉米完整植株;1996年ISHIDA等[5]用含超双元载体的农杆菌转化自交系的幼胚,成功获得转基因玉米植株,初步建立农杆菌遗传转化体系,在此转化体系下,玉米的转化率能够达到5%~30%,这是农杆菌转化玉米的一个重要突破。转基因玉米遗传转化研究已进入飞速发展时期。
目前,玉米遗传转化的方法有很多,包括基因枪法、农杆菌介导转化法、花粉管通道法、PEG介导法、电激法和子房注射法等[6]。由于农杆菌介导转化法具有研究机理相对清楚、外源基因能够稳定表达和遗传、转基因后代拷贝数少,且遗传稳定性好、成本低且操作简单等优势[7],目前该方法已在全世界范围内广泛应用。农杆菌介导玉米遗传转化的主要过程包括:农杆菌侵染吸附受体幼胚、农杆菌体内Vir基因激活及T-DNA复合物的产生、T-DNA复合物整合进入植物细胞核的基因组中并表达外源基因[8-9]。影响农杆菌介导转化的因素包括外植体的类型、幼胚的大小、农杆菌浓度、侵染时间、共培养时间以及抗生素和筛选剂等,都是研究的热点。其中,愈伤组织诱导和再生主要取决于玉米的基因型[10-11]。通过对离体幼胚的多年研究发现,不同基因型的玉米幼胚抵抗农杆菌侵染的能力差异很大,这直接影响到玉米的转化效率,而且绝大部分基因型的玉米转化效率都不高。SCHALAPPI等[12]深入研究农杆菌对玉米幼胚的亲和性时发现,感受态细胞是整个农杆菌转化过程中不可或缺的。相比较而言,再生和整合能力强的感受态细胞更容易得到转化植株。目前,玉米材料A188和HiⅡ取得了不错的效果,但农艺性状较差。
在前期材料筛选的基础上,本研究选择其中遗传转化效率较高的材料Z21,针对遗传转化各个环节的影响条件进行进一步的优化和完善,初步建立高效稳定的遗传转化系统,获得转基因材料,旨在为加快转基因育种进程打下坚实的基础。
1 材料和方法
1.1 材料
1.1.1 供试作物材料 试验所用幼胚取自大田种植的玉米材料Z21,根据气温变化情况,选取授粉后8~10 d、幼胚大小为0.5~2.0 mm的玉米幼穗。
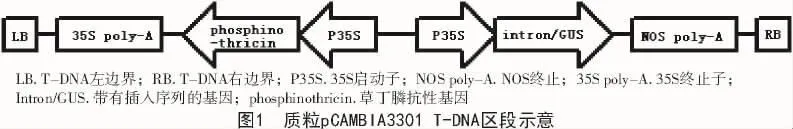
1.1.2 菌株和质粒 菌株选用农杆菌EHA105,质粒为pCAMBIA3301,携带GUS基因(图1)。
1.1.3 培养基及成分 培养基及其成分列于表1。

表1 培养基及溶液组分
1.2 方法
1.2.1 活化菌株 从-20℃冰箱取出保存在甘油中的农杆菌菌种,置于冰块上,待甘油解冻,将接种环经酒精灯灼烧片刻后蘸取菌液,在相应抗性YEP固体培养基上划线,密封置于28℃培养箱中暗培养2 d。2 d后YEP固体培养基上会出现稀疏不同的菌落,选择菌落稀少且不重叠的的区域挑取单菌落,接种于50 mL含抗生素(50 μL)的YEP液体培养基中,28℃条件下200 r/min振荡培养16~20 h。第2天将摇好的菌液离心后去上清,用Inf侵染培养基悬浮农杆菌并调节其 OD600为 0.3,0.5,0.7,0.9,1.0,1.2,1.5 和 2.0。
1.2.2 幼胚遗传转化 取授粉10 d左右、幼胚大小为0.5~2.0 mm的玉米幼穗,除去苞叶,切除果穗顶端和基部1~2 cm,在次氯酸钠溶液中加入0.1%Tween 20后浸泡幼穗,消毒灭菌20 min,每隔5 min左右上下搅动几次,以消除籽粒表面的气泡,从而达到最佳的消毒效果。消毒结束后用无菌水冲洗幼穗籽粒表面,在超净工作台内进行剥胚操作,将所得幼胚置于含有1 mL Inf侵染培养液的1.5 mL EP管中待用。
用 OD600为 0.3,0.5,0.7,0.9,1.0,1.2,1.5 和 2.0的菌液分别侵染待用的幼胚,20℃条件下各自侵染15 min。
1.2.3 共培养 利用带细枪头的移液枪吸除农杆菌悬浮液,将幼胚均匀转移至Coc共培养基中,幼胚盾面朝上放置,间隔1 cm,随后将Coc培养基放置于培养箱中,24 ℃分别暗培养 1,2,3,4,5 d。
1.2.4 GUS染色鉴定 分别将共培养1~5 d后的部分幼胚用无菌水清洗干净,放入含有1 mL GUS染色液的EP管中,置于37℃培养箱24 h。通过肉眼或者显微镜观察统计带有蓝斑的幼胚数量,计算GUS染色瞬时表达率。
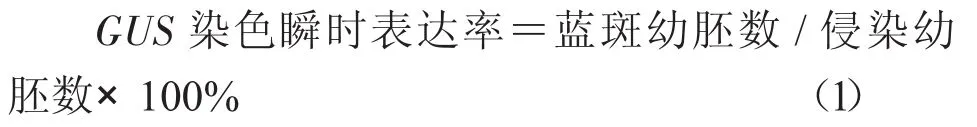
1.2.5 静息培养 将共培养后的另一部分幼胚洗菌并用滤纸将幼胚周围水分吸干,转移到Res静息培养基上面,同时用封口膜封住培养皿,28℃条件下暗培养4 d。
1.2.6 选择阶段 静息培养后,将幼胚转移至选择Ⅰ培养基上,大约间隔1.5 cm。培养皿放置于培养箱中28℃暗培养14 d,直至长出1~2 cm的Ⅱ型愈伤组织。统计数量计算Z21的Ⅱ型愈伤率。
将存活且松散的Ⅱ型愈伤组织块平铺至选择Ⅱ培养基上,简单分离每个愈伤组织块,使其仍能保持完整性。随后将培养皿放置于培养箱的塑料盒中28℃暗培养14 d。再次统计数量计算Z21的Ⅱ型愈伤率。
每隔20 d将新长出的阳性愈伤继代选择培养一次。
1.2.7 再生阶段 把选择出来的Ⅱ型愈伤组织平铺到再生Ⅰ培养基上,每个培养基上4个愈伤组织块,26℃暗培养,直至长出不透明的体细胞胚或不定芽。将体细胞胚或者不定芽转移到再生Ⅱ培养基上,每个培养皿中只放置1个,26℃条件下按16h∶8 h光周期进行光照培养,直至长出约4 cm的绿芽。把绿芽转到RⅢ生根培养瓶中,继续26℃条件下按16 h∶8 h光周期进行光照培养,待长出明显的根芽为止。
1.2.8 幼苗的生长 将长出根芽的幼苗接到壮苗培养基(长试管)中,26℃条件下按16 h∶8 h光周期培养7~14 d。
1.2.9 转化植株的检测 取部分叶片,设计PCR检测引物(F:GAAGGCACGCAACGCCTACGA;R:CCAGAAACCCACGTCATGCCA),用PCR等分子检测手段检测bar基因,通过bar基因的表达情况来验证目的基因是否被成功导入玉米植株中,记录阳性植株。等植株长至试管口处时,轻轻移出,室温下冲洗掉附着在根部的残余培养基,将植株完整转移到含营养土的育苗纸盆中。取少量叶片,加入缓冲液后研磨,用试纸条进行转基因检测,进一步验证所得的阳性植株。
2 结果与分析
2.1 幼胚大小对遗传转化的影响
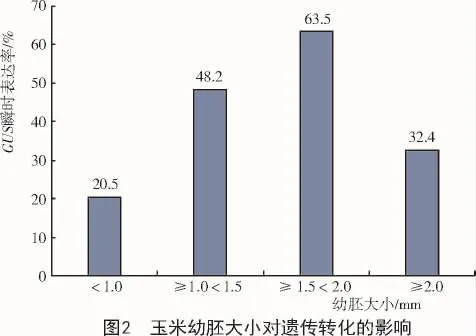
由图2可知,Z21在幼胚大小为1.5~2.0 mm时GUS瞬时表达率达到最大值,为63.5%,明显高于其他3种幼胚。当换用不同浓度的菌液侵染幼胚时,≥1.5<2.0 mm的幼胚的GUS瞬时表达率均处于最大值,且更易形成愈伤组织。通过对比发现,在农杆菌浓度逐渐增大的情况下,<1 mm的幼胚率先大面积染菌,生长停滞甚至褐化死亡,即使存活下来的幼胚也很难形成愈伤组织;而≥2.0 mm的幼胚很容易直接萌发,其愈伤组织的诱导率随着幼胚的长大逐渐降低,不利于转基因幼苗的长成。
2.2 农杆菌浓度对遗传转化的影响
用 OD600分 别 为 0.3,0.5,0.7,0.9,1.0,1.2,1.5和2.0的农杆菌菌液侵染大小为1.5~2.0 mm的Z21幼胚15 min,24℃培养箱中共培养3 d后进行GUS染色,统计染色数量,结果如图3所示。
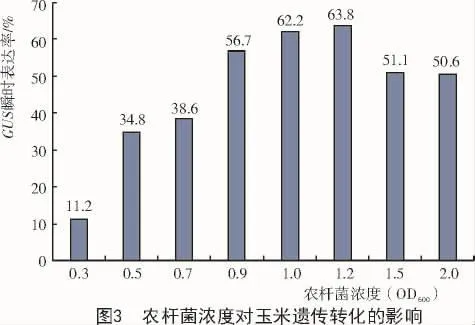
由图3可知,Z21的GUS瞬时表达率随农杆菌浓度的增大呈先升后降的变化趋势,其中,在OD600为0.9~1.2的范围内,Z21的GUS瞬时表达率达到峰值,且3个浓度间的瞬时表达率相差很小;虽然在OD600为1.5和2.0时也获得了较高的GUS瞬时表达率,但在后续的多次筛选过程中,大量的Z21幼胚染菌死亡。说明高浓度的农杆菌对幼胚伤害很大,且容易直接影响后期愈伤的生成。综合各种因素考虑,最终选取OD600=0.9~1.2为农杆菌最适浓度。
2.3 共培养时间对遗传转化的影响
用OD600为0.9的农杆菌菌液侵染1.5~2.0 mm的幼胚15 min,放置24℃培养箱分别培养1~5 d,进行GUS染色检验,结果如图4所示。
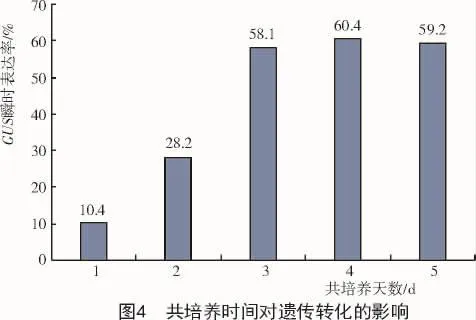
从图4可以看出,当共培养1 d时,Z21的GUS瞬时表达率很低,随着共培养天数的增加,相应的GUS瞬时表达率也随之增加;当共培养3 d后,GUS瞬时表达率不再出现显著的变化。共培养时间的长短能够直接影响农杆菌对幼胚的吸附能力以及T-DNA的转移情况。时间过短会导致吸附的农杆菌量少,T-DNA转移过程不能全部完成;而时间过长也不利于农杆菌的有效控制,容易出现幼胚褐化和水渍化等问题,影响愈伤组织的生成和分化,从而不能再生出完整植株。综合来看,共培养3 d是农杆菌遗传转化的最佳选择。
2.4 培养基成分对遗传转化的影响
2.4.1 基础盐对转化效率的影响 影响玉米幼胚愈伤组织诱导的因素很多,其中,培养基的合理选择是组织培养过程成功的必要条件。本试验分别选用了MS盐和N6盐培养基,最终均稳定并成功地培育出了所要的转基因幼苗,且长势良好。而N6盐诱导产生的愈伤组织分化再生过程相对较快,更符合试验需求。所以,在接下来的试验中均选用N6盐培养基。
2.4.2 抗生素对转化效率的影响 抗生素是由微生物(包括细菌、真菌、放线菌属)或高等动植物在生活过程中所产生的具有抗病原体或其他活性的一类次级代谢产物,能干扰其他生活细胞发育功能的化学物质。本试验在组织培养过程中选择培养基和再生培养基中加入100 mg/L的特美汀,能够在一定程度上抑制残余农杆菌对幼胚和愈伤组织的伤害,提高Ⅱ型愈伤率。
“育人”主要反映教师的管理工作尤其是学生管理工作取得的业绩。有关评价要素包括:管理工作年限;在师德和管理方面获得的表彰;育人管理方面的研究成果;指导学生取得的成绩。其中,除了“管理工作年限”的认可度为中等外,其他评价要素的认可度均为高。
2.5 抗性愈伤组织的获得率
根据研究转化效率的影响因素,选择幼胚大小1.5~2.0 mm,农杆菌菌液OD600处于0.9~1.2,20℃侵染15 min,共培养3 d,选择抗生素特美汀为优化转化条件进行玉米Z21的遗传转化,结果表明,在第1次选择培养阶段(SⅠ),共有745个愈伤,符合要求的抗性愈伤431个,抗性愈伤率达57.8%;在第2次选择培养阶段(SⅡ),获得145个抗性愈伤组织,抗性愈伤获得率为19.5%。
2.6 转基因植株检测
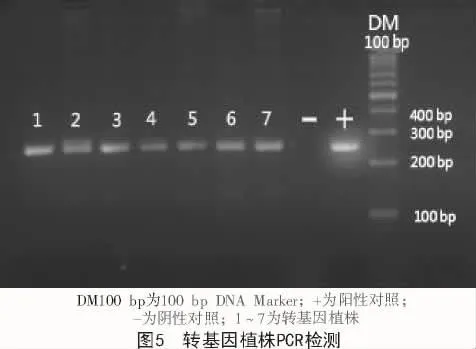
对再生出来的玉米植株提取植株叶片DNA,PCR检测bar基因,结果如图5所示,阳性对照出现明亮的条带,阴性对照无条带,1~7号符合预期的检测结果。且在后续的试纸条检测中,1~7号均出现了明显的检测线,可以初步判定,1~7号为转基因植株。
3 结论与讨论
3.1 讨论
整个试验中还存在一些缺陷,例如在试管中培养的组培苗转移到育苗盆后,长势很弱,幼苗容易断根枯死,其成活率显著下降。所以,在玉米苗期需要加强对幼苗的监管,保证充足的水分、养分和光照供给。
3.1.1 培养基成分对诱导愈伤组织的影响 目前,玉米组织培养体系中按照培养基所含成分不同大体划分为N6,MS和B5培养基。ISHIDA等[18]成功地选用MS培养基培养出转基因植株;李世润等[19]研究认为,相较N6而言,MS更容易作用在胚性愈伤组织的诱导和分化方面;王宏伟等研究发现,用MS培养基培育出的愈伤组织质量相对优于N6培育出的愈伤组织。但是也有研究表明,在组织诱导过程中MS盐容易产生Ⅰ型愈伤组织,N6盐更利于产生Ⅱ型愈伤组织[20-21],而Ⅱ型愈伤组织结构松脆,生长旺盛,色泽鲜艳且增殖很快,符合优良标准的愈伤组织。
3.1.2 残余农杆菌对幼胚的伤害及影响 在农杆菌介导的遗传转化中,共培养后在幼胚的表面和浅层组织中会残留大量的农杆菌,可能会对幼胚产生额外的伤害,褐化、水渍化甚至死亡,严重影响组织培养的过程,所以需要选择合适的抗生素来抑制农杆菌的生长。目前,使用较多的是头孢菌素类和青霉素类,但不同的材料和组织对抗生素的敏感程度不同。本试验选用的特美汀虽然在一定程度上取得了很好的抑菌效果,但部分幼胚仍会出现染菌死亡的情况,较大程度地降低了遗传转化率。
3.2 结论
本研究通过对玉米材料Z21的幼胚进行农杆菌介导转化,在幼胚大小、菌液浓度、侵染时间、共培养时间以及抗生素等方面进行深入地探索,初步建立了适用于Z21的农杆菌介导转化体系。以GUS染色瞬时表达率为依据,对影响农杆菌介导的主要因素采取控制单一变量的方法,不断改变变量的大小进行试验对比探究。本试验研究表明,在幼胚大小为1.5~2.0 mm,农杆菌菌液OD600处于0.9~1.2,20℃侵染15 min,共培养3 d,选择合适的抗生素(特美汀)等条件下,Z21的GUS染色瞬时表达率均达到最高值,且在后续的组织培养过程中,愈伤组织的形成和再分化表现良好,能够稳定地长出转基因幼苗,证明此遗传转化系适用于玉米自交系Z21,符合实际需要。通过该体系可以将抗虫、抗除草剂、抗旱等有益外源基因导入玉米自交系,丰富转基因种质资源。
参考文献:
[1]FAQ.Topproduction-world(total)-2010[EB/OL].[2013-04-10].http://faostat.fao.org/site/339/default.aspx.
[2]戴景瑞,鄂立柱.我国玉米育种科技创新问题的几点思考[J].玉米科学,2010,18(1):1-5.
[3]GRIMSLEYNH,HOHNT,DAVIESJ W,et al.Agrobacterium mediated delivery of infectious maize streak virus into maize plant[J].Nature,1997,325:177-179.
[4] RHODES C A,PIERCE D A,METTLER I J,et al.Genetically transformed maize plants from protoplasts[J].Science,1988,240:204-207.
[5]ISHIDA Y,SAITO H,OHTA S,et al.High efficiency transformation ofmaize(Zea mays L.)mediated byAgrobacterium tumefaciens[J].Nature Biotechnology,1996,14(6):745.
[6]张兆熙.转基因技术的研究综述及利弊关系[J].科技创业月刊,2006(11):111-112.
[7]李新征,郑成超,温孚江.农杆菌介导的玉米遗传转化研究进展[J].生物工程进展,2000,20(6):19-21.
[8]TZFITAT,CITOVSKYV.Fromhost recognition toT-DNAintegration:the function of bacterial and plant genes in the Agrobacterium plant cell interaction[J].Molecular Plant Pathology,2000,1(4):201-212.
[9]ZUPAN J,MUTH T R,DRAPER O,et al.The transfer of DNA from Agrobacterium tumefaciens into plants:a feast of fundamental insights[J].The Plant Journal,2000,23(1):11-28.
[10] AHLOOWALIA B S.Plant regeneration from callus culture of wheat[J].Crop Sci,1982,22:405-410.
[11] SPENCER T M,GORDON-KAMM W J,DAINES R J,et al.Bialaphos selection of stable transformants from maize cell culture[J].Theoretical&Applied Genetics,1990,79(5):625-631.
[12]SCHLÄPPI M,HOHN B.Competence of immature maize embryos for Agrobacterium-mediated gene transfer[J].Plant Cell,1992,4(1):7.
[13]张艳贞,王罡,胡汉桥,等.农杆菌介导将Bt杀虫蛋白基因导入优良玉米自交系的研究[J].遗传,2002,24(1):35-39.
[14]李慧芬,何锶洁,王兴智,等.玉米优良自交系愈伤组织基因枪转化的研究[J].遗传学报,1999(4):397-402.
[15]刘纪华,施介村.青饲玉米有益突变体筛选的研究[J].植物生态学报(英文版),1996(10):839-842.
[16]KAMO K K,BECWAR M R,HODGES T K.Regeneration of Zea mays L.from embryogenic callus[J].Botanical Gazette,1985,146(3):327-334.
[17]ESCUDEROJ,NEUHAUS G,SCHLÄPPI M,et al.T DNA transfer in meristematic cells ofmaize provided with intracellular Agrobacterium[J].Plant Journal,1996,10(2):355-360.
[18] ZHAO Z Y,CAI T,TAGLIANI L,et al.Agrobacterium-mediated sorghum transformation[J].Plant Molecular Biology,2000,44(6):789-798.
[19]李世润,张举仁,陈惠民.玉米胚性愈伤组织诱导和植株再生的研究 [J].山东大学学报 (自然科学版),1990,25(1):116-121.
[20]ARMSTRONG C L,GREEN C E.Establishment and maintenance of friable,embryogenic maize callus and the involvement of L-proline[J].Planta,1985,164(2):207-214.
[21] ELKONIN L A,PAKHOMOVA N V.Influence of nitrogen and phosphorus on induction embryogenic callus of sorghum[J].Plant Cell Tissue&Organ Culture,2000,61(2):115-123.
