黄芪甲苷对被动型Heymann肾炎大鼠PERK通路的影响
2018-04-19项协隆邵思思陈宇陈春董飞侠
项协隆 ,邵思思 ,陈宇 ,陈春 ,董飞侠
1.浙江中医药大学附属温州中医院肾内科,浙江 温州 325000;2.温州老年病医院,浙江 温州 325000
膜性肾病(Membranous nephropathy,MN)是成人肾病综合征的主要病理类型之一,在我国约占原发性肾病综合征的20%,近年来发病率逐渐升高[1]。足细胞损伤是MN发病的关键,而内质网应激(endoplasmic recticulum stress,ERS)是足细胞发生凋亡的最重要机制之一。黄芪具有益气健脾、补中、利尿等功效,是治疗MN的常用中药,其重要成分黄芪甲苷(astragalosideⅣ)具有调节机体免疫力、保护组织器官、降低血糖、抗细胞凋亡和抗炎抗病毒等多方面作用[2],体外实验亦证实黄芪甲苷对补体膜攻击复合物诱导的足细胞损伤有保护作用[3],但对MN的具体作用机制尚不清楚。本研究通过观察黄芪甲苷对被动型海曼(Heymann)肾炎大鼠葡萄糖调节蛋白78(glucose regulated protein 78,GRP78)、磷酸化蛋白激酶R样内质网激酶(phosphorylated protein kinase R-like ER kinase,p-PERK)、磷酸化真核细胞翻译起始因子2α(phosphorylated eukaryotic initiation factor 2 alpha,peIF2α)等内质网应激相关因子表达的影响,进一步明确黄芪甲苷对被动型Heymann肾炎的保护作用机制。
1 材料与方法
1.1 实验动物 雄性SPF级SD大鼠40只,体质量170~200 g,购自上海斯莱克实验动物有限责任公司,许可证号:SCXK(沪)2012-0002,合格证编号:2015000535634,于温州医科大学实验动物中心SPF级实验室饲养,保持(50±5)%相对湿度,25℃恒温,人工光照,明暗各12 h,自由饮食饮水。
1.2 药物与试剂 盐酸贝那普利片(北京诺华制药有限公司,批号:X2445),黄芪甲苷(纯度98%,成都锦泰和医药化学技术有限公司,批号:160802)。羊抗大鼠Fx1A抗体血清(Probetex inc.,批号:169-06G), p-PERK 抗 体(Santa, 货 号 : sc32577),p-eIF2α抗体(Santa,货号:sc101670),GRP78抗体(Santa,货号:sc376768),GAPDH抗体(联科生,货号:MAB5465),兔二步法检测试剂盒(北京中杉金桥生物技术有限公司,货号:PV-6001),DAB显色试剂盒(北京中杉金桥生物技术有限公司),BCA蛋白浓度测定试剂盒(碧云天公司),ECL Plus发光试剂盒(碧云天公司)。
1.3 主要仪器 高速台式冷冻离心机(TGL-16M,湖南湘仪实验仪器开发有限公司),显微镜(BX43型,OLYMPUS公司),隔水式恒温培养箱(PYXDHS500BS-Ⅱ型,上海跃进医疗器械有限公司),酶标仪(SPECTRA max Plus 384,Molecular Devices公司),电泳仪(Mini-Proten Tetra System,Bio-RAD公司),凝胶成像仪(ChemiDoc XRS+System,Bio-RAD公司)。
1.4 模型制备及分组给药 40只雄性SD大鼠适应性饲养1周后开始试验,期间人工光照,明暗各12 h,自由饮水进食。将大鼠随机分为5组,分别为正常对照组、模型组、黄芪甲苷低剂量组、黄芪甲苷高剂量组以及贝那普利组,每组8只。除正常对照组外,其他各组大鼠均尾静脉注射羊抗大鼠Fx1A抗体血清,剂量为6 mL/kg,正常对照组尾静脉注射等量生理盐水。1周后使用代谢笼收集大鼠尿液检测24 h尿蛋白定量,除正常对照组外,其他各组大鼠24 h尿蛋白定量均大于20 mg,用于后续试验。黄芪甲苷低、高剂量组分别按5、10 mg/(kg·d)灌胃给药,贝那普利组按10 mg/(kg·d)予盐酸贝那普利灌胃,正常对照组和模型组给予等量生理盐水灌胃。所有大鼠连续灌胃4周,每周测体质量1次并调整给药量,至实验结束。
1.6 生化指标检测 24 h尿蛋白定量及血清白蛋白采用全自动生化分析仪检测。
1.7 肾组织病理观察及免疫组织化学检查 取大鼠肾组织按常规方法制作石蜡切片,行PASM染色后光镜观察肾小球基底膜、系膜细胞及系膜基质等。免疫组化检查采用3 μm石蜡切片,常规脱蜡水化,柠檬酸盐缓冲液中高压煮沸抗原修复,3%H2O2室温孵育20 min,滴加山羊血清封闭液封闭30 min,分别滴加p-PERK 抗体(1∶50),p-eIF2α 抗体(1∶50),4℃过夜。滴加聚合辣根过氧化物酶标记的二抗,37℃孵育30 min,二氨基联苯胺显色,蒸馏水洗涤,苏木素轻度复染,脱水、透明、封片。光学显微镜下观察,400倍视野下,每张切片随机取5个非重叠视野拍照;Image Pro Plus 6.0软件分析每张照片中阳性染色面积的平均积分吸光度值,取其平均值进行分析。
1.8 Western Blot法检测大鼠肾脏GRP78蛋白的表达 取80 mg肾组织剪碎后加入1 mL组织裂解液,在冰上匀浆后,4℃离心机11 000 rpm离心10 min后取上清液。用BCA试剂盒进行蛋白浓度测定。配置分离胶及浓缩胶,以60 μg上样,电泳并转膜。5%脱脂牛奶室温封闭1 h后,一抗GRP78抗体(1∶500),4℃孵育过夜,辣根过氧化物酶标记的二抗室温孵育1 h后ECL荧光显色。用GAPDH作为内参检测GRP78蛋白条带扫描灰度变化。
1.9 统计学方法 实验数据采用SPSS13.0统计软件进行分析,计量资料以(±s)表示,多组间均数比较采用单因素方差分析,两两比较采用SNK-q检验。
2 结果
2.1 各组大鼠一般情况 正常对照组大鼠精神状态良好,皮毛光泽,反应灵敏,进食正常,无皮下水肿。其他组大鼠在注射羊抗大鼠Fx1A抗体血清后即刻出现精神状态萎靡,反应迟钝,进食明显减少,在注射第2、3天后缓慢恢复。模型组及黄芪甲苷低剂量组大鼠出现皮毛暗淡及皮下水肿;而黄芪甲苷高剂量组以及贝那普利组大鼠介于正常对照组和模型组之间。
2.2 各组大鼠24 h尿蛋白定量及血清白蛋白比较见表1。模型组大鼠24 h尿蛋白定量较正常对照组显著升高(P<0.05),并随着时间推移蛋白尿逐渐增多,至4周后达到高峰。在给药4周后,与正常对照组比较,模型组大鼠血清白蛋白明显降低(P<0.05)。与模型组比较,黄芪甲苷高剂量组及贝那普利组大鼠24 h尿蛋白显著减少,血清白蛋白显著升高,差异均有统计学意义(P<0.05)。
表1 各组大鼠24 h尿蛋白定量及血清白蛋白比较(±s)

表1 各组大鼠24 h尿蛋白定量及血清白蛋白比较(±s)
与正常对照组比较,①P<0.05;与模型组比较,②P<0.05
组 别2 4 h尿蛋白定量(m g/2 4 h)血清白蛋白(g/L)正常对照组模型组黄芪甲苷低剂量组黄芪甲苷高剂量组贝那普利组n 8 8 8 8 8给药1 w 1 4.9 7±3.3 7 6 4.4 0±1 0.0 2①6 2.4 9±8.5 8 6 8.9 2±7.1 8 6 5.7 4±6.6 1给药2 w 1 8.7 7±4.9 4 1 0 0.5 4±1 1.2 4①9 5.3 2±8.9 7 9 2.3 6±8.4 7 8 9.5 1±7.5 6给药4 w 1 7.0 2±1.2 6 1 2 0.1 6±1 7.4 7①1 1 0.1 7±1 8.5 9 8 5.9 4±9.7 3②8 0.0 2±8.3 1②4 8.6 0±7.3 5 3 3.1 0±2.6 9①3 4.9 7±2.1 4 4 0.9 3±3.8 8②4 1.4 5±4.1 2②
2.3 各组大鼠肾组织PASM染色结果比较 见图1。PASM染色光镜下观察显示,正常对照组大鼠肾小球结构基本正常,肾小球基底膜无增厚,不伴有系膜增生。模型组及黄芪甲苷低剂量组大鼠肾小球基底膜僵硬增厚,伴有系膜增生。与模型组比较,黄芪甲苷高剂量组与贝那普利组大鼠病理改变明显减轻。
施工所需的原料一旦进入施工场地就需要展开检查工作。如原料形状和尺寸,及基本性能,如果原料有特殊要求还必须查看相关原料的质量证明文书,文件上要有生产日期等等。进到施工现场的原料还需要进行复检,在第一次复检不过关的情况下需要根据原料检测相关规定进行再次复检。另外检测工作还需要监理人员到现场参与监督工作,要求取两分样品进行检测工作,只有检测合格才能进入施工现场和投入到施工中。如果施工原料在进行质量检测时发现完全不符使用规格就需要对原料进行处理,并通知监督工作人员到现场进行处理。

图1 各组大鼠肾组织PASM染色病理结果 (×400)
2.4 各组大鼠肾组织p-PERK及p-eIF2α表达比较见表 2、图 2。正常对照组大鼠可见 p-PERK、p-eIF2α在肾小球及肾小管少量表达。与正常对照组比较,模型组大鼠肾小管及肾小球p-PERK、p-eIF2α表达显著升高,差异均有统计学意义(P<0.05);与模型组比较,黄芪甲苷高剂量组及贝那普利组大鼠p-PERK、p-eIF2α表达显著降低,差异均有统计学意义(P<0.05)。
表2 各组大鼠肾组织p-PERK及p-eIF2α表达比较(±s)
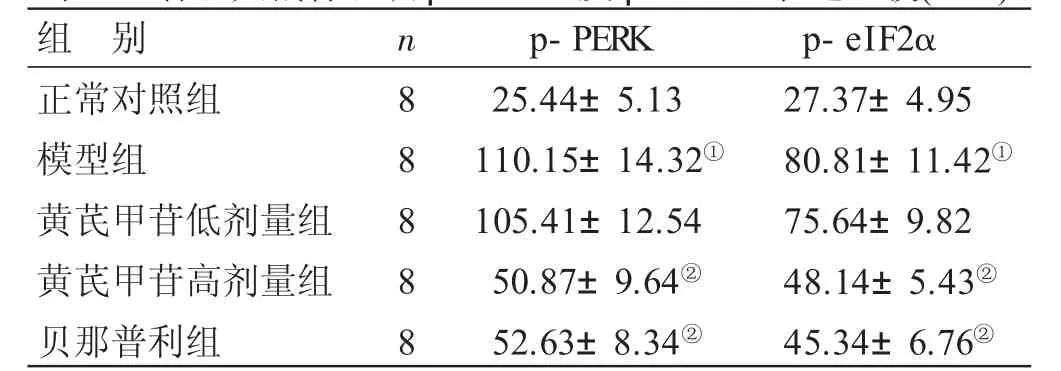
表2 各组大鼠肾组织p-PERK及p-eIF2α表达比较(±s)
与正常对照组比较,①P<0.05;与模型组比较,②P<0.05
组 别正常对照组模型组黄芪甲苷低剂量组黄芪甲苷高剂量组贝那普利组n 8 8 8 8 8 p-P E R K 2 5.4 4±5.1 3 1 1 0.1 5±1 4.3 2①1 0 5.4 1±1 2.5 4 5 0.8 7±9.6 4②5 2.6 3±8.3 4②p-e I F 2 α 2 7.3 7±4.9 5 8 0.8 1±1 1.4 2①7 5.6 4±9.8 2 4 8.1 4±5.4 3②4 5.3 4±6.7 6②
2.5 各组大鼠肾组织GRP78蛋白表达比较 见表3、图3。正常对照组大鼠肾脏组织GRP78少量表达。与正常对照组比较,模型组大鼠GRP78表达明显增高,差异有统计学意义(P<0.05)。与模型组比较,黄芪甲苷高剂量组及贝那普利组大鼠GRP78表达显著减少,差异均有统计学意义(P<0.05);黄芪甲苷低剂量组较模型组GRP78表达虽有下降,但无统计学差异(P>0.05)。

图2 各组大鼠肾组织p-PERK、p-eIF2α表达情况 (×400)
表3 各组大鼠肾组织GRP78蛋白表达比较(±s)

表3 各组大鼠肾组织GRP78蛋白表达比较(±s)
与正常对照组比较,①P<0.05;与模型组比较,②P<0.05
组 别正常对照组模型组黄芪甲苷低剂量组黄芪甲苷高剂量组贝那普利组n 8 8 8 8 8 G R P 7 8 0.3 8±0.0 2 0.8 1±0.2 6①0.6 8±0.1 7 0.5 2±0.0 8②0.4 5±0.0 5②

图3 各组大鼠肾组织GRP78蛋白表达情况
3 讨论
MN患病率随着人口老龄化、肾活检指征放宽及环境污染的加剧等原因不断升高,其在原发性肾小球疾病中的占比亦逐渐升高[4]。被动型Heymann肾炎大鼠是研究MN的经典模型。MN患者肾活检标本研究及被动型Heymann肾炎大鼠研究均发现ERS的标志蛋白GRP78表达明显升高,而且进一步明确ERS是膜性肾病发病及足细胞损伤凋亡的重要病理机制[5~6]。黄芪是中医学中的常用药物,黄芪甲苷是其主要活性成分。研究提示,黄芪甲苷具有抗炎、降压、降糖、心肌保护等多种药理作用[7~8]。黄芪在膜性肾病患者的使用非常广泛,新近研究也发现黄芪甲苷能够缓解成人原发性肾病综合征的足细胞损伤,减少蛋白尿[3],但黄芪甲苷是否通过影响PERK通路中相关蛋白表达而缓解ERS减少蛋白尿尚不清楚。本研究首先通过注射羊抗大鼠Fx1A抗体血清,建立被动型Heymann肾炎模型[9~10],再将黄芪甲苷应用于该模型。本研究发现,模型组大鼠24 h尿蛋白定量明显升高,血清白蛋白降低,肾组织PASM染色出现肾小球基底膜僵硬增厚及肾组织GRP78蛋白表达增多等,均提示模型组大鼠出现ERS且造模成功。黄芪甲苷高剂量组较模型组24 h尿蛋白定量明显减少,血清白蛋白上升,肾组织PASM染色示病理损害减轻,肾组织GRP78蛋白表达下调,均提示高剂量黄芪甲苷能够通过减轻ERS而有效缓解肾脏损伤。
缺血缺氧、氧化应激、钙浓度异常等因素导致内质网蛋白负荷过重引发ERS时,机体将激活一系列信号途径过程即未折叠蛋白反应(unfolded protein response,UPR),以减少蛋白质产生或者降解异常折叠蛋白质[11]。UPR由分子伴侣GRP78和3种ERS感受器蛋白介导,这3种蛋白分别是PERK,转录激活因子6和肌醇依赖酶1,它们引导三种不同的信号通路,其中PERK/eIF2α信号通路为主要通路[12]。ERS启动时,PERK与GRP78解离后发生自身磷酸化,成为p-PERK并激活下游eIF2α使其磷酸化为p-eIF2α,从而下调几乎所有蛋白质的翻译合成,减轻内质网负担[13]。适当的ERS有助于维持细胞生存,但过度ERS会引导组织细胞发生凋亡,引起或加重疾病[14]。Chen Y等[15]发现在糖尿病肾病大鼠中,黄芪甲苷可以通过抑制肾组织ERS发挥保护足细胞减少蛋白尿的作用,并且进一步了解该作用主要通过PERK/eIF2α信号通路实现,而对转录激活因子6和肌醇依赖酶1没有影响。本研究中同样发现黄芪甲苷高剂量组大鼠GRP78、p-PERK、p-eIF2α蛋白表达明显下调,尿蛋白减少而血清白蛋白明显上升,病理损伤减轻,提示黄芪甲苷可能通过抑制PERK/eIF2α通路减轻ERS,缓解蛋白尿,起到保护Heymann肾炎大鼠肾脏的作用,为以后黄芪甲苷在膜性肾病中的运用提供新的视角。
[参考文献]
[1]杨柳,刘东伟,刘章锁.膜性肾病流行病学研究进展[J].中华肾脏病杂志,2016,32(3):229-232.
[2]段立军,孙博航.黄芪甲苷的研究进展[J].沈阳药科大学学报,2011,28(5):410-416.
[3]Zheng R, Deng Y, Chen Y, et al.Astragaloside IV attenuates complement membranous attack complex induced podocyte injury through the MAPK pathway[J].Phytother Res,2012,26(6):892-898.
[4]Zhu P,Zhou FD,Wang SX,et al.Increasing frequency of idiopathic membranous nephropathy in primary glomerular disease:a 10-year renal biopsy study from a single Chinese nephrology centre[J].Nephrology(Carlton), 2015, 20(8):560-566.
[5]Wang L, Hong Q, Lv Y,et al.Autophagy can repair endoplasmic reticulum stress damage of the passive Heymann nephritis model as revealed by proteomics analysis[J].J Proteomics,2012,75(13):3866-3876.
[6]Markan S,Kohli HS,Joshi K,et al.Up regulation of the GRP-78 and GADD-153 and down regulation of Bcl-2 proteins in primary glomerular diseases:a possible involvement of the ER stress pathway in glomerulonephritis[J].Mol Cell Biochem,2009,324(1-2):131-138.
[7]Gui D,Huang J,Guo Y,et al.Astragaloside IV ameliorates renal injury in streptozotocin-induced diabetic rats through inhibiting NF-kappaB-mediated inflammatory genes expression[J].Cytokine,2013,61(3):970-977.
[8]Zhang N, Wang XH,Mao SL, et al.Astragaloside IV improves metabolic syndrome and endothelium dysfunction in fructose-fed rats[J].Molecules,2011,16(5):3896-3907.
[9]Lindskog A,Ebefors K,Johansson ME,et al.Melanocortin 1 receptor agonists reduce proteinuria[J].J Am Soc Nephrol,2010,21(8):1290-1298.
[10]杨凤杰,周建华,吕倩影,等.足细胞自噬在被动Heymann肾炎发病中的作用[J].中华肾脏病杂志,2014,30(1):41-47.
[11]武晓旭,章超群,许坤,等.白芍总苷对糖尿病大鼠肾组织中内质网应激的影响[J].安徽医科大学学报,2014,49(6):768-772.
[12]Atkins C,Liu Q,Minthorn E,et al.Characterization of a novel PERK kinase inhibitor with antitumor and antiangiogenicactivity[J].CancerRes, 2013, 73(6):1993-2002.
[13]Cunard R,Sharma K.The endoplasmic reticulum stress response and diabetic kidney disease[J].Am J Physiol Renal Physiol,2011,300(5):F1054-F1061.
[14]Tagawa Y,Hiramatsu N,Kasai A,et al.Induction of apoptosis by cigarette smoke via ROS-dependent endoplasmic reticulum stress and CCAAT/enhancer-binding protein-homologous protein(CHOP)[J].Free Radic Biol Med,2008,45(1):50-59.
[15]Chen Y,Gui D,Chen J,et al.Down-regulation of PERKATF4-CHOP pathway by Astragaloside IV is associated with the inhibition ofendoplasmic reticulum stress-induced podocyte apoptosis in diabetic rats[J].Cell Physiol Biochem,2014,33(6):1975-1987.
