铁皮石斛黑斑病病原鉴定及生物学特性研究
2018-04-19袁盛勇王传铭薛春丽郭建伟周银丽吴光梅
孔 琼,袁盛勇,王传铭,薛春丽,郭建伟,李 珣,周银丽,吴光梅
(红河学院生命科学与技术学院/云南省高校农作物优质高效栽培与安全控制重点实验室,云南 蒙自 661199)
【研究意义】铁皮石斛(Dendrobiumofficinale)是一种兰科石斛属药用植物,具有滋阴清热,益胃生津,润肺止咳等功效,富含石斛碱、石斛多糖等有效药用成分[1]。由于大规模的采挖和自然繁殖率低等原因导致了铁皮石斛野生资源稀缺,因此铁皮石斛的人工种植逐渐增多。随着人工种植面积的扩大和年限延长,大量的病害伴随于铁皮石斛的种植过程中,如炭疽病、疫病、黑斑病、茎基腐病、白绢病[2],其中由黑斑病引起的铁皮石斛病害发病较重,据笔者2012年4-12月于云南屏边铁皮石斛大棚种植基地的田间调查,发现该病发病率较重,高达30 %~50 %,严重影响了寄主植物的光合作用,从而导致了产量的降低。【前人研究进展】有关研究发现,链格孢菌(Alternariasp.)、叶点霉(Phyllostictasp.)、柱盘孢(Cylindrosporiumsp.)均能引起石斛属兰科植物发生黑斑病[3-8],不同寄主或地理区域下,其黑斑病的病原不尽相同。如前人研究发现引起浙江义乌和永康铁皮石斛、贵州赤水金钗石斛、云南屏边齿瓣石斛黑斑病的病原均为细极链格孢(Alternaria.tenuissima)[3-4,7-8],而引起云南普洱市民族传统医药研究所试验基地石斛的黑斑病为柱盘孢(Cylindrosporiumsp.)[6]。【本研究的切入点】对云南屏边铁皮石斛黑斑病病原和生物学特性方面的研究还未见报道,因此文章采取形态学和ITS序列对铁皮石斛黑斑病的病原菌进行鉴定,同时对其生物学特性进行研究。【拟解决的关键问题】旨在对铁皮石斛种植过程中该病害的防治提供理论依据。
1 材料与方法
1.1 材料
于2012年8月从云南屏边铁皮石斛种植基地采集铁皮石斛黑斑病病标样,采用组织分离法对病原菌进行分离[9],并经柯赫氏法则验证后确定2株铁皮石斛黑斑病病原,菌株编号为SA4和SA5。
1.2 方法
1.2.1 病原菌鉴定 病原菌落形态、分生孢子、产孢表型等特征观察方法根据《中国真菌志-链格孢属》进行观察和鉴定[10]。采用CTAB法提取SA4和SA5菌株的基因组DNA,通过真菌通用引物ITS1和ITS4进行病原菌rDNA-ITS序列扩增后[11],送至上海生工生物工程有限公司进行序列测定,测序结果于NCBI中BLAST上进行比较分析,用MEGA5构建各基因系统发育树,并用bootstrap对系统发育树进行检验,1000次重复。
1.2.2 病原菌生物学特性研究 采用在PCA上培养7 d的菌种,菌丝块大小为4 mm×4 mm,培养温度为27 ℃(除测定温度对病菌菌丝生长的影响外),光照条件为L∶D=12∶12(除测定光周期对病菌菌丝生长的影响除外),于培养第7天测定菌落直径和产孢量[12]。不同培养基对病原菌菌落生长及产孢量的影响。将菌种分别接入马铃薯蔗糖琼脂培养基(PSA)、马铃薯葡萄糖琼脂培养基(PDA)、马铃薯胡萝卜琼脂培养基(PCA)、胡萝卜琼脂培养基(CA)和查氏培养基(Czapek)5种培养基中,采用十字交叉法测量菌落直径,同时测定产孢量。不同氮源对病原菌菌落生长及产孢量的影响。以查氏(Czapek)培养基为基础培养基,以不加氮源作为对照,以甘氨酸、硝酸钠、硫酸铵、蛋白胨、氯化铵为替换氮源,置换Czapek培养基中的硝酸钾,制成含有相同含氮量的不同氮源培养基。pH对病原菌菌丝生长及孢子萌发率的影响。将病原菌菌丝块分别接种到pH值为3、4、5、6、7、8、9、10、11、12、13的PCA上培养7 d并测定其菌落直径。用病原菌的分生孢子分别制成pH为3、4、5、6、7、8、9、10、11、12、13的孢子悬浮液,24 h后检测萌发率,每次检测100个孢子,在显微镜下观察分生孢子萌发率。温度对病菌菌丝生长的影响。将菌丝块分别置于5、15、20、25、27、30、35 ℃不同温度下进行恒温培养,第7天测量菌落直径。光周期对病菌菌丝生长的影响。菌丝块接种于PCA培养基上,并置于全光照、光暗交替(L∶D=12∶12)和全黑暗条件下培养,于第7天用测量菌落直径。
1.2.3 数据分析 试验数据用DPSv7.05进行方差分析,再用Duncan法进行多重比较,数值表示为平均值±标准差。
2 结果与分析
2.1 形态特征
2.1.1 SA4形态特征 SA4菌株于PSA培养基上培养6 d后,菌落中心略突起,直径为5.39 cm,表面絮状,灰色,背面黑色。在湿润滤纸上产孢良好,培养7 d形成2~6个孢子的链,少分枝,分生孢子梗单生或数根簇生,分生孢子单生或短链生,卵形,倒梨形,倒棒状,淡褐色至褐色。具横膈膜1~4个,纵、斜隔膜0~4个。孢身大小11.819~31.012 μm×9.721~16.029 μm(平均21.42 μm×12.88 μm),短柱状假喙0.948~20.059 μm×1.897~4.307 μm(平均10.50 μm×3.10 μm)(图1)。依据形态学特征,鉴定为链格孢(Alternaria.alternata)。
2.1.2 SA5形态特征 SA5菌株在PSA培养基上培养6 d,菌落中心略突起,直径为5.63 cm,菌落表面密绒状,圆形灰白色,背面棕黄色,在湿润滤纸上产孢丰富,培养7 d形成4~10个孢子的链,多数分生孢子链不分枝,罕生的侧链一般较短,分生孢子中间1~2个横膈膜增厚,分生孢子梗单生或数根簇生,淡褐色,分生孢子链生,近球形,椭圆形,倒棒状,具横膈膜1~3个,纵、斜隔膜0~3个,孢身大小8.023~28.078 μm×9.370~14.360 μm(平均18.05 μm×11.87 μm),柱状假喙1.308~14.048 μm×2.392~4.499 μm(平均7.68 μm×3.44 μm)(图2)。根据形态学特征,鉴定为细极链格孢(Alternariatenuissima)。
2.2 致病性测定
根据柯赫氏法则,将SA4和SA5菌株接种于带有伤口的铁皮石斛叶片上,得到了黑斑病的典型症状,对照CK不发病,无症状(图3)。SA4菌株在接种的第2天开始发病,而SA5菌株于接种第4天才发病,随着时间的推移,病斑逐渐扩大;第6天时,SA4菌株接种的叶片出现水渍状和黑褐色的病斑,病斑较大,而SA5菌株表现为圆形的黑色病斑,且病斑较小。同时从病斑中重新分离获得的病原菌与接种病原菌的菌落形态和菌体特征完全一致。

A: 菌落正面;B: 产孢表型;C: 分生孢子A: Front colony on PSA; B: Sporulation pattern; C: Conidia图1 SA4菌株的形态特征Fig.1 Morphological characteristics of SA4 isolate

A:菌落正面;B:产孢表型;C:分生孢子A: Front colony on PSA;B: Sporulation pattern;C: Conidia图2 SA5菌株的形态特征Fig.2 Morphological characteristics of SA5 isolate
2.3 ITS序列分析
以SA4和SA5菌株的DNA为模板,用ITS1和ITS4引物进行PCR扩增,获得1条介于500~750 bp DNA片段(图4),通过上海生工测序后发现SA4菌株的ITS DNA片段大小为528 bp,SA5为531 bp。将所获得的序列与Gene Bank中链格孢属(Alternaria)5个小孢子种(Alternarialongipes、A.gaisen、A.brassicae、A.alternata和A.tenuissima)的一些菌株进行序列同源性比对,同时选取4个相似属[假格孢属(Nimbya)、细基格孢属(Ulocladium)、埃里格孢属(Embellisia),匍柄霉属(Stemphylium)]一些菌株ITS序列,采用MEGA 5.22中的NJ法构建系统发育树(图5)。结果显示SA4、SA5菌株与KC337037、KJ526175、HQ238277、JN108912、JQ004404的同源性高达99 %以上,同时聚在一个分枝,支持率为100 %,进一步支持了铁皮石斛黑斑病的病原菌是链格孢属(Alternaria)真菌,但无法鉴定到具体的种。

图3 SA4和SA5菌株接种6 d时的发病症状 Fig.3 Symptom of black spot disease with SA4 and SA5 after being inoculated for 6 days
2.4 病原菌生物学特性
2.4.1 不同培养基对病原菌菌落生长及产孢量的影响 2种链格孢菌在PSA、PCA、PDA、CA、Czapek培养基上均能生长和产孢(表1)。PDA培养基有利于促进病原菌菌丝的生长,菌丝生长旺盛,直径最大,且SA5菌株的菌落直径明显大于SA4菌株;而促进链格孢菌产孢的培养基为PCA培养基,该配方处理后的产孢量极显著高于其他处理,其中SA4菌株的产孢量显著高于SA5菌株的产孢量。
2.4.2 不同氮源对病原菌菌落生长及产孢量的影响 2种链格孢真菌对供试5种氮源均能利用,但菌落直径差异较大,同时在不含氮源的培养基中也能生长,说明其对氮源要求不高,具体见表2。适合链格孢菌菌丝扩展的氮源是硝酸钠、甘氨酸和蛋白胨,显著或极显著高于其他处理;而适合链格孢产孢的氮源为硝酸钠;而氯化铵和硫酸铵处理的菌落直径明显低于其他3种氮源的处理,且均不产孢。

图4 PCR扩增结果Fig.4 PCR amplification of SA4 and SA5 with ITS1 and ITS4
2.4.3 pH对病原菌生长和孢子萌发率的影响 在PCA培养基中,链格孢菌丝生长和孢子萌发的pH值范围较广,对酸碱度有较强的适应能力。其中pH为6时,SA4和SA5菌株的菌落直径最大,极显著高于其他处理;而孢子萌发率最高的pH为8,其产孢量极显著高于其他处理(表3)。

图5 SA4和SA5菌株构建的系统进化树Fig.5 Phylogenetic tree of SA4 and SA5 with NJ method by MEGA

培养基DifferentmediaSA4SA5菌落直径(cm)Colonydiameter产孢量(个)Sporulationquantity菌落直径(cm)Colonydiameter产孢量(个)SporulationquantityPSA7.30±0.00Aa4.00±1.00Cd7.67±0.21Bb1.33±0.58BbPCA7.75±0.22Aa12.00±1.00Aa7.45±0.13Bb5.00±1.00AaPDA7.40±0.36Aa6.00±1.00BCc8.87±0.06Aa1.33±0.58BbCA5.32±0.13Bb8.00±1.00Bb6.03±0.15Cd2.00±1.00BbCzapek5.50±0.31Bb0.67±0.58De6.37±0.26Cc2.00±1.00Bb
注:不同小写字母代表在P<0.05水平差异显著;不同大写字母代表在P<0.01水平差异极显著,下同。
Note: Different capital letters meant significant difference at the 5 % level, and different lowercase letters meant significant difference at the 5 % level. The same as below.

表2 不同氮源对病原菌菌丝生长和产孢量的影响

表3 不同pH对病原菌菌落和孢子萌发率的影响
2.4.4 温度对病原菌菌丝生长的影响 SA4和SA5菌株在5~30 ℃范围内均能生长,其中在25~30 ℃之间生长较快,最适生长温度为27 ℃,其菌落直径显著高于其他处理;而低温和高温时,菌丝生长缓慢(表4)。

表4 温度对病原菌菌落生长的影响
2.4.5 光周期对病原菌菌丝生长的影响 不同光照处理对链格孢属真菌的菌落生长影响差异不显著,说明菌丝生长对光照的要求不高(表5)。但是2个不同链格孢菌种之间存在一定的差异,SA4菌株(细极链格孢)在有光照时,菌丝生长较快;而是否有光照对SA5菌株(链格孢)的生长影响不明显。
3 讨 论
3.1 铁皮石斛黑斑病的病原鉴定
大量研究发现,很多植物病原能引起寄主植物叶片、叶鞘、枝条、果实发生黑斑病。如Alternariasp.侵染引起牡丹、石楠、梨、枣果、人参等花卉园林苗木、果树和中草药的黑斑病[13-17];福建琯溪蜜柚黑斑病的病原是由亚洲柑橘叶点霉(Phyllostictacitriasiana)和中华柑橘叶点霉(Phyllostictacitrichinaensis)引起[18],而柑橘黑斑病则是由柑桔球座菌(Guignardiacitricarpa)造成的[19];湖南水稻叶鞘黑斑病则由假弯孢(Cochliobolusfallax)侵染引起[20]。虽然感病寄主植物的发病症状均表现为黑斑,但病原和发病部位却不同,其中大多数病原为植物病原真菌,同时也有例外,如杧果黑斑病的病原是细菌(Xanthomonascampestrispv.mangiferae-indicae)[21]。因而植物黑斑病的病原鉴定工作尤为重要,同时应根据病原和病害的田间流行规律制定出可行的防治措施。因此笔者调查了铁皮石斛黑斑病的发生情况,并从田间采集病标样进行室内鉴定,结果发现云南屏边铁皮石斛黑斑病病菌组成复杂,目前至少有2个种,分别为细极链格孢(Alternariatenuissima)和链格孢(Alternariaalternata),其中细极链格孢(Alternariatenuissima)是在已报道的关于石斛黑斑病病原的文献中较为常见的种,而链格孢(Alternariaalternata)较少有报道。
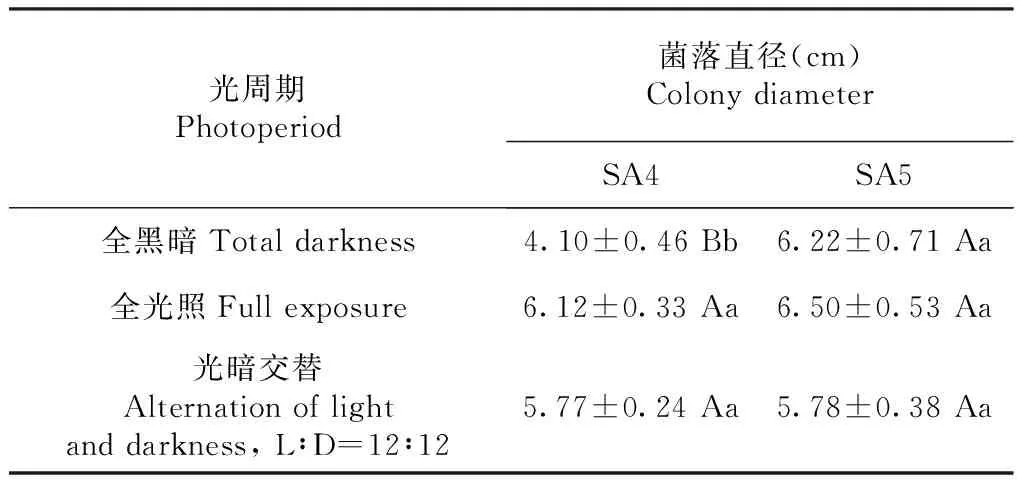
表5 不同光周期对病原菌菌落生长的影响
链格孢属真菌属级特征明显,而种级特征由于受环境条件影响变异幅度较大。在真菌鉴定时须采用单孢分离纯化后的菌种,同时严格按照现代链格孢分离国家标准方法进行鉴定,主要形态特征包括:分生孢子(形状、大小、分隔情况、有无纹饰、产孢表型);分生孢子梗(单生、簇生、分枝方式、延伸方式、产孢方式);孢子链(长度及孢子数目);喙(有无、形态、长短)[10]。同时文章对这2种链格孢菌进行了ITS序列分析,发现该方法无法区分这2种链格孢菌,因此在进行链格孢属真菌种类鉴定时,应侧重于形态学鉴定,同时结合分子生物学方法进行,其中分子鉴定采用多基因(如OPA2-1、OPA1-3、RPB2、endoPG)测序后构建系统进化树进行区分。
3.2 病原菌生物学特性
文章对铁皮石斛黑斑病病原细极链格孢(Alternariatenuissima)和链格孢(Alternariaalternata)的生物学特性研究发现,这2种病原真菌对营养要求不高,很多能培养真菌的培养基和氮源都适合其生长需求。菌丝生长最适培养基为PDA,产孢最适培养基为PCA;这与前人对其他链格孢属真菌的研究结果相一致[22]。而对供试5种氮源均能利用,但是利用效率各有差异,最适氮源分别是蛋白胨和硝酸钠,但是铵态氮则明显抑制2种链格孢属真菌菌丝的生长;菌落生长最适pH为6,孢子萌发的最高pH为8;光照的有无对2种病原菌的菌丝生长影响不大;病原菌在25~27 ℃生长速度最快,而35 ℃以上就难以生长。本研究结果与该病害在屏边温室大棚中易在6-8月侵染铁皮石斛老叶,从而引起黑斑病的发病规律相吻合。
4 结 论
引起铁皮石斛叶片黑斑病的病原菌为细极链格孢(Alternariatenuissima)和链格孢(Alternariaalternata)2种真菌,两种病原菌的生物学特性有一定差异,且该病害易于高温条件下传播蔓延。
参考文献:
[1]冯 杰,杨生超,萧凤回.铁皮石斛人工繁殖和栽培研究进展[J].现代中药研究与实践, 2011, 25(1):81-85.
[2]李 戈,李荣英,高薇薇.药用石斛规模化种植中的病害问题及防治策略[J].中国中药杂志,2013, 38(4):485-487.
[3]张敬泽,郑小军.铁皮石斛黑斑病病原菌的鉴定和侵染过程的细胞学研究[J].植物病理学报, 2004, 34(1):92-94.
[4]曹星星.铁皮石斛病原菌分离与鉴定及印度梨形孢促生作用研究[D]. 杭州:浙江大学, 2015.
[5]宋海超,张 勇,邢 波,等.海南石斛兰叶片黑点病病原鉴定及室内药剂毒力测定[J].中国农学通报,2011, 27(19):110-114.
[6]付开聪.傣药喃该罕(石斛)黑斑病的研究[J].中国民族医药杂志,2008(10):47-48.
[7]桑维钧,李小霞,练启仙,等.赤水金钗石斛黑斑病菌生物学特性及防治研究[J].云南大学学报,2007,29(1):90-93.
[8]王仕玉,萧凤回.齿瓣石斛病原链格孢菌生物学特性研究[J].华北农学报,2009(s2):243-246.
[9]方中达.植病研究方法(第3版)[M]. 北京:中国农业出版社,1998.
[10]张天宇.中国真菌志(第十六卷)链格孢属[M].北京:科学出版社,2003.
[11]White T J, Bruns T, Lee S, et al. Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics[A]. INNIS M A, GELFAND D H, SNINSKY J J, et al. PCR Protocols: A guide to methods and applications[M]. New York: Academic Press, 1990.
[12]杨丽芬,孔垂思,郭建伟,等.云南墨兰炭疽病的病原菌鉴定、致病性及生物学特性研究[J].西南农业学报,2017, 30(9):2003-2009.
[13]石良红,赵兰勇,吴 迪,等.山东牡丹黑斑病的病原菌鉴定与ITS序列分析[J].园艺学报, 2015, 42(3):585-590.
[14]韩长志,李瑞强.球花石楠黑斑病菌生物学特性[J].中国森林病虫,2015, 34(2):6-8.
[15]孙 卓,杨利民,马秀杰,等.人参黑斑病拮抗细菌的分离筛选和鉴定[J].吉林农业大学学报, 2014, 36(3):276-281.
[16]陈维维.库尔勒香梨萼端黑斑病病原学、发生规律和防治技术研究[D].乌鲁木齐:新疆农业大学, 2014.
[17]刘晓琳,刘 玉,马 荣,等.新疆枣果黑斑病病原菌鉴定及生物学特性[J].西北林学院学报,2015, 30(3):132-138.
[18]张晓彬.琯溪蜜柚黑斑病诊断与发生规律研究[D].福州:福建农林大学,2014.
[19]Baldassari R B, Reis R F, de Goes A. A new method for inoculation of fruit withGuignardiacitricarpa, the causal agent of citrus black spot[J]. European Journal of Plant Pathology, 2009, 123: 1-4.
[20]黄 微,夏 花,高必达.水稻新病害叶鞘黑斑病的病原鉴定[J].植物病理学报,2014, 44(3): 225-231.
[21]Ah-You N, Gagnevin L, Grimont P A D, et al. Polyphasic characterization ofXanthomonadspathogenic to members of the Anacardiaceae and their relatedness to species ofXanthomonas[J]. International Journal of Systematic and Evolutionary Microbiology, 2009, 59:306-318.
[22]常慧红.冬枣黑斑病菌生物学特性的研究[J].林业实用技术,2013(1):45-46.
