CeO2富氧性对质子交换膜燃料电池阴极催化剂性能的影响
2018-04-18张扬傅杰王婕润王紫雪
张扬, 傅杰, 王婕润,王紫雪
(大连交通大学 环境与化学工程学院,辽宁 大连 116028)
0 引言
质子交换膜燃料电池(PEMFCs)是以阳极通入氢气为燃料,阴极通入空气或氧气做为氧化剂,无须经过燃烧,在低温下将电极中的燃料和氧化剂流经催化剂使其化学能转变为电能的装置,最后产生的仅是水.所以在未来发展PEMFCs将有助于减少传统能源消费过程中产生的污染性气体,并缓解当前的能源危机.目前使用最广的催化剂是铂系催化剂,虽然贵金属催化剂在高纯度燃料和氧化剂环境中能保持较好的活性,但铂对燃料或氧化剂中的杂质气体(CO,SOx等)抵抗性极差[1-2],少量的杂质气体即可导致贵金属催化剂的中毒.例如,当阳极燃料气体中CO浓度达到5ppm时就可使工作状态下铂催化剂的最大能量密度下降一半[3].
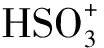
CeO2具有萤石型晶体结构,其储氧能力十分优秀,与贵金属容易形成金属-氧化物相互作用力,并起到了锚定位点的作用,可以使催化剂的颗粒不仅保持在较小尺寸,还可以增大催化剂中Pt分散度.通过CeO2中的铈在四价与三价态之间相互转换过程中吸收或释放的氧,当贵金属催化剂负载CeO2时可以调节活性颗粒表面氧的含量以促进对有毒气体的氧化[11-12].
本文采用水热法制备CeO2,研究了不同Ce含量对CeO2-Pt/C催化剂催化活性及对SO2耐受性的影响.通过Ce改性,提高催化活性的同时提供较强的氧化能力.
1 实验方法
1.1 立方形CeO2的制备
称取适量的Ce(NO3)3·6H2O(国药),加入40mL去离子水和无水乙醇(天津科密欧)1∶1配制的溶液中,电磁力搅拌30 min后,加入0.6mol/L的NaOH溶液(国药),继续搅拌直到溶液呈乳白色后迅速倒入聚四氟乙烯管中,将高压釜于马弗炉中180℃恒温保存24 h.充分冷却后用去离子水多次洗涤,过滤,最后置于真空干燥箱中室温干燥6 h.
1.2 CeO2-Pt/C催化剂的制备
称取不同量的CeO2和XC-72碳粉(美国Carbot)倒入茄形瓶中,加入适量乙二醇(天津科密欧)超声混匀后,加入H2PtCl6·6H2O(沈阳金科试剂厂)溶液,用NaOH溶液调节pH值至12,全程在高纯N2(大连浚枫气体)保护下以120℃回流3h.冷却后经过滤、洗涤、真空干燥,制得CeO2含量分别为2%、4%、6%、8%的CeO2-Pt/C催化剂.用同样方法制得纯Pt/C催化剂进行对比.
1.3 催化剂的表征
1.3.1透射电镜(TEM)
取少量CeO2-Pt/C粉末,加入适量无水乙醇,用超声波震荡均匀,将适量溶液滴在标准铜网上,干燥后放入样品架,由JEOLTEM-2000EX型透射电镜系统测定该催化剂的粒径大小和分布,颗粒微观状态下的整体形貌,电压120 kV,分辨率为 1.43Å.
1.3.2循环伏安测试
取催化剂样品5 mg放入试管中,加入1 mL无水乙醇和25 μL的Nafion(Dupont)溶液,超声波分散均匀.用微量进样器吸取5 μL溶液逐滴涂在玻碳电极表面(直径3 mm).
涂好的玻碳电极作为工作电极进行循环伏安(CV)测试,饱和甘汞电极为参比电极,铂丝为对电极,以0.5 mol/L的H2SO4溶液(N2饱和)为电解液.使用辰华电化学工作站(CHI 600C),电压范围-0.2~1.2 V,扫描速度50 mV/s.
1.3.3SO2电催化氧化实验
将电极放入HClO4溶液中(0.1 mol/L N2饱和),以50 mV/s的扫描速率在-0.2~1.2 V的电势范围内扫描10圈活化.再将电极移至NaSO3(0.1 mol/L)电解液中,恒电势0.5 V下持续200s,让SO2分子吸附在活性颗粒表面.取出电极后用HClO4溶液冲洗,再放入HClO4溶液中,以50mV/s的扫描速率在-0.2~1.2 V的电势范围内再次扫描.
2 实验结果与讨论
2.1 CeO2的透射电镜图片
图1是由水热法制得的CeO2的TEM图片.从图中可以清晰的看到每个颗粒的形貌都非常完整,呈现出大小不一的立方体结构.边长由5~20 nm不等.

(a)立方形CeO2的TEM图 (b)CeO2颗粒的放大图
2.2 CeO2-Pt/C的透射电镜图片
图2为纯Pt/C催化剂和2%的CeO2-Pt/C的TEM照片对比.从图中可以明显看出加入了CeO2的催化剂(图2(a))中,Pt与CeO2的粒径相对更小,分散度也高于未加入CeO2的催化剂(图2(b)),这是由于CeO2起到了锚定位点的作用,提高了Pt 纳米颗粒的分散,同时可以看出图2(b)中颗粒存在着明显的团聚现象.

(a)CeO2-Pt/C (b)Pt/C (c)CeO2-Pt/C纳米颗粒
2.3 CeO2-Pt/C的能谱分析
图3中颜色最亮的为碳黑,其次为铂,最黑的是CeO2. 再由图(2(c))可以证明Ce和Pt元素的存在,并且无明显团聚现象(图3(b)),Ce与Pt的含量接近投料比.
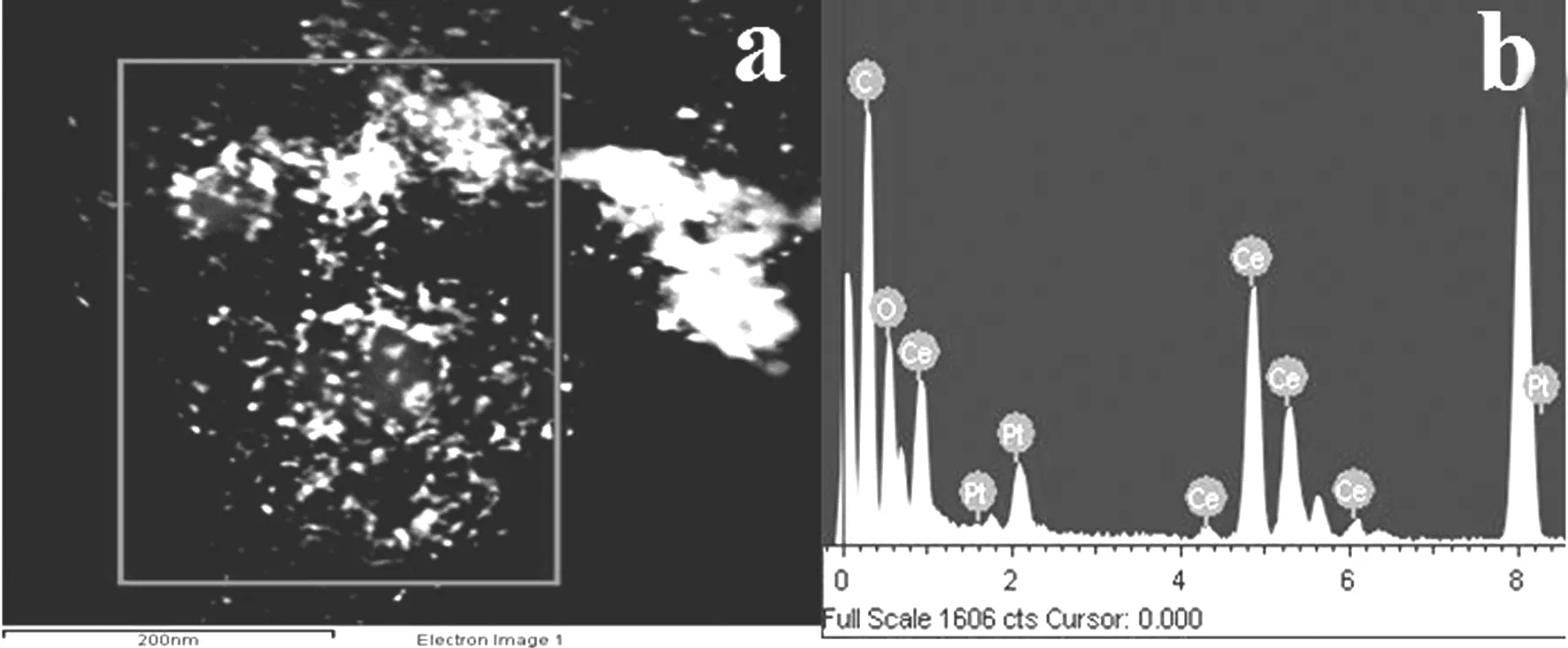
图3 CeO2-Pt/C的EDS图谱
2.4 CeO2-Pt/C的电化学循环伏安扫描
图 4 表明所测试的催化剂都显示出了Pt颗粒的多晶面循环伏安特性.图中-0.2~0 V范围内产生的波峰表明电解液中的氢在不同晶面Pt颗粒上的吸附与脱附.其氢的氧化、还原峰电位十分接近,面积近似,表明其具有可逆性良好的氧化还原过程.在各组分催化剂中,虽然CeO2与Pt直接接触,但当CeO2含量低于4%时,Pt颗粒表面活性点位被其覆盖的较少,并未对催化剂的活性造成大的影响,当CeO2的含量达到6%时,催化剂的活性超过未加入CeO2的纯Pt/C催化剂.最后当CeO2的含量继续增加时,由于已影响了活性位数量,造成催化剂活性急剧下降.
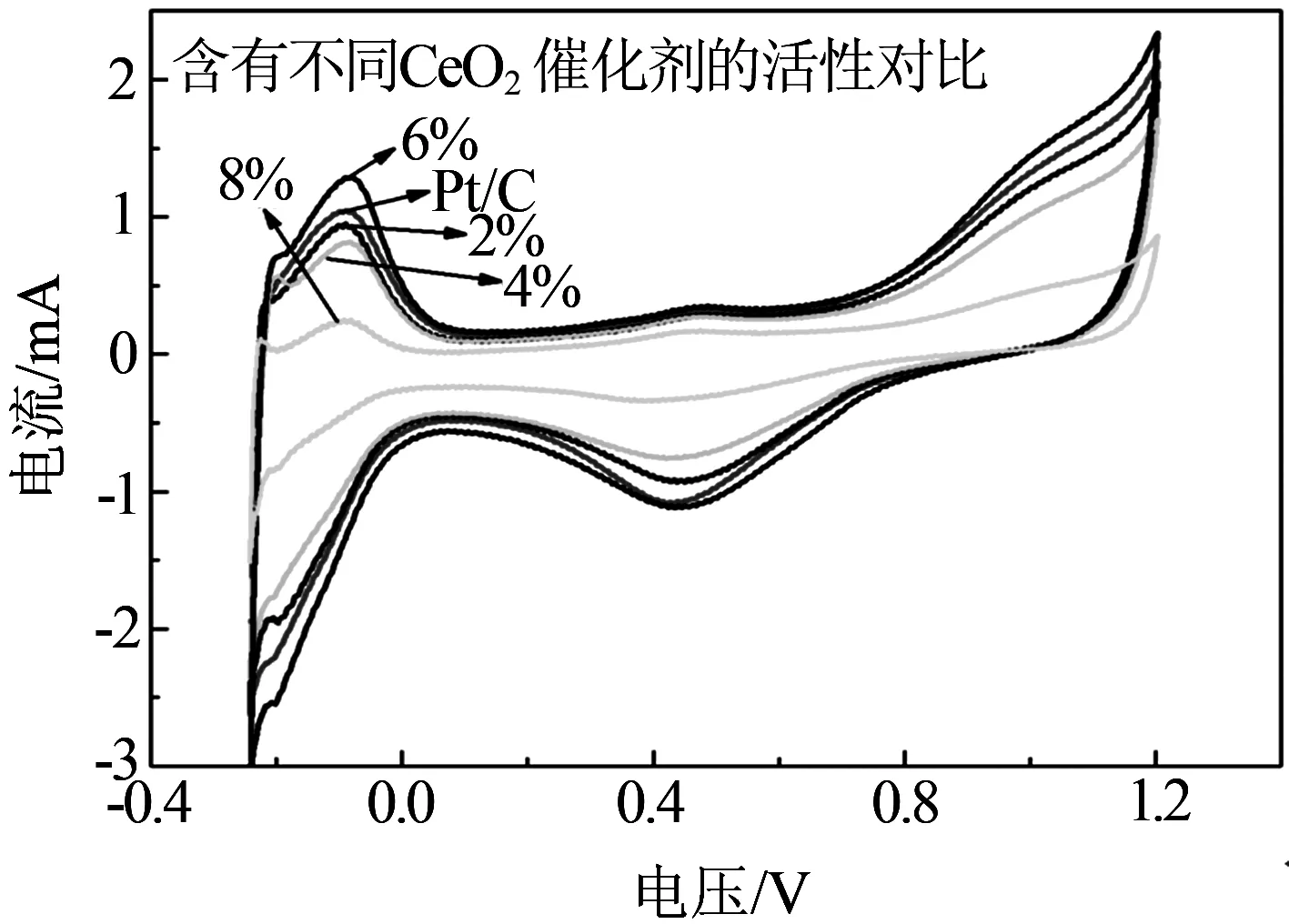
图4 不同CeO2含量CeO2-Pt/C催化剂CV图
2.5 CeO2-Pt/C催化剂上吸附SO2的电化学氧化
图5是催化剂对SO2耐受性的电化学实验,(a)为不同CeO2含量催化剂的抗硫曲线;(b)为SO2氧化局部放大图;(c)为2% CeO2催化剂中毒后的恢复曲线;(d)为纯Pt/C催化剂中毒后的恢复曲线.从图5(a)~(b)中可以看出,氧化特征峰始于0.5 V,氧化峰在0.95 V附近出现.两个因素造成该峰的形成,第一是吸附在催化剂颗粒上的含硫杂质被氧化,第二是在高电位下铂发生自身的氧化.把各催化剂对吸附的SO2的催化氧化第一圈曲线叠加到一起,通过对比后我们发现,掺有CeO2的催化剂中毒后的电流衰减明显小于纯Pt/C催化剂.当CeO2的质量分数为2 %时,催化剂表现出最好的SO2氧化能力,电位相比于纯Pt/C催化剂降低了71 mV.其次是4 %,6 %.当含量达到8 %时氧化电位反而上升,高含量的CeO2会对催化剂对SO2的催化氧化能力有所阻碍.图5(c)~(d)是催化剂中毒后经60圈CV扫描后催化剂回复状况的曲线,图5(c)为CeO2-Pt/C催化剂,经60圈CV回复后, 催化剂基本恢复到初始水平. 图5(d)为纯Pt/C催化剂,从图中可以看出经过60圈CV回复后,纯Pt/C催化剂只恢复到了初始一半的水平.所以可得出结论,CeO2的加入提高了催化剂的抗中毒能力,还改善了催化剂的恢复性能.
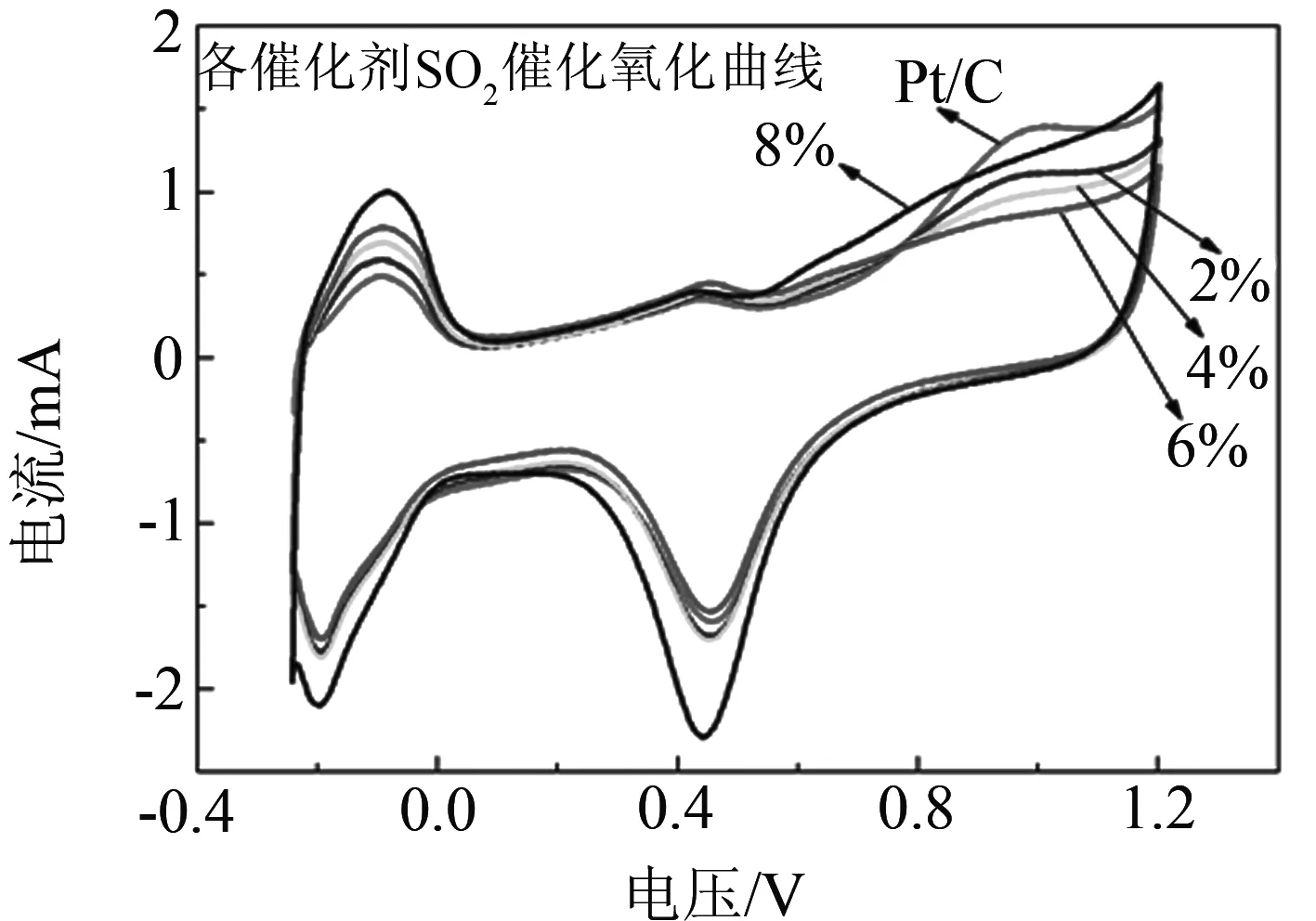
(a)
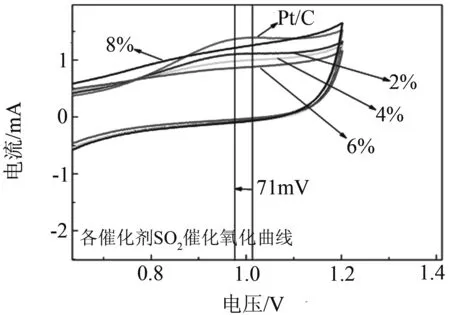
(b)
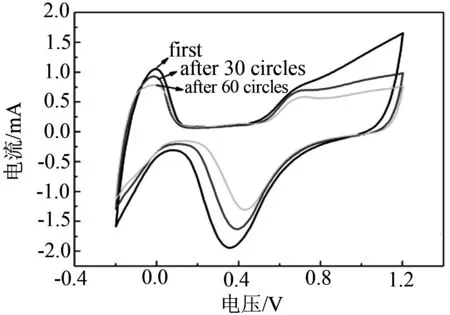
(c)
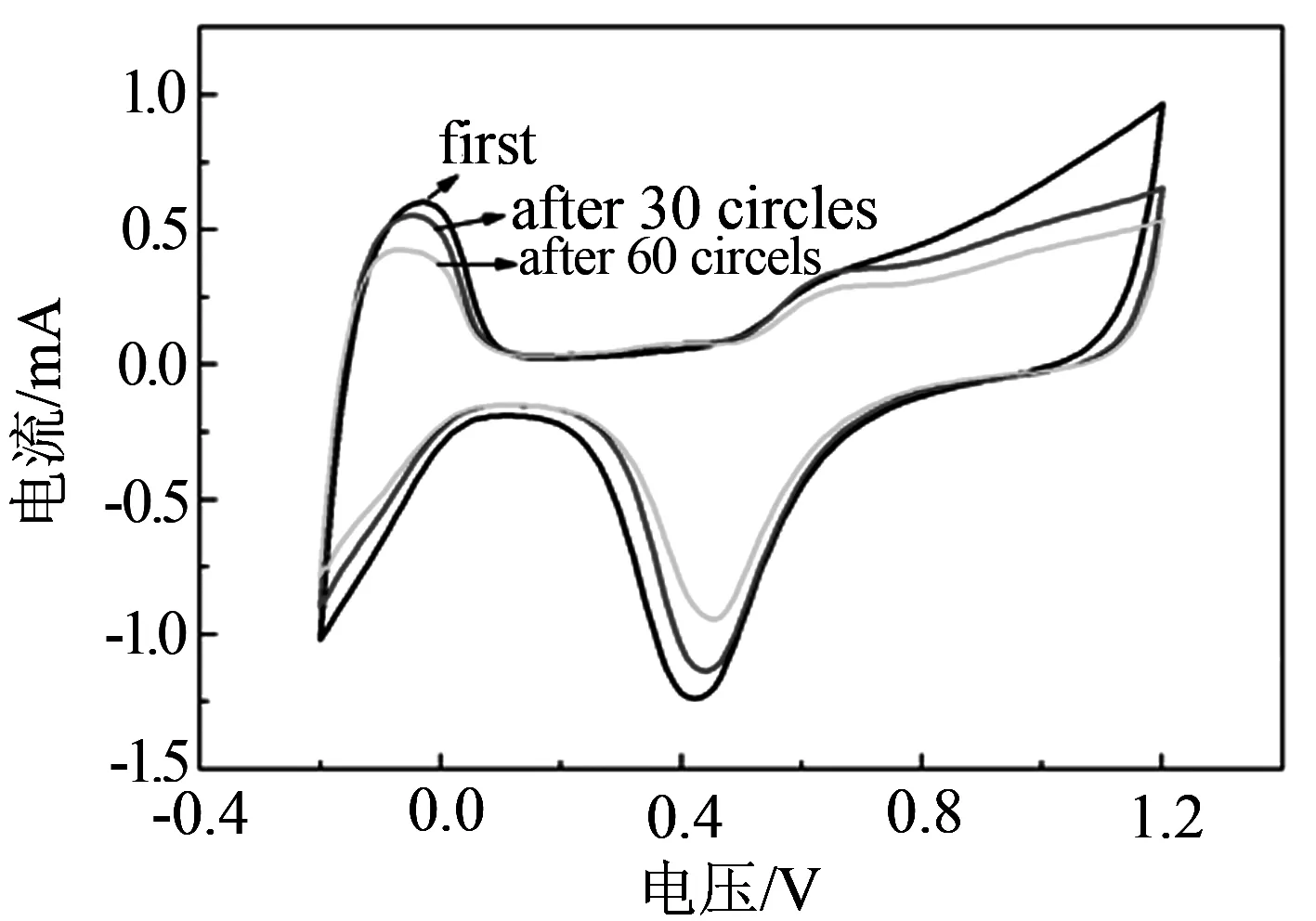
(d)
3 结论
CeO2的加入既可以提高传统PEMFCs阴极Pt/C催化剂的活性,又可以促进吸附在活性颗粒表面SO2的氧化.含量适当时表现出强的催化活性,相反对于SO2的氧化,随着CeO2含量的进一步增加其氧化能力反而大幅度降低,CeO2的加入对传统阴极Pt/C催化剂的活性与SO2的耐受性都有所提高.
参考文献:
[1]BRIAN C H, STEELE ANGELIKA HEINZEL. Materials for fuel-cell technologies[J]. Nature, 2010,414 (21): 345-352.
[2]YU Y, XIN H L,HOVDEN R, et al. Three-Dimensional tracking and visualization of hundreds of Pt-Co fuel cell nanocatalysts during electrochemical aging[J]. Nano letter, 2012(12): 4417- 4423.
[3]OETJEN H F, SCHMIDT V M, STIMMING U, et al.Performance Data of a Proton Exchange Memberane Fuel Cell Using H2/CO as Fuel Gas[J]. Electrochemical Society,1996(143):3838-3842.
[4]TANG Z, GENG D, LU G. Size-controlled synthesis of colloidal platinum nanoparticles and their activity for the electrocatalytic oxidation of carbonmonoxide[J]. Colloid interface Science ,2005(287):159-166.
[5]SUN S H, JAOUEN F, DODELET J P. Controlled Growth of Pt Nanowires on Carbon Nanospheres and Their Enhanced Performance as Electrocatalysts in PEM Fuel Cells[J]. Advanced Materials, 2008(20):3900-3904.
[6]SU H, XU L, ZHU H P,et al. Self-humidification ofa PEM fuel cell using a novel Pt/SiO2/C anode catalyst[J]. International Journal Hydrogen Energy, 2010(35):7874-7880.
[7]LEE Y, KIM J, YUN D S, et al. Virus-templated Au and Au-Pt core-shell nanowires and their electrocatalytic activities for fuel cell applications[J]. Energy and Environmental Science,2012 (5):8328-8334.
[8]JING F, HOU M, SHI W. et al.The effect of ambient on PEMFC performance[J]. Power Sources ,2007(166):172-176.
[9]AQ CONTRACTOR, H LAL. The nature of spcies adsorbed on platinum from SO2solution[J]. Electroanalytic Chemistry, 1978(93): 99-107.
[10]GARSANY Y, BATURINA O A, LYONS K E S.Impact of Sulfur Dioxide on the Oxygen Reduction Reaction at Pt/Vulcan Carbon Electrocatalysts[J]. ElectrochemicalSociety, 2007(154):B670-B675.
[11]XU J, HARMER J,LI G,et al. Size Dependent Oxygen Buffering Capacity of Ceria Nanocrystals[J]. Chemical Communications, 2010(46): 1187-1189.
[12]OU D R, MORI T,TOGASAKI H, et al. Microstructural and Metal Support Interactions of the Pt-CeO2/C Catalysts for Direct Methanol Fuel Cell Application[J]. Langmuir, 2011 (27): 3859-3866.
