印度梨形孢对棉花苗期生长及耐盐性的影响
2018-04-18邓晶潘锐胡爱兵张文英
邓晶,潘锐 胡爱兵 张文英
( 长江大学作物抗逆技术研究中心,湖北 荆州 434025)( 湖北省荆州农业科学院棉花研究所,湖北 荆州 434000)( 长江大学作物抗逆技术研究中心,湖北 荆州 434025)
土地盐碱化是世界农业可持续发展面临的一个重大问题。中国盐渍地面积约为3.5×107hm2,其中在棉花种植区域盐渍地面积约为3.3×106hm2[1]。由于盐渍严重影响棉花的生长和产量[2,3],因而培育和提高棉花的耐盐性成为近年来盐碱地开发的研究热点之一。目前,对于棉花与真菌共生提高耐盐性的研究尚未见报道。
印度梨形孢(Piriformosporaindica)能定殖于多种植物根部,促进植株生长,提高植株生物与非生物逆境耐受性[4~6]。印度梨形孢可以提高烟草[7]、苜蓿[8]、水稻[9]、大麦[10]等作物的耐盐性,目前尚无印度梨形孢提高棉花耐盐性的报道。本研究以盐敏感型棉花品种邯郸8942为试验材料,接种印度梨形孢后,施加不同浓度NaCl处理,着重研究不同盐胁迫下接种和不接种印度梨形孢表型和生理的差异,探讨印度梨形孢对棉花幼苗生长及苗期耐盐性的影响,以为提高棉花耐盐性研究提供参考。
1 材料与方法
1.1 试验材料
盐敏感棉花品种邯郸8942由国家棉花中期种质库( 河南安阳)提供;印度梨形孢真菌菌种由德国耶拿大学Ralf Oelmüller教授提供。
1.2 试验设计
1.2.1种子和真菌预处理
选取颗粒饱满、大小一致的棉花种子,用0.5%次氯酸钠( NaClO)处理10min,清水冲洗5次后浸泡3h,放置在灭菌的湿毛巾上,置于生长箱( 温度28℃,湿度60% RH)中催芽。挑选活力充足的带有印度梨形孢的PDA菌块,加入到灭菌的ASP液体培养基中,放置在25℃、150r/min的恒温摇床中培养15d备用。
1.2.2共生体系构建
将印度梨形孢加入无菌水中( 1mg∶100mL),用搅拌机打散并混合均匀制成菌液。挑选整齐一致棉花幼苗,移栽至塑料生长盆( 18cm×10cm,直径×高)中,并在幼苗根系注射1mL菌液,共生培养12d后随机挑选5株幼苗,蒸馏水冲洗根系泥沙后,剪成1cm长小段,10% KOH处理12h,1% HCl浸泡5min后洗净,0.04%台盼蓝染色制片,相差显微镜( Nikon Ri260)下观察根系孢子定殖情况。
1.2.3盐胁迫处理
将接菌植株和不接菌植株分别移栽至有孔的泡沫板上,放置于生长盆中。分别加入2L含有0、100、200mmol/L NaCl的霍格兰溶液。所有生长盆均用空气泵每隔2h通空气10min。试验设置4次重复。
1.3 指标测定
1.3.1形态指标
接菌15d后和NaCl处理7d后分别用直尺测量株高,游标卡尺测量茎粗,相机拍照并用ImageJ软件( 美国National Institutes of Health)测量叶面积。
1.3.2地上部和地下部生物量
接菌15d后和NaCl处理7d后将苗完整地取出,从根基部剪断,分别称量地上部和地下部鲜重,105℃杀青30min,75℃烘干至恒重,称量干重。
1.3.3光合作用参数
采用Li-6400 便携式光合测定仪( 美国LI-COR 公司)分别测定接菌15d后和NaCl处理7d后的植株倒三叶的光合参数,包括净光合速率(Pn)、气孔导度(Gs)、胞间CO2浓度(Ci)、蒸腾速率(Tr)。
1.4 数据处理
数据处理采用Excel 2007和DPS 9.05,作图采用SigmaPlot 10.0软件。未接菌盐处理植株均与未接菌未盐处理植株对比;接菌盐处理植株均与接菌未盐处理植株对比,参数降低比例按[(对照-处理) ÷对照]×100%进行计算。
2 结果与分析
2.1 印度梨形孢对棉花苗期生长的影响
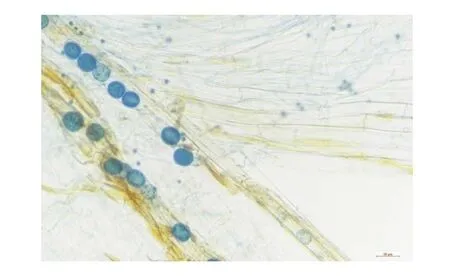
图1 邯郸8942接种印度梨形孢12d后镜检图
接种印度梨形孢12d后对根系进行镜检可以看到,印度梨形孢的厚垣孢子成串排列在根系中,分布区域广,孢子数量多( 图1)。这表明,印度梨形孢成功定殖于棉花根系。
2.1.1接种印度梨形孢对棉花幼苗形态的影响
未接种与接种印度梨形孢15d后的邯郸8942植株形态指标测定结果如图2所示。由图2可知,接种印度梨形孢15d后的植株比未接菌植株的株高、茎粗、真叶数目、叶面积分别上升16.3%、23.0%、13.3%和12.3%,均达到显著水平。这表明接种印度梨形孢可以促进棉花幼苗生长。
未接种与接种印度梨形孢15d后的邯郸8942植株的生物量测定结果如表1所示。由表1可知,接种印度梨形孢植株比未接菌植株的地上部分鲜重和干重分别上升30.3%和23.1%,地下部分鲜重和干重分别上升35.9%和34.7%,均达到显著水平,根冠比由12.743%上升至13.896%。这表明,接种印度梨形孢可以增加棉花植株的地上部分和地下部分生物量累积,增大植株根冠比。
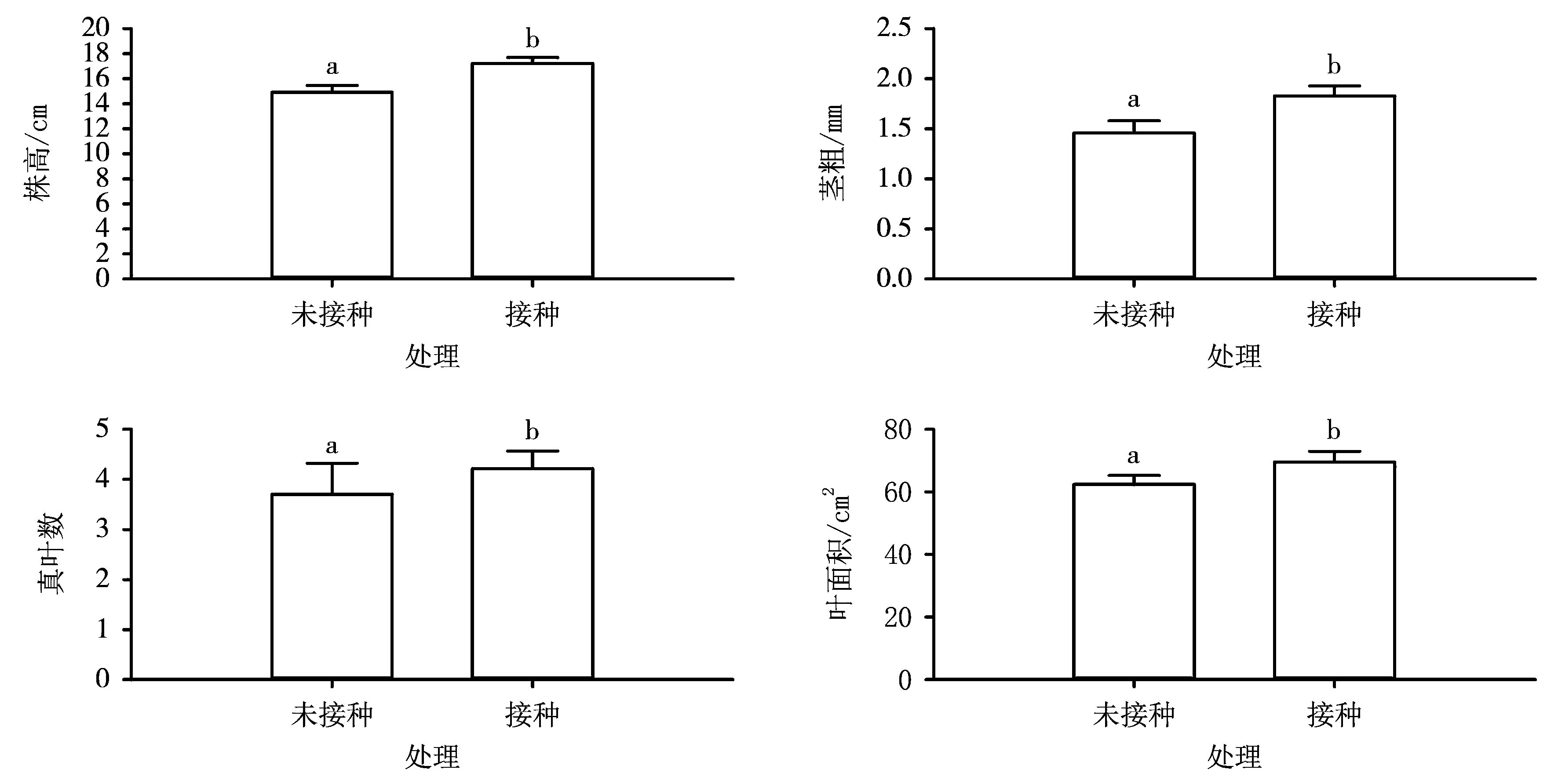
图2 未接种与接种印度梨形孢15d后的邯郸8942植株形态指标比较

处理地上部鲜重/g地上部干重/g地下部鲜重/g地下部干重/g根冠比/%未接种3.20±0.135a0.39±0.023a0.64±0.053a0.05±0.004a12.74±1.523a接种4.17±0.239b0.48±0.031b0.87±0.061b0.07±0.004b13.90±2.011b
2.1.2接种印度梨形孢对棉花光合参数的影响
未接种与接种印度梨形孢15d后的邯郸8942植株光合作用参数测定结果如图3所示。由图3可知,接种印度梨形孢后对比未接菌植株净光合速率(Pn)、气孔导度(Gs)、胞间CO2浓度(Ci)、蒸腾速率(Tr)分别上升了9.6%、14.2%、6.0%和33.7%,均达到显著水平。这表明,接种印度梨形孢可以促进棉花植株光合作用。
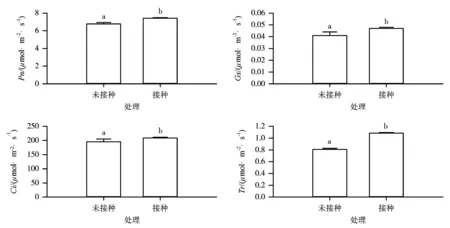
图3 未接菌与接种印度梨形孢15d后邯郸8942植株的光合参数比较
2.2 印度梨形孢对棉花耐盐性的影响
2.2.1接种印度梨形孢对盐胁迫下棉花形态的影响
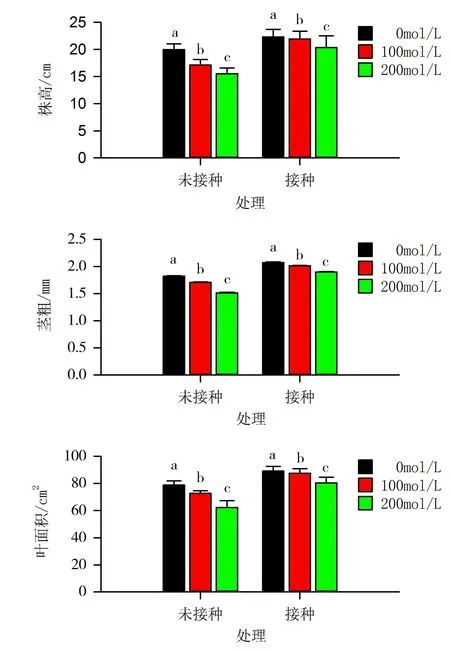
图4 未接种与接种印度梨形孢的邯郸8942植株在盐处理7d后的株高、茎粗和叶面积比较
不同浓度NaCl处理7d后的植株形态指标测定结果如图4所示。由图4可知,对于未接种印度梨形孢的植株,与经0mmol/L NaCl的处理相比,经100mmol/L 的NaCl处理后的株高、茎粗、叶面积分别减少15.6%、8.1%和7.9%,经200mmol/L的NaCl处理后的株高、茎粗、叶面积则分别减少23.4%、17.2%和18.7%,均达到显著水平。对于接种印度梨形孢植株,与经0mmol/L的 NaCl处理相比,经100mmol/L的NaCl处理后的株高、茎粗、叶面积分别减少3.0%、2.8%和2.9%,但均未达到显著水平;而经200mmol/L的NaCl处理后的株高、茎粗、叶面积则分别减少9.6%、9.0%和8.9%,均达到显著水平,并且可见减少量均低于未接菌植株。这表明接种印度梨形孢可以降低盐胁迫下棉花植株株高、茎粗、叶面积的减少量,缓解盐胁迫对作物生长的抑制。
未接种与接种印度梨形孢植株在盐胁迫7d后的生物量测定结果如表2所示。由表2可知,对于未接种印度梨形孢的植株,经100mmol/L、200mmol/L的NaCl处理与经0mmol/L的NaCl处理相比,其地上部分鲜重分别降低10.2%、29.9%,干重分别降低9.8%、23.5%;地下部分鲜重分别降低6.0%、16.9%,干重分别降低14.7%、27.9,均达到显著水平。对于接种印度梨形孢的植株,经100mmol/L的NaCl处理与经0mmol/L 的NaCl处理相比,其地上部分鲜重和干重分别减少3.1%、3.4%,地下部分鲜重和干重分别减少1.8%、2.3%,但均未达到显著水平;经200mmol/L 的NaCl处理与经0mmol/L 的NaCl处理相比,其地上部分鲜重和干重分别减少10.5%、15.2%,地下部分鲜重和干重分别减少28.4%、9.2%,均达到显著水平。这表明,接种印度梨形孢可以缓解盐胁迫下棉花植株生物量的减少,且在低浓度盐胁迫下比高浓度盐胁迫下效果显著。未接菌植株在经100mmol/L和200mmol/L的NaCl处理后根冠比均降低,而接菌植株根冠比均上升。这表明接种印度梨形孢可以增加植株盐胁迫下根冠比,利于耐受盐胁迫。
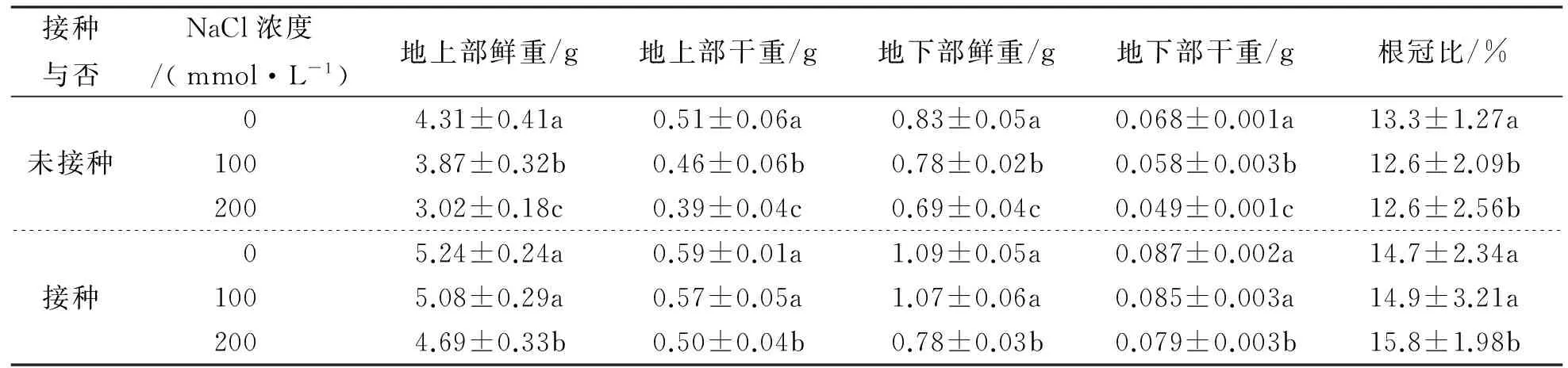
表2 未接种与接种印度梨形孢的邯郸8942植株在盐处理7d后的生物量比较
2.2.2接种印度梨形孢对盐胁迫下棉花光合参数的影响
未接种与接种印度梨形孢的植株在盐处理7d后的光合作用参数测定结果如图5所示。由图5可知,对于未接种印度梨形孢的植株,经100mmol/L的NaCl处理后相比经0mmol/L的NaCl处理,净光合速率、气孔导度、胞间CO2浓度、蒸腾速率分别下降21.9%、9.8%、6.4%和7.1%,均达到显著水平;经200mmol/L的NaCl处理后的则分别下降56.3%、19.6%、11.8%和14.3%,均达到极显著水平;对于接种印度梨形孢的植株,经100mmol/L的NaCl处理后与经0mmol/L的 NaCl处理相比,净光合速率、气孔导度、胞间CO2浓度、蒸腾速率分别下降8.7%、3.1%、2.3%和1.9%,均未达到显著水平;而经200mmol/L的NaCl处理后的则分别下降24.0%、9.4%、5.7%和4.6%,均达到显著水平。这表明接种印度梨形孢可以缓解盐胁迫下棉花植株光合作用的降低,且在低盐浓度下比高盐浓度下效果更显著。
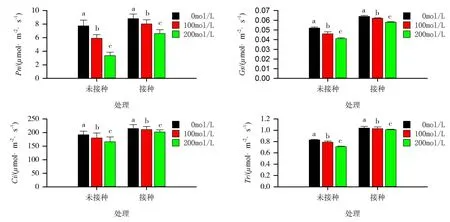
图5 未接种与接种印度梨形孢的邯郸8942植株在盐处理7d后的光合参数比较
3 讨论
植物的地上部分和地下部分是一个相互作用的整体[11]。根系是作物吸收水分和营养物质的主要器官,发达的根系对作物的生长具有很强的促进作用[1];地上部分是光合作用同化有机物的场所,是植物生长的主要干物质来源[12]。本研究中,印度梨形孢进入作物根系后地下部分生物量和根冠比增加,水分和营养物质吸收增加。地上部分的气孔导度和胞间CO2浓度增加,提高了植株的净光合速率,同化的有机物增加,促进生长效应显著。
盐胁迫下植物体外渗透势低[13],会造成植物水分亏缺[14],同时钠离子过多也会对植物产生离子毒害作用[15~17]。本研究中,未接菌植株在盐胁迫生长减慢,而接种印度梨形孢植株在低盐浓度下仍可以保持正常生长,但在高浓度盐胁迫下,接种印度梨形孢也会出现生长减慢的现象。从生物量来看,接种印度梨形孢植株在盐胁迫下根冠比增加,未接菌植株根冠比减少。前人的研究[18]也证明根系吸水能力和作物的耐盐性显著相关,因此保持发达的根系可能是印度梨形孢提高棉花耐盐性的方式之一。从光合参数来看,未接种印度梨形孢植株净光合速率减慢,同化的有机物显著减少,但是气孔导度和胞间CO2浓度减少幅度不大,说明此时限制棉花植株光合作用的因素为叶绿体等光合器官受损,原因可能是渗透压过大导致细胞膜损伤[16]。有研究表明,接种印度梨形孢可以维持植物体内的渗透平衡[7]。在低盐浓度下,接种印度梨形孢植株的光合器官细胞未受明显损伤,保持正常的净光合速率,这是接种印度梨形孢植株在低浓度盐胁迫下形态指标未明显减少的原因。但在高浓度盐胁迫下,植株体内渗透压过大[13],印度梨形孢无法完全缓解叶绿体等细胞器的损伤,最终出现随着盐浓度增加而印度梨形孢提高耐盐性效果减弱的现象。综上所述,接种印度梨形孢可以显著促进棉花苗期生长并诱导提高棉花的耐盐性,可应用于盐碱地开发利用中。
[参考文献]
[1]刘祎,张海娜,钱玉源,等.NaCl水培胁迫下棉花苗期耐盐指标筛选与分析[J].河北农业科学,2017,21(3):30~34.
[2]Zhao Y L,Wang H M,Shao B X,etal.SSR-based association mapping of salt tolerance in cotton (GossypiumhirsutumL.)[J].Genetics & Molecular Research,2016,15:29~36.
[3]Dong X N,Gao L H,Ding M Q,etal.Effect of bivalent geneKCERF-PEDREB2Aon drought and salt tolerance of cotton[J].Journal of Agricultural Science & Technology,2016,18:17~23.
[4]Xu L,Wang A A,Wang J,etal.Piriformosporaindicaconfers drought tolerance onZeamaysL.through enhancement of antioxidant activity and expression of drought-related genes[J].The Crop Journal,2017,5:251~258.
[5]Abdelaziz M E,Kim D,Ali S,etal.The endophytic fungusPiriformosporaindicaenhancesArabidopsisthalianagrowth and modulates Na+/K+homeostasis under salt stress conditions[J].Plant Science,2017,263:107~115.
[6]Hosseini F,Mosaddeghi M R,Dexter A R.Effect of the fungusPiriformosporaindica,on physiological characteristics and root morphology of wheat under combined drought and mechanical stresses[J].Plant Physiology & Biochemistry,2017,118:107~120.
[7]惠非琼,彭兵,楼兵干,等.印度梨形孢通过促进渗透调节物质的合成和诱导抗逆相关基因的表达提高烟草耐盐性[J].农业生物技术学报,2014,22(2):168~176.
[8]李亮,武洪庆,马朝阳,等.印度梨形孢促进蒺藜苜蓿生长及其提高耐盐性研究[J].微生物学通报,2015,42(8):1492~1500.
[9]Jogawat A,Saha S,Bakshi M,etal.Piriformosporaindicarescues growth diminution of rice seedlings during high salt stress[J].Plant Signaling & Behavior,2013,8:41~61.
[10]Ghabooli M.Effect ofPiriformosporaindica,inoculation on some physiological traits of barley (Hordeumvulgare) under salt stress[J].Chemistry of Natural Compounds,2014,50:1082~1087.
[11]王艳哲,刘秀位,孙宏勇,等.水氮调控对冬小麦根冠比和水分利用效率的影响研究[J].中国生态农业学报,2013,21(3):282~289.
[12]刘爱荣,张远兵,钟泽华,等.盐胁迫对彩叶草生长和渗透调节物质积累的影响[J].草业学报,2013,22(2):211~218.
[13]黄清荣,祁琳,柏新富.根环境供氧状况对盐胁迫下棉花幼苗光合及离子吸收的影响[J].生态学报,2018,12(2):1~9.
[14]阿曼古丽·买买提阿力,拉扎提·努尔布拉提,高丽丽,等.盐胁迫对海岛棉和陆地棉幼苗生长及生理特性的影响[J].植物学报,2017,(4):465~473.
[15]韩冰,贺超兴,郭世荣,等.丛枝菌根真菌对盐胁迫下黄瓜幼苗渗透调节物质含量和抗氧化酶活性的影响[J].西北植物学报,2011,31(12):2492~2497.
[16]徐猛,马巧荣,张继涛,等.盐胁迫下不同基因型冬小麦渗透及离子的毒害效应[J].生态学报,2011,31(3):784~792.
[17]Jin L,Chen G L,Zhao Y,etal.Response of arbuscular mycorrhizal fungi to salt stressed condition and the interrelation between AMF and host plant[J].Ecology and Environment,2007,16:228~233.
[18]Irizarry I,White J F.Application of bacteria from non-cultivated plants to promote growth,alter root architecture and alleviate salt stress of cotton[J].Journal of Applied Microbiology,2017,122:1110~1120.
