玉竹多糖补充对肥胖大鼠血清自由基代谢的影响
2018-04-17洪卫星黄徐根
许 超, 洪卫星, 蒋 珍, 黄徐根
(1.铜陵学院, 安徽 铜陵 244000; 2.安徽师范大学, 安徽 芜湖 241002)
0 引 言
自由基(Free Radical),又称游离基,是具有非偶电子的原子或基团[1],其化学性质非常活泼,具有强氧化性,它与诸多疾病的产生息息相关,在正常生理条件下,机体内自由基的产生和清除处于一种动态的平衡状态。有研究表明,肥胖会导致机体自由基堆积,清除能力下降[2]。适宜的低氧运动可以增强骨骼肌氧利用率,从而减少自由基生成[3],有效改善心肌缺血和组织用氧功能,对机体心血管、呼吸和免疫等系统功能有改善作用[4]。
随着经济与科技的飞速发展,人们对人体奥秘的探求越来越细化且科学,运动领域与医学领域的交叉研究受到运动医学界的追捧与关注,尤其以国粹传统中药更为兴起,人们通过从传统中药玉竹中提取得到玉竹多糖,将它与运动相结合,研究其应用价值[5-7]。本研究旨在利用玉竹多糖的抗氧化作用干预低氧训练过程中的肥胖大鼠,测其血清氧自由基与羟自由基抑制能力以评估其对自由基代谢的干预效果,进而为玉竹多糖在运动训练、大众健身中的开发利用提供一个可靠依据。
1 研究对象与方法
1.1 研究对象
6周龄健康雄性SD大鼠203只(购自上海实验动物中心,许可证号:SCXK(沪)2013-0006),SPF 级体重(172.15±11.94) g。分笼饲养,自由饮食,自然采光,通风条件良好,温度(23±2) ℃,相对湿度40%~60%。实验期间严格控制饲养条件。
1.2 研究方法
1.2.1实验条件
采用美国进口的小型低氧发生器(MAG-10)组建低氧帐篷(低氧帐篷面积约6.75 m2,空间体积约9.45 m3),建立氧浓度为13.6%(模拟海拔3 500 m高度)、压强为101 kPa的常压低氧环境;利用动物跑台创造训练条件。
1.2.2肥胖大鼠模型建立
203只雄性SD大鼠经适应性饲养7 d后,随机挑选25只普通饲料饲养,178只高脂饲料饲养(高脂饲料配方为:猪油12%、蛋黄粉8%、白砂糖5%、全脂奶粉8%、胆固醇1%、胆盐0.2%、普通饲料65.8%)。饲养第十八周末,按肥胖标准[8](体重增量大于普通饲料饲养组体重增量均值加上1倍标准差)筛选肥胖大鼠112只。
1.2.3适应性训练及实验大鼠筛选
筛选出的肥胖大鼠随后进行一周低氧仓适应后,进行为期两周逐渐增加强度的适应训练(训练方案参照文献[4]并稍加修改,第一周适应训练时间为20 min,强度为12~18 m/min;第二周适应训练时间为40 min,强度为18~22 m/min)。经过一阶段适应性训练后,对于运动能力极好和极差以及有伤病的大鼠进行剔除,且剔除体重过重和过轻的大鼠,保留56只肥胖大鼠随机分为7组,即肥胖低住安静对照组(FLC组)、肥胖高住安静对照组(FHC)、肥胖低住低练组(FLL组)、肥胖高住低练组(FHL组)、肥胖低住高练组(FLH组)、肥胖高住低练玉竹组(FHLP组)、肥胖低住高练玉竹组(FLHP组)。并从25只普通饲料饲养的大鼠中挑选8只作为正常安静对照组(C组)。
1.2.4大鼠实验分组安排
各训练组大鼠在水平动物实验跑台上进行耐力性练习,低氧条件下进行60 min/d,5 d/w,4 w的训练,训练强度为20 m/min;常氧条件下进行60 min/d,5 d/w,4 w的训练,速度为22 m/min。具体实验分组安排见表1。
1.2.5给药方案
分组后,每天上午对大鼠进行灌服,其中,FHLP和FLHP大鼠灌服玉竹多糖溶液(河南中冠建业生物科技有限公司)1 g/kg(灌胃方案参照文献[7]并稍加修改),其余各训练组大鼠灌服等量的生理盐水,训练1 h后灌胃,1 w灌胃5次,灌胃共4 w。
1.2.6血清自由基指标的测定
4周实验后大鼠采用腹主动脉取血,放入离心管中,随后将离心管置于37 ℃水浴箱中水浴60 min,然后置离心机以3 000 r/min速度离心20 min,用移液枪提取出上层血清,根据说明书,完成血清O2-·、OH·指标的测定。
测试仪器:分光光度计。
测定指标方法:血清OH·、O2-·采用比色法用可见分光光度计测定。
测试试剂:实验所需试剂皆购于南京建成生物工程研究所。

表1 实验大鼠分组情况
1.2.7统计分析
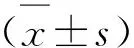
2 研究结果与分析
4周实验后大鼠血清氧自由基、羟自由基抑制能力见表2。

表2 各组大鼠血清氧自由基、羟自由基抑制能力一览表
注:应用单因素方差分析中的Duncan检验不同组同一指标,以P<0.05为显著性水平,不同上标间差异显著,a>b>c>d>e。
从表2可以看出,实验4周末,各肥胖安静对照组大鼠血清氧自由基抑制能力与正常安静对照组相比组间差异性不显著(P>0.05);各肥胖低氧训练组大鼠血清氧自由基抑制能力与各安静对照组相比均有所升高,其中,肥胖低住高练玉竹组和肥胖高住低练玉竹组大鼠血清氧自由基抑制能力显著高于各安静对照组和肥胖低住低练组(P<0.05);肥胖低住高练组大鼠血清氧自由基抑制能力与肥胖低住高练玉竹组相比组间差异不显著(P>0.05),但肥胖低住高练玉竹组大鼠血清氧自由基抑制能力仍高于肥胖低住高练组大鼠血清氧自由基抑制能力;而肥胖高住低练玉竹组与肥胖高住低练组相比组间有显著性差异(P<0.05),前者显著高于后者。
由表2可以看出,各肥胖组除肥胖低住低练组和肥胖低住高练组外,其余各组大鼠血清羟自由基抑制能力均显著高于正常安静对照组(P<0.05);肥胖高住安静对照组大鼠血清羟自由基抑制能力显著高于肥胖低住安静组和正常安静对照组(P<0.05);肥胖高住低练组、肥胖低住高练玉竹组和肥胖高住低练玉竹组大鼠血清羟自由基抑制能力显著高于肥胖低住低练组和肥胖低住高练组(P<0.05);与肥胖低住高练组相比,肥胖低住高练玉竹组大鼠血清羟自由基抑制能力显著升高(P<0.05)。
3 结 语
低氧训练能一定程度的提高高脂饮食所致肥胖大鼠血清氧自由基和羟自由基的抑制能力,玉竹多糖补充可增强其抑制能力,从而减少自由基的生成,进而提高机体的抗氧化能力。
参考文献:
[1]赵性川.外场作用对钛表面磷酸锌转化膜形成及结构和性能的影响[D].济南:山东大学,2014.
[2]吴鹤群,王勇.黄柳菇总黄酮对过度训练大鼠心肌抗氧化酶及肌酸激酶活性的影响[J].三明学院学报,2011,28(6):8-11.
[3]李一新,刘仁仪.低氧运动对骨骼肌自由基代谢的影响[J].湘南学院学报,2010,31(5):112-115.
[4]赵鹏,冯连世.新的低氧训练模式研究及应用进展[J].体育科学,2005,25(6):70-74.
[5]徐春燕.苜蓿多糖和黄芪多糖对肉仔鸡抗氧化性能影响的研究[D].扬州:扬州大学,2010.
[6]吕佳妮.石斛根中石斛多糖提取优化及抗氧化活性研究[D].杭州:浙江大学,2014.
[7]谢建军,胡蔓菁,孙桂菊.玉竹多糖对四氧嘧啶糖尿病大鼠胰岛B细胞损伤的保护作用[J].时珍国医国药,2008,19(10):2479-2481.
[8]贡晨.肥胖大鼠低氧训练减体重研究[D].芜湖:安徽师范大学,2014.
