Hsa_circ_PVT1在肝细胞癌中的表达及意义
2018-04-17朱元鑫付航玮林夏蓝翔马钰李光耀董睿王宇洲陈平
朱元鑫,付航玮,林夏,蓝翔,马钰,李光耀,董睿,王宇洲,陈平
在全球范围内,肝细胞癌(HCC)约占原发性肝癌的90%,是癌症相关致死的主要原因之一,其中有50%的病例发生在我国[1]。目前肝癌最有效的治疗方法仍然是手术治疗,但是由于缺乏早期诊断的有效手段,导致仅30%~40%的肝癌患者适于根治性切除术,而且由于术后高复发转移率,导致这些肝癌患者预后较差[2-3]。因此,寻找更加有效的肿瘤标志物是HCC早期诊断、早期治疗以及改善预后的关键。
近年来,研究发现环状RNA(circRNA)作为一类共价闭合环状的内源性RNA,广泛存在于哺乳动物细胞中[4-6],且可能作为癌症早期诊断的新型生物标志物和潜在的治疗靶点[7]。hsa_circ_PVT1(CircBaseID: hsa_circ_0001821)是一类来源于PVT1基因座内的长链非编码RNA区浆细胞瘤变体易位转录物,长约410nt。Chen等[8]首次利用RNA测序技术发现浆细胞瘤多样异位基因1(circ-PVT1)在胃癌组织中高表达,并且通过与miR-125b结合促进胃癌细胞增殖,证实了circ-PVT1在胃癌中可以作为一种新型的增殖因子及预后标志物。circ-PVT1与人类肝细胞癌的发生发展是否存在相关性,能否通过影响肝癌细胞的增殖能力从而影响肝癌发生和演变,目前尚不清楚。本研究检测HCC患者中肝癌组织/癌旁组织的circ-PVT1表达水平,分析其与患者临床病理指标的关系,并通过干扰circ-PVT1的表达检测细胞增殖能力的变化,以明确circ-PVT1表达与人肝癌细胞增殖的关系。
1 材料与方法
1.1 实验试剂与研究对象
1.1.1 主要试剂 南美胎牛血清(ExCell公司),DMEM培养基(Gibco公司),总RNA提取试剂盒(Promega公司),反转录试剂盒、荧光定量PCR试剂盒(TaKaRa公司),细胞周期检测试剂盒(碧云天生物技术),CCK-8(Dojindo 公司),Click-iT EDU法细胞增殖成像检测试剂盒(凯基生物),LipoFiter脂质体转染试剂(汉恒生物)。
1.1.2 研究对象 本研究收集2016年1月-2017年6月在第三军医大学第三附属医院肝胆外科行肝癌切除术且术后病理诊断为HCC的患者共46例,且入组患者术前均未接受放疗或者化疗,组织标本包括:组织标本取自肝癌组织和癌旁组织(距离肿瘤>2cm)。人肝癌细胞系(HepG2、SMMC-7721、MHCC-97H、MHCC-97L、HCC-LM3),正常人肝细胞系(L02,上海市生命科学院细胞中心)。
1.2 实验方法
1.2.1 组织标本与数据收集 46例HCC患者的肝癌组织/癌旁组织标本均在肿瘤切除后15min内置于液氮罐中冻存。临床病理指标主要包括:患者性别、年龄、家族史、肝硬化、HBsAg、肿瘤大小、肿瘤TNM分期、分化程度、甲胎蛋白(alpha fetal protein,AFP)、碱性磷酸酶(alkaline phosphatase, ALP)、γ-谷胺酰转肽酶(gamma glutamyl transpeptidase, GGT)。本试验所有标本获取前均得到受试者同意,并得到第三军医大学医学伦理委员会批准。
1.2.2 细胞培养 人肝癌细胞系(HepG2、SMMC-7721、MHCC-97H、MHCC-97L、HCC-LM3),正常人肝细胞系L02均采用含有10%胎牛血清的DMEM培养基,5%CO237℃的细胞孵育箱中培养。
1.2.3 circ-PVT1表达检测 按照试剂盒说明书提取组织标本及细胞RNA,反转录成cDNA。取上述反转录产物在Bio-Rad PCR仪上扩增,反应体系为10μl,包括cDNA 1μl,上下游引物各0.5μl,SYBR Premix Ex Taq(2×)5μl。RT-qPCR条件为:95℃ 预变性30s;95℃ 5s,60℃退火30s,40个循环。Hsa_circ_PVT1引物序列:前引物5'-GGTTCCACCAGCGTTATTC-3',后引物5'-CAACTTCCTTTGGGTCTCC-3';线性RNA PVT1引物序列:前引物5'-TTCAGCACTCTGGACGGAC TT-3',后引物5'-TATGGCAGGGCAGGGTAG-3';GAPDH作为内参,前引物5'-TTGCCCTCAACGAC CACTTT-3',后引物5'-TGGTCCAGGGGTCTTACT CC-3'(成都擎科生物合成)。实验独立重复3次,每个样本设3个复孔。通过熔解曲线分析确认扩增特异性,利用ΔCt法(目标基因Ct值-内参基因的Ct值)比较表达的高低,采用2–ΔΔCT法计算相对表达量。
1.2.4 细胞转染 实验设小干扰RNA PVT1(sicircPVT1)组和阴性对照(si-NC)组,分别以LipoFiter脂质体转染试剂将si-circPVT1和si-NC转染入人肝癌细胞系HepG2、SMMC-7721中。转染方法:HepG2、SMMC-7721分别以2.0×105/孔在6孔板中培养,待融合度达40%~50%时,将培养基换成无血清DMEM,严格按照试剂说明书进行操作。si-circPVT1及si-NC均由上海生工公司合成,sicircPVT1序列:5'-GCCAACUUCCUUUGGGUCUT T-3',si-NC序列:5'-UUCUCCGAACGUGUCACGU TT-3'。
1.2.5 CCK-8实验 将细胞转染48h后常规消化,重悬并计数,以2.0×103/孔接种于96孔板中。置于培养箱(37℃,5%CO2)中分别培养24、48、72、96h,每孔加入10μl CCK-8溶液,37℃孵育2h,酶标仪检测450nm波长处吸光度(OD)值。实验独立重复3次,每组设5个复孔。
1.2.6 EdU实验 采用Click-iT EdU法细胞增殖成像检测试剂盒进行EdU测定。将细胞转染48h后常规消化,重悬并计数,以1.0×104/孔接种于96孔板,每组设3个复孔。50μmol/L EdU孵育2h后,用4%多聚甲醛将细胞固定并用Click-iT反应混合物染色,Hoechst 33342染细胞核,在荧光显微镜(OLympus FSX100)下随机取3个视野拍照,并计算EdU阳性细胞百分率。
1.2.7 流式细胞术检测细胞周期 细胞转染48h后,按照细胞周期试剂盒使用说明进行固定、染色,流式细胞仪检测细胞周期,并记录激发波长488nm处红色荧光。
1.3 统计学处理 采用SPSS 18.0及GraphPad Prism 5软件进行统计分析。两组之间比较采用独立样本t检验,多组间比较采用单因素方差分析。数据以±s表示。P<0.05为差异有统计学意义。
2 结 果
2.1 circ-PVT1在人肝癌组织及肝癌细胞系中的表达检测 RT-qPCR结果显示,circ-PVT1在人肝癌组织中的表达水平明显高于癌旁组织(图1A,P<0.001),同时circ-PVT1在人肝癌细胞系(HepG2、SMMC-7721、MHCC-97H、MHCC-97L、HCC-LM3)中的表达水平明显高于人正常肝细胞系L02(图1B,P<0.05)。

图1 RT-qPCR检测circ-PVT1在人肝癌组织(A)及肝癌细胞系(B)中的表达水平Fig.1 Expression of circ-PVT1 in human hepatocellular carcinoma (HCC) and HCC cell lines detected by RT-qPCR
2.2 circ-PVT1的表达水平与肝细胞癌患者临床病理指标之间的关系 circ-PVT1表达水平(ΔCt)与肝细胞癌患者肿瘤大小(P=0.029),肿瘤TNM分期(P=0.036)及分化程度(P=0.038)密切相关(表1)。
2.3 siRNA转染效率及特异性检测 RT-qPCR结果显示,si-circPVT1可明显抑制circ-PVT1的表达(P<0.001),但对其亲本基因PVT1的mRNA表达几乎无影响(P=0.05),表明此siRNA可特异性干扰circ-PVT1的表达(图2)。
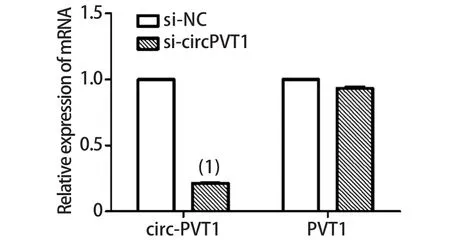
图2 RT-qPCR检测si-circPVT1对circ-PVT1及PVT1线性转录本mRNA表达量的影响Fig.2 Expression of circ-PVT1 and PVT1 RNA were detected after treatment with si-circPVT1 by RT-qPCR
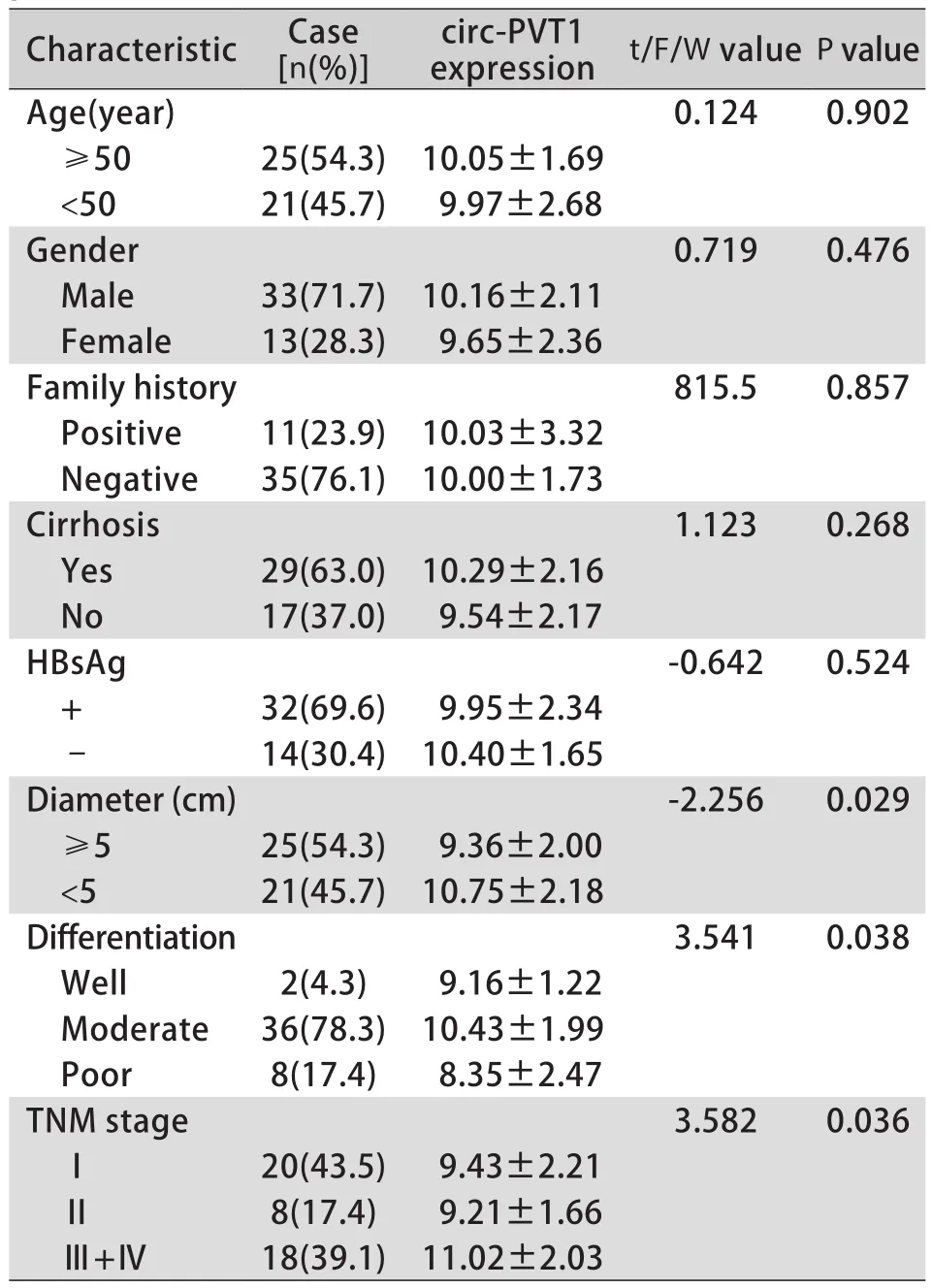
表1 肝癌组织中circ-PVT1表达水平(ΔCt)与HCC患者临床病理指标之间的关系Tab.1 Relationship between circ-PVT1 expression levels (ΔCt) in cancer tissues and clinicopathological features of patients with HCC
2.4 干扰circ-PVT1表达对人肝癌细胞周期及增殖能力的影响 CCK-8实验结果显示,干扰circ-PVT1表达后,人肝癌细胞HepG2、SMMC-7721的增殖活性明显低于si-NC组(P<0.01,图3A、B)。EDU实验得到相同的结果,即干扰circ-PVT1的表达后,与si-NC组比较,si-circPVT1组肝癌细胞增殖能力明显下降(图3C、D)。流式细胞术结果显示,sicircPVT1组细胞在G1期的比例明显高于si-NC组,S期和G2期的细胞比例则低于si-NC组。推测干扰circ-PVT1表达后,肝癌细胞系HepG2、SMMC-7721可能发生了G1/S期转换阻滞(图3E、F)。
3 讨 论
在过去的几十年中,环状RNA一直被认为是剪接体介导的拼接错误产生的副产物[9],并未引起科研工作者们的足够重视。然而,近年来随着高通量测序技术的广泛应用和生物信息技术的发展,发现环状RNA在真核生物中普遍存在[4,10],且通过非线性反向剪接形成闭合环状结构,其表达具有组织特异性、细胞类型特异性及生长阶段差异性[7,11-12],引起了科研工作者们越来越多的重视。最近已经发现并证实了多种环状RNA具有重要的生理功能[13],尤其在癌症的发生发展过程中,环状RNA可能作为多种癌症的诊断标志物及潜在的治疗靶点。但是由于癌症的多样性以及在不同的发展阶段,环状RNA都可能通过不同的靶点发挥作用[11-12],所以其作用机制至今尚未完全阐明。研究报道最多的是环状RNA可作为竞争性内源RNA或miRNA分子海绵,形成circRNA-miRNA-mRNA轴参与癌症的发展[4,14]。部分环状RNA含有miRNA结合位点,可以通过与mRNA竞争性结合miRNA,抑制mRNA降解[4,14-15],从而发挥转录后调节作用。例如,Circ-SRY通过吸附miR-138成为结直肠癌和卵巢癌中的肿瘤相关分子[16];Cir-ITCH可以作为miR-7、miR-17和miR-214的分子海绵,抑制Wnt/β-Catenin信号通路[17];ciRS-7通过与miR-7相互作用参与胃癌的发生发展过程[18];Hsa_circ_0005386通过与miR-129-5p相互作用调控Notch1的表达,从而参与HCC的发生过程,并且可以作为HCC诊断的潜在生物标志物[19]。
人类PVT1基因位于染色体8q24区,在肿瘤细胞中,此区是常见的DNA扩增区,提示肿瘤发病风险高,属于癌症易感基因座。Chen等[8]在对胃癌中环状RNA的研究过程中首次命名了circ-PVT1,发现circ-PVT1是一种源自PVT1基因的3号外显子,并且侧翼含有2个长的内含子,其中富含大量ALU元件重复序列的细胞质环状RNA,在胃癌中,circ-PVT1可以通过对let-7b的海绵吸附作用促进c-Myc的表达,并且可以通过与miR-125b结合促进胃癌细胞增殖,证实了circ-PVT1是胃癌中的新型增殖因子和预后标志物。本研究利用RT-qPCR技术检测了46例HCC患者肝癌组织/癌旁组织中circ-PVT1的表达水平,发现circ-PVT1在肝癌组织中的表达水平明显高于癌旁组织。此外,我们还发现,circ-PVT1的表达水平与HCC患者的肿瘤大小、TNM分期及分化程度密切相关。为进一步研究circ-PVT1与HCC发生发展过程的关系,我们比较了人肝癌细胞系(HepG2、SMMC-7721、MHCC-97H、MHCC-97L、 HCC-LM3)中circ-PVT1的表达水平,发现其表达水平高于正常肝细胞系L02;体外实验发现,干扰circ-PVT1表达可明显抑制肝癌细胞的增殖能力,并且对细胞周期分布产生显著影响。

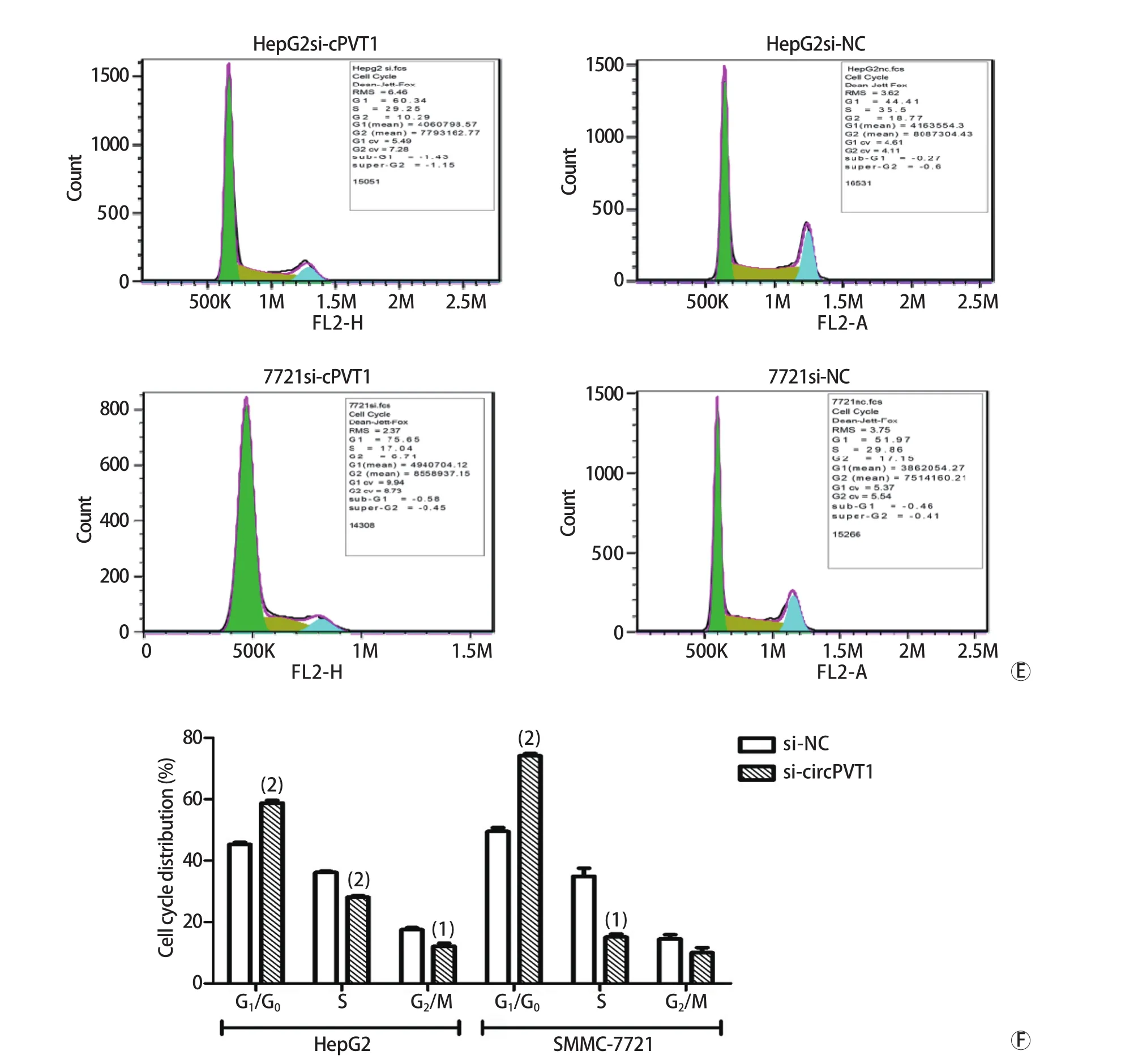
图3 siRNA干扰circ-PVT1表达对人肝癌细胞系HepG2、SMMC-7721增殖和细胞周期的影响Fig.3 Effects of circ-PVT1 on cell proliferation and cell cycle of HCC cell lines HepG2 and SMMC-7721 after treatment with sicirc-PVT1
综上所述,circ-PVT1不仅是HCC诊断的潜在生物标志物,而且可能会成为HCC中的一种新型增殖因子,但其在HCC发生发展过程中的具体作用机制还有待进一步研究阐明。
【参考文献】
[1] Torre LA, Bray F, Siegel RL, et al.Global cancer statistics, 2012[J].CA Cancer J Clin, 2015, 65(2): 87-108.
[2] Han D, Li J, Wang H, et al.Circular RNA circMTO1 acts as the sponge of microRNA-9 to suppress hepatocellular carcinoma progression[J].Hepatology (Baltimore, Md.), 2017, 66(4): 1151-1164.
[3] Wang S, Feng J, Chen YW, et al.Efficacy evaluation of laparoscopy assisted ultrasound guided radiofrequency ablation in the treatment of hepatocellular carcinoma beneath the diaphragm[J].Med J Chin PLA, 2017, 42(5): 452-455.[王松, 冯健, 陈永卫, 等.腹腔镜辅助超声引导下射频消融治疗膈顶部原发性肝细胞癌疗效评价[J].解放军医学杂志, 2017, 42(5): 452-455.]
[4] Memczak S, Jens M, Elefsinioti A, et al.Circular RNAs are a large class of animal RNAs with regulatory potency[J].Nature, 2013, 495(7441): 333-338.
[5] Li P, Chen S, Chen H, et al.Using circular RNA as a novel type of biomarker in the screening of gastric cancer[J].Clinica Chimica Acta, 2015, 444: 132-136.
[6] Shao Y, Li J, Lu R, et al.Global circular RNA expression profile of human gastric cancer and its clinical significance[J].Cancer Med, 2017, 6(6): 1173-1180.
[7] Bachmayr-Heyda A, Reiner AT, Auer K, et al.Correlation of circular RNA abundance with proliferation-exemplified with colorectal and ovarian cancer, idiopathic lung fibrosis, and normal human tissues[J].Scientific Reports, 2015, 5(1): 8057-8089.
[8] Chen J, Li Y, Zheng Q, et al.Circular RNA profile identifies circPVT1 as a proliferative factor and prognostic marker in gastric cancer[J].Cancer Letters, 2017, 388: 208-219.
[9] Cocquerelle C, Mascrez B, Hétuin D, et al.Mis-splicing yields circular RNA molecules[J].FASEB J, 1993, 7(1): 155-60.[10] Guo JU, Agarwal V, Guo H, et al.Expanded identification and characterization of mammalian circular RNAs[J].Genome Biol, 2014, 15(7): 409-439.
[11] Salzman J, Chen RE, Olsen MN, et al.Cell-type specific features of circular RNA expression[J].PLoS Genet, 2013, 9(9): e1003777.
[12] Ebbesen KK, Kjems J, Hansen TB.Circular RNAs: Identification, biogenesis and function[J].Biochim Biophys Acta, 2016, 1859(1): 163-168.
[13] Vicens Q, Westhof E.Biogenesis of circular RNAs[J].Cell, 2014, 159(1): 13-14.
[14] Hansen TB, Jensen TI, Clausen BH, et al.Natural RNA circles function as efficient microRNA sponges[J].Nature, 2013, 495(7441): 384-388.
[15] Ashwal-Fluss R, Meyer M, Pamudurti NR, et al.circRNA biogenesis competes with pre-mRNA splicing[J].Mol Cell, 2014, 56(1): 55-66.
[16] Long L, Huang G, Zhu H, et al.Down-regulation of miR-138 promotes colorectal cancer metastasis via directly targeting TWIST2[J].J Transl Med, 2013, 1(1): 275-284.
[17] Li F, Zhang L, Li W, et al.Circular RNA ITCH has inhibitory effect on ESCC by suppressing the Wnt/beta-catenin pathway[J].Oncotarget, 2015, 6(8): 6001-6013.
[18] Pan H, Li T, Jiang Y, et al.Overexpression of circular RNA ciRS-7 abrogates the tumor suppressive effect of miR-7 on gastric cancer via PTEN/PI3K/AKT signaling pathway[J].J Cell Biochem, 2018, 119(1): 440-446.
[19] Fu L, Chen Q, Yao T, et al.Hsa_circ_0005986 inhibits carcinogenesis by acting as a miR-129-5p sponge and is used as a novel biomarker for hepatocellular carcinoma[J].Oncotarget, 2017, 8(27): 43878-43888.
