舰船烟雾致吸入性肺损伤大鼠模型的建立及评价
2018-04-17段欣欣杨明张帆王成彬吕建新
段欣欣,杨明,张帆,王成彬,吕建新
舰船火灾是作战时经常遇到的情况,舰船内部非金属材料在燃烧时释放出大量的有毒气体、粉尘及颗粒物,舰员极易因吸入有毒气体而引发急性呼吸道和肺损伤,甚至发展为呼吸衰竭[1]。近年来,海军舰船大量新型复合材料的应用增加了烟雾成分的复杂性,主要包括CO、CO2、H2S、NOx等有害气体,有时甚至含有氯化氢、氯化氰、氰化氢等高毒性气体,对人体的危害比单一的有毒气体大得多,严重者可迅速致人死亡[2]。舰船火灾、爆炸事故已成为国内外研究的热点之一[3-5],但因其燃烧烟雾致肺损伤因素复杂,目前相关研究报道较少。若要进一步探索海军舰船烟雾导致的肺部损害的发病机制、药物预防及治疗效果评价,尚须构建稳定、可靠的动物模型。因此,本研究在课题组前期构建的火药烟雾致肺损伤分析平台基础上,构建了舰船烟雾致吸入性肺损伤大鼠模型,并对其进行评价。
1 材料与方法
1.1 实验动物 健康雄性Wistar大鼠,体重150~200g,由解放军总医院实验动物中心提供,合格证号SCXK(京)2016-0006。大鼠于动物中心清洁房中饲养,温度21~24℃,湿度50%~60%,昼夜12h节律,自由进食、饮水。
1.2 烟雾发生装置 自制烟雾吸入性损伤装置由发烟室和动物室两部分组成。两室中间有孔相通,发烟室内部安有风扇使烟雾均匀流通在整个装置。发烟室内径31cm×40cm×28cm,内置遥控电磁加热器、发烟铁盘、鼓风扇。动物室内径31cm×40cm×28cm,室壁的透视窗口用于观察动物烟熏后的状况,外部壁上安有烟雾检测仪监测装置内舰船烟雾的成分,包括O2、CO、CO2、H2S,遥控电磁炉开关、温湿度监控仪,用于实时监控发烟装置内的温度和湿度。整个实验过程温度保持在37℃左右。
1.3 发烟材料 聚双马(Ⅲ型)泡沫材料:主要组分为双马来酰胺聚合物;NH/福乐斯发泡橡塑绝热制品:主要组分为橡胶和塑料复合体;EA-100阻燃白胶:主要组分为胶黏剂、无机填料;LZN-1高性能阻尼材料:主要组分为橡胶、硫化剂、胶黏剂等;JYJPJ85/SC舰船用低烟无卤电缆:主要组分为聚乙丙烯塑料;WQF-2硅丙乳胶漆:主要组分为硅丙乳胶;装饰板:主要组分为铝板、木板、胶黏剂。将7种舰船非金属材料按一定用量比称量后剪成均匀小块,置于洁净的塑料袋中密封保存备用。
1.4 方法
1.4.1 动物分组及处理 42只Wistar大鼠随机分为对照组和致伤后2、6、12、24、48、72h组(n=6)。致伤组大鼠置于密闭的发烟箱中并在5g舰船材料产生的烟雾中暴露15min,致伤结束后回笼饲养。依据分组在相应时间点分别处死。对照组大鼠暴露于发烟箱的空气中15min,于暴露后72h处死。
1.4.2 致伤方法 取配比称量处理好的舰船材料放入发烟室的铁盘上,置于遥控电磁炉加热器上,关闭发烟室门,打开动物室门,放入要致伤的大鼠后关闭,检查装置气密情况,打开发烟装置总电源开关、气体成分分析仪、气体采样泵及温湿度监测器开关,使用遥控装置打开电磁炉加热器开关并将其调至最大功率档位,1min后可观察到发烟室内迅速充满烟雾,加热5min后关闭电磁加热器。待达到暴露时间后,打开动物室取出大鼠,置于空气中。
1.4.3 舰船材料量、大鼠暴露时间与死亡发生率的关系 固定舰船材料量为5g,烟熏时间为20min(由前期实验得出)。①将大鼠在固定的舰船材料量(5g)的条件下分别暴露不同时间(8、10、15、18、20min)。②将大鼠在固定烟熏时间(20min)的条件下分别暴露在不同的舰船材料量(3、5、8、10g)所产生的烟雾中。记录并分析整个烟熏过程及烟熏处理后3d内大鼠的生存状况。
1.4.4 烟雾中O2、CO、CO2、H2S浓度及温度检测采用澳洲新仪EM-4四合一气体检测仪检测舰船材料燃烧后5、10、18min时各气体成分的浓度及烟雾的温度。
1.4.5 致伤大鼠表现 观察大鼠在吸入烟雾过程中及致伤结束后的精神状态、活动情况、呼吸情况及发绀程度等。
1.4.6 动脉血气及凝血功能检测 在各相应时间点用10%水合氯醛(0.35ml/100g)腹腔注射麻醉大鼠,分离腹主动脉,取血1ml后处死大鼠,于30min内进行动脉血气分析。腹主动脉取血置于枸橼酸钠抗凝管中,待测凝血功能。
1.4.7 肺含水率检测 取右肺前叶,滤纸拭干表面血液,于电子天平上称重(湿重),后放入70℃烘箱烘烤48h至恒重,于电子天平称上称重(干重),计算肺含水率(%)。
1.4.8 肺组织病理学检查 打开胸腔后观察肺的大体改变,取右肺下叶浸入10%中性甲醛溶液中固定,石蜡包埋,常规HE染色后光镜下观察。
1.5 统计学处理 采用SPSS 17.0软件进行统计分析。计量资料以±s表示,多组间比较采用单因素方差分析(One-way ANOVA),进一步两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 舰船材料量、大鼠暴露时间与死亡率的关系固定舰船材料量为5g时,死亡率随暴露时间的延长而增加,暴露时间为8、10、15min时,3d内大鼠死亡率为0,暴露时间增至18min时,24h内大鼠死亡率上升达88.3%。固定暴露时间为20min时,舰船材料为3g时未见大鼠死亡,舰船材料为5g时,大鼠12h内死亡率为83.3%,舰船材料为8g时,大鼠6h内死亡率为83.3%,当舰船材料增至10g时,2h死亡率达到100%。固定舰船材料量、不同烟熏时间处理后大鼠生存状况及固定烟熏时间、不同舰船材料量处理后大鼠生存状况如表1所示。
2.2 烟雾中气体成分浓度及温度测定 5g舰船材料完全燃烧后形成的烟雾,在5、10、15、18min时,发烟箱中O2、CO、CO2、H2S浓度及温度差异无统计学意义(P>0.05,表2)

表1 烟熏时间及舰船材料量与大鼠死亡率的关系(%)Tab.1 The relationship between the smoking time, the material quantity of ship and the mortality of rats (%)
表2 舰船烟雾形成后不同时间点气体浓度、温度变化(±s,n=6)Tab.2 Variation of gas concentration and temperature at different time points after the formation of ship's smoke (±s,n=6)
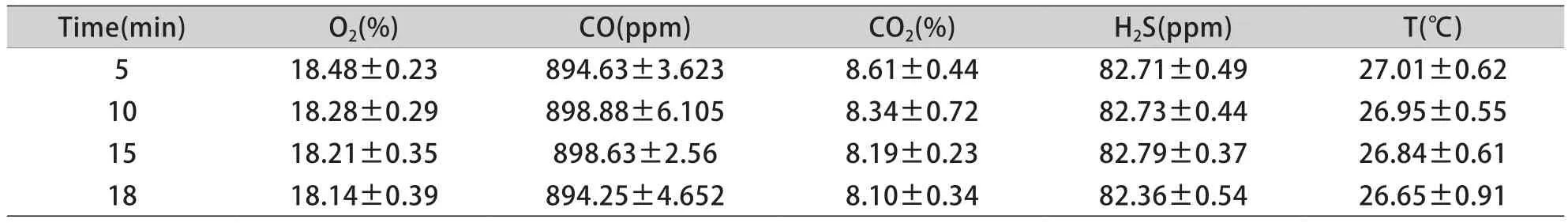
表2 舰船烟雾形成后不同时间点气体浓度、温度变化(±s,n=6)Tab.2 Variation of gas concentration and temperature at different time points after the formation of ship's smoke (±s,n=6)
CO.1ppm=2.86×10–8mol/L; H2S.1ppm=1.94×10–8mol/L
Time(min) O2(%) CO(ppm) CO2(%) H2S(ppm) T(℃)5 18.48±0.23 894.63±3.623 8.61±0.44 82.71±0.49 27.01±0.62 10 18.28±0.29 898.88±6.105 8.34±0.72 82.73±0.44 26.95±0.55 15 18.21±0.35 898.63±2.56 8.19±0.23 82.79±0.37 26.84±0.61 18 18.14±0.39 894.25±4.652 8.10±0.34 82.36±0.54 26.65±0.91
2.3 临床表现 实验结束时,对照组大鼠无异常,精神状况好,活动正常,反应灵敏,呼吸平稳,被毛光滑。致伤组大鼠烟熏过程中出现呼吸急促,张口呼吸;实验结束后可观察到口鼻分泌物增多,被毛湿润无光泽,并闻及喘鸣音,四肢、口唇部可见发绀。
2.4 肺含水率及动脉血气分析 大鼠吸入舰船烟雾后肺含水率逐渐升高,至6h达峰值,随后逐渐恢复正常。烟雾吸入性损伤的早期阶段常发生低氧血症,氧分压(PaO2)在烟雾吸入后2h达到最低值,之后逐渐恢复。二氧化碳分压(PaCO2)在烟雾吸入后开始逐渐上升,6h达到峰值,后逐渐降低恢复。碳氧血红蛋白(COHb)在烟雾吸入后2h达到峰值,随后逐渐恢复。氧合血红蛋白(oxyhemoglobin,O2Hb)在烟雾吸入后开始降低,2h降至最低值,后逐渐恢复;血氧饱和度(oxygen saturation,SO2)在烟雾吸入后逐渐降低,2h达最低值,随后逐渐恢复正常(表3)。
表3 动脉血气和肺含水率的变化(±s, n=6)Tab.3 The change of arterial blood gas and the lung water content (±s, n=6)
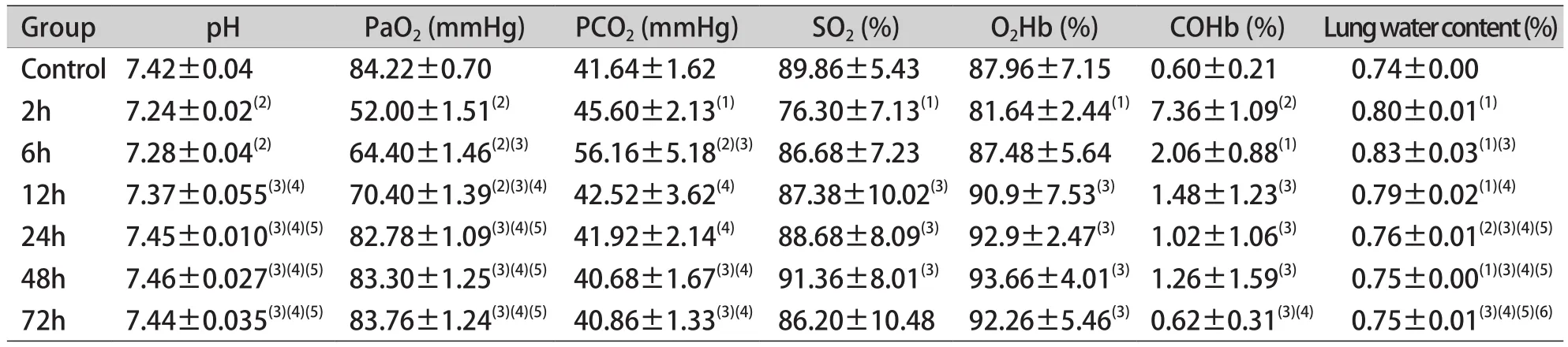
表3 动脉血气和肺含水率的变化(±s, n=6)Tab.3 The change of arterial blood gas and the lung water content (±s, n=6)
PaO2.Partial pressure of oxygen; PaCO2.Partial pressure of carbon dioxide; SO2.Oxygen saturation; O2Hb.Oxyhemoglobin; COHb.Carboxyhemoglobin; (1)P<0.05, (2)P<0.01 compared with control group; (3)P<0.05 compared with 2h group; (4)P<0.05 compared with 6h group; (5)P<0.05 compared with 12h group; (6)P<0.05 compared with 24h group
Group pH PaO2 (mmHg) PCO2 (mmHg) SO2 (%) O2Hb (%) COHb (%) Lung water content (%)Control 7.42±0.04 84.22±0.70 41.64±1.62 89.86±5.43 87.96±7.15 0.60±0.21 0.74±0.00 2h 7.24±0.02(2) 52.00±1.51(2) 45.60±2.13(1) 76.30±7.13(1) 81.64±2.44(1)7.36±1.09(2) 0.80±0.01(1)6h 7.28±0.04(2) 64.40±1.46(2)(3) 56.16±5.18(2)(3)86.68±7.23 87.48±5.64 2.06±0.88(1) 0.83±0.03(1)(3)12h 7.37±0.055(3)(4) 70.40±1.39(2)(3)(4) 42.52±3.62(4) 87.38±10.02(3)90.9±7.53(3) 1.48±1.23(3) 0.79±0.02(1)(4)24h 7.45±0.010(3)(4)(5)82.78±1.09(3)(4)(5) 41.92±2.14(4) 88.68±8.09(3) 92.9±2.47(3) 1.02±1.06(3) 0.76±0.01(2)(3)(4)(5)48h 7.46±0.027(3)(4)(5)83.30±1.25(3)(4)(5) 40.68±1.67(3)(4)91.36±8.01(3) 93.66±4.01(3)1.26±1.59(3) 0.75±0.00(1)(3)(4)(5)72h 7.44±0.035(3)(4)(5) 83.76±1.24(3)(4)(5) 40.86±1.33(3)(4) 86.20±10.48 92.26±5.46(3)0.62±0.31(3)(4) 0.75±0.01(3)(4)(5)(6)
2.5 凝血功能 大鼠在吸入舰船烟雾后,与对照组比较,2h时凝血酶原时间(PT)明显降低(P<0.05),48h时凝血酶时间(TT)明显降低(P<0.01),72h时纤维蛋白降解产物(FDP)明显降低(P<0.05);但各致伤时间点大鼠活化部分凝血活酶时间(APTT)、纤维蛋白原(FIB)、D-二聚体(D-D)和抗凝血酶 Ⅲ(ATⅢ)与对照组比较差异均无统计学意义(P>0.05,表4)。
2.6 肺组织病理学变化 肺大体观可见致伤组大鼠在烟雾吸入24h内两肺明显充血水肿,肺表面早期有针尖样出血点,部分可见多处斑片状出血,气管内有白色泡沫状液体,72h肺部仍有出血点;对照组大鼠两肺呈肉粉色,颜色均匀,未见肿胀、出血及坏死(图1)。光镜下观察可见致伤组大鼠在烟雾吸入2h后即出现出血、水肿,6h可见肺泡腔内漏出的红细胞、炎性细胞浸润,12h除红细胞、炎症细胞浸润外,同时出现肺泡腔增宽,间隔增厚,72h红细胞和炎症细胞减少(图2)。
表4 凝血功能的变化(±s,n=6)Tab.4 The changes of coagulation function(±s, n=6)
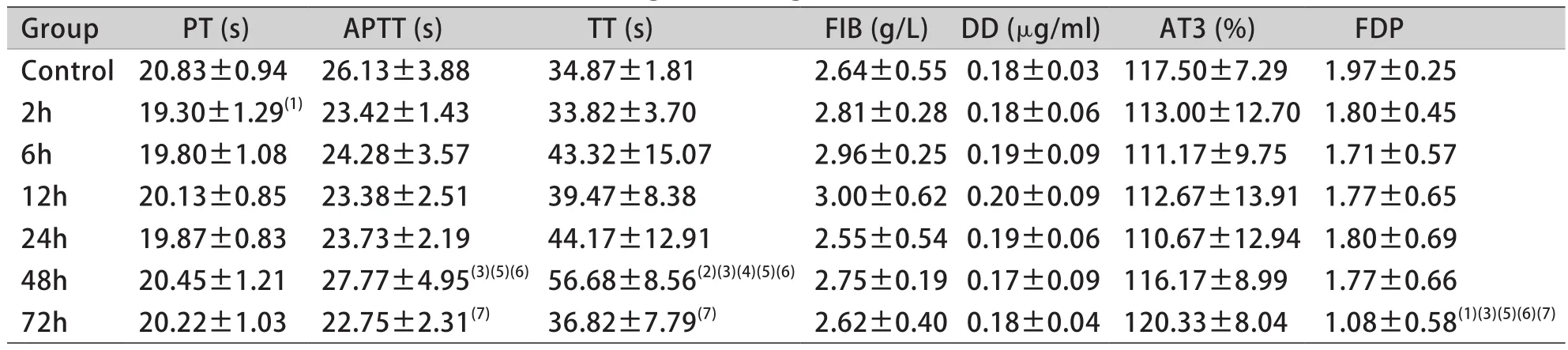
表4 凝血功能的变化(±s,n=6)Tab.4 The changes of coagulation function(±s, n=6)
PT.Prothrombin time; APTT.Activated partial thromboplastin time; TT.Thrombin time; FIB.Fibrinogen; DD.D-Dimer; AT3.Antithrombin Ⅲ; FDP.Fibrinogen degradation-product; (1)P<0.05, (2)P<0.01 compared with control group; (3)P<0.05 compared with 2h group; (4)P<0.05 compared with 6h group; (5)P<0.05 compared with 12h group; (6)P<0.05 compared with 24h group; (7)P<0.05 compared with 48h group; (8)P<0.05 compared with 72h group
Group PT (s) APTT (s) TT (s) FIB (g/L) DD (μg/ml) AT3 (%) FDP Control20.83±0.94 26.13±3.88 34.87±1.81 2.64±0.55 0.18±0.03 117.50±7.29 1.97±0.25 2h 19.30±1.29(1)23.42±1.43 33.82±3.70 2.81±0.28 0.18±0.06 113.00±12.70 1.80±0.45 6h 19.80±1.08 24.28±3.57 43.32±15.07 2.96±0.25 0.19±0.09 111.17±9.75 1.71±0.57 12h 20.13±0.85 23.38±2.51 39.47±8.38 3.00±0.62 0.20±0.09 112.67±13.91 1.77±0.65 24h 19.87±0.83 23.73±2.19 44.17±12.91 2.55±0.54 0.19±0.06 110.67±12.94 1.80±0.69 48h 20.45±1.21 27.77±4.95(3)(5)(6)56.68±8.56(2)(3)(4)(5)(6)2.75±0.19 0.17±0.09 116.17±8.99 1.77±0.66 72h 20.22±1.03 22.75±2.31(7) 36.82±7.79(7) 2.62±0.40 0.18±0.04 120.33±8.04 1.08±0.58(1)(3)(5)(6)(7)

图1 肺组织大体观Fig.1 Gross examination of the rat lungs

图2 肺组织病理学观察(HE×100)Fig.2 Histopathological observation of the lung tissues(HE×100)
3 讨 论
烟雾常见于火灾、战争等环境中,主要由大小不等的悬浮颗粒和有毒气体构成,成分较为复杂,多达250多种[5]。以往研究吸入性肺损伤模型所采用的发烟材料主要为干燥松木屑及煤油,且大鼠为麻醉后放入装置中进行烟雾吸入,麻醉状态下的大鼠呼吸及其他生理活动均减弱,对模型的结果会有较大影响。本研究采用自制烟雾吸入性损伤装置,在大鼠正常活动状态下,进行自主的烟雾吸入,排除麻醉及其他影响。本研究采用舰船内部7种非金属材料并按一定比例配制,模拟舰船燃烧环境,构建舰船烟雾致肺损伤大鼠模型,为进一步研究舰船烟雾致肺损伤奠定了基础。
烟雾吸入性损伤装置分为发烟室和动物室,二者相互独立,排除了舰船材料燃烧可能导致的其他致伤因素,确保烟雾吸入为单一的致伤因素;发烟室中产生的烟雾在风扇气流作用下均匀流通于整个装置;内置遥控电磁加热器,避免打开舱透视门导致每次燃烧条件的不一致;外部烟雾和温湿度检测仪的实时监测确保构建模型条件的一致性、可靠性及稳定性。此外,本装置体积较小,制作简单,便于推广应用。
本研究中,通过改变舰船材料的燃烧量和暴露时间,观察大鼠3d内的生存情况,发现大鼠死亡发生率随舰船材料量和暴露时间的增加而升高,当暴露时间为20min时,大鼠的半数致死量在5~8g之间,取5g舰船材料燃烧,暴露时间为18min,24h内死亡发生率为83.3%,暴露时间为15min,3d内未见大鼠死亡,最终选择5g舰船材料、暴露15min为致伤条件。
7种舰船非金属材料燃烧后的成分为主要包括CO、CO2、H2S、NOx等有害气体,有时甚至含有氯化氢、氯化氰、氰化氢等高毒性气体[7]。本研究中,烟雾产生15min内,CO、CO2、H2S等气体浓度和发烟装置中温湿度保持稳定。其中CO是由含碳化合物不完全燃烧所致,在所有的火灾中都有大量产生,对人体危害大,可致神经和血管毒性[8],同时也被证实是造成人员死亡的有毒气体[9]。含碳化合物完全燃烧形成CO2,有研究表明CO2也是导致肺部损伤的因素之一[10]。结合吸入不同浓度CO与中毒程度的关系[11],本研究采用密闭条件连续吸入烟雾制作舰船烟雾吸入性损伤模型。
本研究结果显示,在舰船烟雾吸入性肺损伤早期模型大鼠即可发生低氧血症,PaO2在烟雾吸入后2h达最低值,后逐渐恢复;PaCO2在烟雾吸入后开始升高,6h达到峰值。COHb是CO吸入后与血红蛋白结合而成,比与氧气结合能力高250倍[12],使血红蛋白失去输氧能力,导致肺部缺氧致伤,因此可认为是CO中毒的指标[13]。本研究中COHb含量在烟雾吸入后开始上升,2h达到峰值,随后开始逐渐下降。肺含水率是评价肺水肿较好的指标,也可反映肺微血管通透性,本模型中肺含水率的升高提示大鼠肺部微血管通透性增加,烟雾吸入后直接作用于气道,致血管内皮损伤,血管静水压增高,进而产生肺水肿,影响肺通气换气功能,进一步加重组织缺氧,启动肺部防御系统,刺激大量炎症因子释放,导致恶性循环。病理组织学光镜下观察可见致伤组大鼠肺组织在烟雾吸入2h后即出现出血、水肿,6h可见肺泡腔内漏出的红细胞、炎性细胞浸润,12h除红细胞、炎症细胞浸润外,同时出现肺泡腔增宽,间隔增厚,72h红细胞和炎症细胞减少。凝血功能检测结果显示,与对照组比较,PT于致伤2h(P<0.05)、TT于致伤48h(P<0.01)、FDP于致伤72h(P<0.05)明显降低,而各致伤时间点APTT、FIB、D-D、AT Ⅲ与对照组比较差异均无统计学意义,提示本模型中舰船烟雾吸入性损伤可能尚未引发大规模的凝血功能紊乱。
综上所述,使用本研究组自制的发烟装置,使大鼠在5g舰船材料所形成的烟雾中暴露15min能够成功构建吸入性肺损伤大鼠模型,模型可致肺部出血、水肿、气道炎性浸润,达到预期伤情,稳定且易于复制,且未致大鼠窒息死亡。本模型可根据不同实验要求进行调节,可进行细胞学实验,可改变舰船材料及比例等,适用于对舰船烟雾吸入性损伤早期发病机制及实验性治疗的研究。
【参考文献】
[1] Lee AS, Mellins RB.Lung injury from smoke inhalation[J].Paediatr Respir Rev, 2006, 7(2): 123-128.
[2] Xu LJ, Chen Q, Xiao CJ, et al.Qualitative analysis of the smoke composition of nonmetal materials of ships in combustion[J].J Navy Med, 2005, 26(1): 8-11.[许林军, 陈茜, 肖存杰, 等.舰艇用非金属材料燃烧时烟雾成分的定性分析[J].海军医学杂志, 2005, 26(1): 8-11.]
[3] Li XL, Shen Y, Lai XN, et al.Characteristics of brain injury induced by shock wave propagation in solids after underwater explosion in rats[J].Med J Chin PLA, 2016, 41(8): 689-693.[李新岭, 沈岳, 赖西南, 等.水下爆炸固体冲击波致大鼠脑损伤研究[J].解放军医学杂志, 2016, 41(8): 689-693.]
[4] Luo JH, Jiang YS, Chen LN.Characteristic and prevention as well as control of harmful gases causing by fire disaster in naval vessels chambers[J].J Navy Med, 2009, 30(2): 105-107.[罗江华, 蒋以山, 陈鲁宁.舰艇舱室火灾有害烟气的特性与防控研究[J].海军医学杂志, 2009, 30(2): 105-107.]
[5] Li YT, Cheng G, Liu S, et al.Experimental study on brain injury in Beagle dogs caused by adjacent cabin explosion in warship[J].Med J Chin PLA, 2017, 42(3): 234-238.[李彦腾, 程岗, 刘帅, 等.舰船邻舱爆炸致比格犬脑损伤的实验研究[J].解放军医学杂志, 2017, 42(3): 234-238.]
[6] Ballardcroft C, Sumpter LR, Broaddus R, et al.Ovine smoke/burn ARDS model: a new ventilator-controlled smoke delivery system[J].J Surg Res, 2010, 164(1): 155-162.
[7] Xu LJ, Xiao CJ, Chen Q, et al.Quantitative analysis of the smoke composition formed by the burning of seven nonmetal materials within the naval vessel[J].Chin J Naut Med Hyper Med, 2009, 16(2): 117-119.[许林军, 肖存杰, 陈茜, 等.舰艇舱室中7种非金属材料燃烧时烟雾中主要无机有害气体定量分析[J].中华航海医学与高气压医学杂志, 2009, 16(2): 117-119.]
[8] Dries DJ, Endorf FW.Inhalation injury: epidemiology, pathology, treatment strategies[J].Scand J Trauma Resus, 2013, 21(1): 1-15.
[9] Zhao J, Zhu MX, Lu YM.Toxic gases and poisoning mechanisms in fire smoke[J].Chin J Emergy Med, 2004, 13(7): 497-498.[赵杰, 朱明学, 陆一鸣.火灾烟雾中的有毒气体及中毒机制[J].中华急诊医学杂志, 2004, 13(7): 497-498.]
[10] Abolhassani M, Guais A, Chaumet-Riffaud P, et al.Carbon dioxide inhalation causes pulmonary inflammation[J].Am J Physiol Lung Cell Mol Physiol, 2009, 296(4): L657-L665.
[11] Li JX, Xia T, Qin WH, et al.The correlation analysis of indoor carbon monoxide concentration and chronic diseases[J].Int J Lab Med, 2015, 36(16): 2326-2328.[李金秀, 夏天, 秦卫华, 等.室内一氧化碳浓度与慢性疾病的相关性分析[J].国际检验医学杂志, 2015, 36(16): 2326-2328.]
[12] Gozubuyuk AA, Dag H, Kacar A, et al.Epidemiology, pathophysiology, clinical evaluation, and treatment of carbon monoxide poisoning in child, infant, and fetus[J].North Clin Istanb, 2017, 4(1): 100-107.
[13] Lange M, Cox RA, Enkhbaatar P, et al.Predictive role of arterial carboxyhemoglobin concentrations in ovine burn and smoke inhalation-induced lung injury[J].Exp Lung Res, 2011, 37(4): 239-245.
