lnc-MGC对高糖诱导的人腹膜间皮细胞转分化的影响
2018-04-17李欢何丽洁娄未娟王汉民
李欢,何丽洁,娄未娟,王汉民
腹膜透析(PD)是治疗终末期肾脏病(ESRD)的一种重要方法,而长期PD可使腹膜超滤功能下降甚至丧失,最终无法进行PD。因此,解决腹膜超滤功能下降或失败的机制是目前的研究热点[1]。研究发现干预间皮细胞转分化可延缓腹膜纤维化[2],而本实验组前期研究发现,MicroRNA-199a/214可以介导高糖引起的腹膜损伤和纤维化[3],血清反应因子(SRF)可通过snail信号通路促进高糖诱导的腹膜间皮细胞转分化[4],SRF/miR-143-3p信号通路参与高糖刺激引起人腹膜间皮细胞(HPMCs)的转分化[5], lncRNA-MALAT1参与高糖诱导腹膜间皮细胞转化[6]等,均提示高糖刺激可诱导腹膜间皮细胞转分化,并且是目前常用的成熟模型。长链非编码RNA(lncRNA)指的是长度超过200nt的RNA分子,它可参与多种生物学过程的调控,如基因沉默、染色体修饰以及转录的干扰等[7]。对于lncRNA的作用机制,目前有“microRNA海绵功能”假说,即lncRNA像海绵一样特异性吸附miRNA,竞争性抑制miRNA与自身靶基因的结合[8];此外,还有“长链非编码RNA 作为miRNA 产生的前体”的假说[8]。
Kato等[9]在2016年报道lnc-MGC参与了诱发糖尿病肾病的早期病变,并参与调节肾脏纤维化的发生,他们发现Chop基因敲除小鼠可通过lnc-MGC对下游miRNA簇进行负向调控。但目前尚无关于lnc-MGC参与高糖诱导的腹膜纤维化的报道。本研究通过观察lnc-MGC在高糖诱导的HPMCs转分化中的作用,为寻找干预或逆转腹膜纤维化可能的治疗靶点提供依据。
1 材料与方法
1.1 材料 HPMCs购自广州弗尔博生物科技有限公司,DMEM培养基、胎牛血清(FBS)均购自美国Hyclone公司,胰蛋白酶(Trypsin)购于澳大利亚Gibco公司,D型-葡萄糖购自美国Sigma公司,总RNA提取试剂、反转录试剂盒及Real-time PCR试剂盒、iso裂解液(DNAiso Reagent)均购自日本TaKaRa公司。调控lnc-MGC的慢病毒由上海汉恒生物科技有限公司设计并合成,引物由上海生工生物工程有限公司设计并合成。β-actin抗体购自中国Proteintech公司,E-钙黏素(E-Cadherin)抗体、抗α-平滑肌肌动蛋白(α-SMA)抗体、抗结缔组织生长因子(CTGF)抗体、抗Ⅰ型胶原蛋白(COL-1)抗体、抗Ⅲ型胶原蛋白(COL-3)抗体均购自英国Abcam公司,SDS-PAGE试剂盒及RIPA裂解液(强)购自碧云天生物技术有限公司,辣根酶标记山羊抗兔/小鼠抗体购自北京中杉金桥有限公司。
1.2 方法
1.2.1 HPMCs培养及传代 将HPMCs接种在25cm2的无菌培养瓶中,采用含10% FBS的DMEM培养基进行培养,置于37℃、5%CO2孵箱中,间隔24h更换培养液,待细胞铺满瓶底80%左右时进行传代。弃去培养液,采用未加FBS的DMEM 1~2ml冲洗瓶底培养基,弃去后每瓶加入胰蛋白酶1.0~1.5ml进行消化,显微镜下观察细胞形态由贴壁的不规则多边形变为规则的圆形并有大量细胞悬浮时加入含10% FBS的DMEM中和胰蛋白酶,终止消化过程;用无菌吸管轻轻吹打瓶底少量贴壁细胞,并收集入15ml离心管中,800r/min离心5min,加入培养基将细胞重悬,分别铺入2个25cm2培养瓶或6孔板中,置于孵箱培养。
1.2.2 实验分组 将HPMCs分为对照组和高糖组,对照组采用含10% FBS的DMEM培养,高糖组在对照组基础上待细胞完全贴壁后采用60mmol/L高糖培养基培养72h[10]。
1.2.3 总RNA提取 采用iso裂解液手工提取RNA(此方法比试剂盒提取的RNA浓度高),具体步骤为:取长满3.5cm2培养皿的细胞,PBS洗3次,加1ml的iso裂解液,静置冰上裂解3~5min后移入1.5ml EP管,加1/5体积氯仿混匀,4℃下12 000r/min离心30min,取上清(注意勿吸入蛋白),加等体积异丙醇混匀,4℃下12 000r/min离心15min,弃上清,加1ml无水乙醇,4℃下12 000r/min离心10min,弃上清后室温干燥,加适量无酶水稀释,测定总RNA的浓度及纯度。
1.2.4 反转录及Real-time PCR 按照说明配制20μl反应体系进行反转录:37℃ 15min,85℃ 3s,4℃ 60min,反转录成cDNA,置于4℃冰箱保存。按照说明配制20μl PCR反应体系,反应条件为:95℃ 30s;95℃ 5s,65℃ 30s,共40个循环。
1.2.5 总蛋白提取 取10cm2培养皿中培养好的待检细胞,用4℃预冷的1×PBS冲洗3次,根据细胞量,加入适量含蛋白酶抑制剂的RIPA细胞裂解液,静置于冰上裂解30min,期间可利用超声再次充分裂解细胞;将裂解液于4℃、12 000r/min离心10min,取上清放入1.5ml EP管中,并加入1/4体积的5×蛋白上样缓冲液,混匀置于100℃加热器中10min将蛋白变性,然后12 000r/min离心10min, –20℃保存。
1.2.6 Western blotting检测 将蛋白样品加入SDS凝胶中,加1×电泳液,恒压(浓缩胶80V,分离胶120V)电泳,结束后转膜。1×TBST配制10%牛奶封闭1h。1×TBST配制5%牛奶稀释一抗,加E-Cadherin抗体(1:1000)、抗α-SMA抗体(1:1000)、抗CTGF抗体(1:500)、抗COL-1抗体(1:1000)、抗COL-3抗体(1:1000)、β-actin抗体(1:2000),4℃摇床孵育过夜。次日,取出条带,1×TBST洗5min×3次。分别加入相应二抗(1:2000),室温孵育1h。1×TBST洗5min×3次。1:1配制显影液显影,Image Lab软件测量条带的灰度值。
1.2.7 lnc-MGC慢病毒转染 分别使用上调慢病毒和下调慢病毒对HPMCs进行转染。取对数生长期HPMCs,调整细胞浓度至5×104个/ml,每孔加1ml细胞悬液。24h后按感染复数(MOI)=30将慢病毒与培养基混匀,加入待转染细胞中,48h后更换常规液培养。荧光显微镜观察转染率约90%后将转染细胞接种于培养瓶中扩增。
1.3 miRBase数据库预测 采用miRBase数据库预测lncRNA下游相关miRNA靶分子,预实验结果发现Lnc-MGC相关的miRNA中miRNA126-3p表达较显著。
1.4 统计学处理 采用SPSS 19.0软件进行统计分析。计量资料以±s表示,两组间比较采用t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 高糖刺激后lnc-MGC及纤维化相关分子mRNA和蛋白的表达变化 Real-time PCR检测结果显示,与对照组比较,高糖刺激后lnc-MGC的表达明显增加(P=0.0074);E-Cadherin mRNA表达明显降低(P<0.05),而α-SMA、CTGF、COL-1、COL-3 mRNA表达明显升高(P<0.05),差异均有统计学意义(图1A)。Western blotting检测结果显示,高糖刺激后,纤维化相关分子E-Cadherin蛋白表达明显降低,而α-SMA、CTGF、COL-1、COL-3蛋白表达明显增加,蛋白表达变化趋势与mRNA相同,差异均有统计学意义(P<0.05,图1B)。

图1 高糖刺激后lnc-MGC及纤维化相关分子mRNA(A)和蛋白(B)表达的变化Fig.1 mRNA (A) and protein (B) expressions of lnc-MGC and fibrosis related molecules after high glucose (HG) stimulation
2.2 lnc-MGC慢病毒转染的影响
2.2.1 下调lnc-MGC对纤维化相关分子mRNA和蛋白表达的影响 Real-time PCR检测结果显示,转染下调慢病毒后,与对照组相比,lnc-MGC及α-SMA、CTGF、COL-1、COL-3 mRNA表达明显降低(P<0.05),E-Cadherin mRNA表达明显升高(P<0.05),差异均有统计学意义(图2A)。Western blotting检测结果显示,转染下调慢病毒后,α-SMA、CTGF、COL-1、COL-3蛋白表达明显降低,E-Cadherin蛋白表达明显升高,蛋白表达变化趋势与mRNA相同,差异均有统计学意义(P<0.05,图2B)。
2.2.2 上调lnc-MGC对纤维化相关分子mRNA和蛋白表达的影响 对HPMCs分别转染对照慢病毒及过表达慢病毒,Real-time PCR检测结果显示,与对照组相比,转染过表达病毒后,lnc-MGC、α-SMA、CTGF、COL-1、COL-3 mRNA表达明显升高(P<0.05),E-Cadherin mRNA表达明显降低(P<0.05),差异均有统计学意义(图3A)。Western blotting检测结果显示,转染过表达病毒后,α-SMA、CTGF、COL-1、COL-3蛋白表达明显升高,E-Cadherin蛋白表达明显降低,蛋白表达变化趋势与mRNA相同,差异均有统计学意义(P<0.05,图3B)。

图2 下调lnc-MGC对纤维化相关分子mRNA(A)和蛋白(B)表达的影响Fig.2 mRNA (A) and protein (B) expressions of fibrosis related molecules after down-regulating lnc-MGC
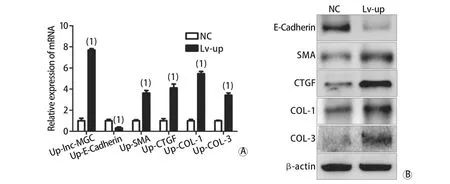
图3 上调lnc-MGC对纤维化相关分子mRNA(A)和蛋白(B)表达的影响Fig.3 mRNA (A) and protein (B) expressions of fibrosis related molecules after up-regulating lnc-MGC
2.3 lnc-MGC下游靶点预测 采用数据库miRBase预测得到lnc-MGC下游多个miRNA,其中在慢病毒转染后,miRNA126-3p有显著改变,因此考虑lnc-MGC可能对其具有调控作用。故采用Realtime PCR检测正常组、高糖刺激72h、慢病毒转染后的miRNA126-3p表达水平,结果显示,高糖组miRNA126-3p表达明显高于正常组(P<0.05)。与正常组相比,转染慢病毒下调lnc-MGC后,miRNA126-3p表达明显降低(P<0.05),而上调lnc-MGC后,miRNA126-3p表达则明显升高(P<0.05,图4)。
3 讨 论
在ESRD患者肾脏替代治疗中PD所占比例大于10%[11]。腹膜长期暴露于高糖腹透液中,可发生结构和功能的改变,并逐渐出现腹膜纤维化,进而导致PD功能丧失。因此,探讨腹膜纤维化发生发展的机制对行PD的患者来说具有非常重要的意义。目前研究发现lncRNAs与糖尿病肾病、肾小球疾病、急性肾移植排斥反应、肾细胞癌、急性肾损伤都有联系,例如lncRNA-H19可对抗预防肾纤维化[12],lncRNA-MALAT1可调节SAA3、IL-6和TNF等炎症因子的表达[13],lncRNA-H19参与上皮细胞和间皮细胞之间相互转化的异常调节[14], lncRNA-Arid2IR参与了肾脏炎症和纤维化的过程[15],LINC01619在糖尿病肾病中可调节miR-27a/FOXO1介导的内质网应激和足细胞损伤[16]。lncRNA调控miRNA参与细胞表型转化的机制在腹透研究中尚未见报道,但目前在肝癌[17]、肝内胆管癌[18]、胰腺癌[19]、鼻咽癌[20]等研究中已有报道。本研究组已发现的参与腹膜间皮细胞转分化的分子有lncRNA-H19、lncRNA-MALAT1[6],而最新研究发现上调lncRNA-ATB的表达可促进HPMCs表型转换及增殖[21]。目前这类分子已引起该领域很多学者的关注[22],并不断取得新的进展,但有关该类分子在腹膜透析中的研究较少。
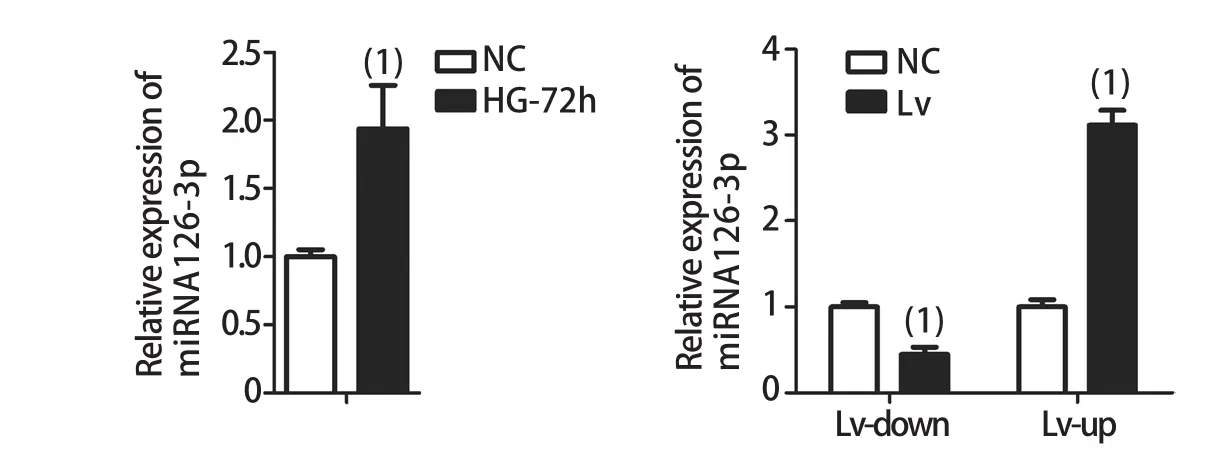
图4 高糖刺激及慢病毒转染后miRNA126-3p的表达变化Fig.4 Expression of miRNA126-3p after high glucose stimulation and lentivirus transfection
本研究结果显示,调控上游lncRNA可改变纤维化相关标志物的表达,下游miRNA126-3p可以被正向调控,提示lnc-MGC可通过调控miRNA126-3p来影响腹膜间皮细胞的转分化。因而本实验假设与上述“海绵假说”[8]不同。可假设认为lncRNA为miRNA的前体[8],在成熟过程中剪切产生miRNA,miRNA进而调控下游蛋白发挥作用,影响HPMCs转分化的过程,影响腹膜纤维化进展。但lnc-MGC通过何种下游靶蛋白来调控纤维化进展,调控或阻断miRNA126-3p后是否会影响下游靶蛋白,其影响与调控lnc-MGC影响纤维化相关蛋白变化有什么区别,以及对腹膜纤维化进展的影响仍需进一步研究。本课题组下一步将使用双荧光素酶报告基因来进一步验证二者的关系。
综上,本研究结果表明,lnc-MGC在HPMCs转分化及纤维化中可能发挥着一定的作用,lnc-MGC可通过调控miRNA126-3p来影响腹膜间皮细胞的转分化,有可能成为干预或逆转腹膜纤维化治疗的重要靶点之一。
【参考文献】
[1] Che MW, Li FR, Gong LF, et al.Effects of protein PUMA-α on the apoptosis and fibrosis of human peritoneal mesothelial cells induced by high glucose[J].Med J Chin PLA, 2017, 42(9): 781-787.[车明文, 李凤容, 龚莉芳, 等.PUMA-α蛋白在高糖诱导的人腹膜间皮细胞凋亡及纤维化中的作用[J].解放军医学杂志, 2017, 42(9): 781-787.]
[2] Yanez-Mo M, Lara-Pezzi E, Selgas R, et al.Peritoneal dialysis and epithelial-to-mesenchymal transition of mesothelial cells[J].Engl J Med, 2003, 348(5): 403-413.
[3] Che M, Shi T, Feng S, et al.The microRNA-199a/214 cluster targets E-cadherinherin and claudin-2 and promotes high glucose-induced peritoneal fibrosis[J].J Am Soc Nephrol, 2017, 28(8): 2459-2471.
[4] He L, Lou W, Ji L, et al.Serum response factor accelerates the high glucose-induced Epithelial-to-Mesenchymal Transition (EMT) via snail signaling in human peritoneal mesothelial cells[J].PLoS One, 2014, 9(10): e108593.
[5] Che MW, Hu JP, Tang YW, et al.The role of miRNA-143-3p in epithelial-to-mesenchymal transition of human peritoneal mesothelial cells[J].Chin J Cell Mol Immunol, 2015, 31(4):496-499.[车明文, 胡晋平, 唐亚为, 等.MiRNA-143-3p在人腹膜间皮细胞转分化过程中的作用及机制[J].细胞与分子免疫学杂志, 2015, 31(4): 496-499.]
[6] Shi TT, He LJ, Sun SR, et al.Role of long noncoding RNAMALAT1 in human peritoneal mesothelial cells fibrosis induced with high glucose[J].Chin J Kidney Dis Invest (Electron Ed), 2016, 5(3): 128-134.[石田田, 何丽洁, 孙世仁, 等.长链非编码RNA-MALAT1在高糖诱导的人腹膜间皮细胞纤维化过程中的作用[J].中华肾病研究电子杂志, 2016, 5(3): 128-134.]
[7] Xia T, Xiao BX, Guo JM.Acting mechanisms and research methods of long noncoding RNAs[J].Hereditas, 2013, 35(3): 269-280.[夏天, 肖丙秀, 郭俊明.长链非编码RNA的作用机制及其研究方法[J].遗传, 2013, 35(3): 269-280.]
[8] Chen XM, Zhang DD, Luo JJ, et al.Research progress on long noncoding RNAs[J].Prog Biochem Biophys, 2014, 41(10): 997-1009.[陈晓敏, 张栋栋, 骆健俊, 等.长非编码RNA研究进展[J].生物化学与生物物理进展, 2014, 41(10): 997-1009.]
[9] Kato M, Wang M, Chen Z, et al.An endoplasmic reticulum stress-regulated LncRNA hosting a microRNA mega cluster induces early features of diabetic nephropathy[J].Nat Commun, 2016, 7: 12864.
[10] Yu MA, Shin KS, Kim JH, et al.HGF and BMP-7 ameliorate high glucose-induced epithelial-to-mesenchymal transition of peritoneal mesothelium[J].J Am Soc Nephrol, 2009, 20(3): 567-581.
[11] Grassmann A, Gioberge S, MoeIler S, et al.ESRD patients in 2004: global overview of patient numbers, treatment modalities and associated trends[J].Nephrol Dial Transplant, 2005, 20 (12): 2587-2593.
[12] Xie H, Xue JD, Chao F, et al.Long non-coding RNA-H19 antagonism protects against renal fibrosis[J].Oncotarget, 2016, 7(32): 51473-51481.
[13] Puthanveetil P, Chen S, Feng B, et al.Long non-coding RNA MALAT1 regulates hyperglycaemia induced inflammatory process in the endothelial cells[J].J Cell Mol Med, 2015, 19(6): 1418-1425.
[14] Kanwar YS, Pan X, Lin S, et al.Imprinted mesodermal specific transcript (MEST) and H19 genes in renal development and diabetes[J].Kidney Int, 2003, 63(5): 1658-1670.
[15] Zhou Q, Huang XR, Yu J, et al.Long noncoding RNA Arid2IR is a novel therapeutic target for renal inflammation[J].Mol Ther, 2015, 23(6): 1034-1043.
[16] Bai X, Geng J, Li X, et al.Long non-coding RNA LINC01619 regulates miR-27a/FOXO1 and endoplasmic reticulum stressmediated podocyte injury in diabetic nephropathy[J].Antioxid Redox Signal, 2018.[Epub ahead of print].
[17] Ye P, Wang T, Liu WH, et al.Enhancing HOTAIR/MiR-10b drives normal liver stem cells toward a tendency to malignant transformation through inducing epithelial- to-mesenchymal transition[J].Rejuvenation Res, 2015, 18(4): 332-340.
[18] Zhang S, Xiao J, Chai Y, et al.LncRNA-CCAT1 promotes migration, invasion, and EMT in intrahepatic cholangiocarcinoma through suppressing miR-152[J].Dig Dis Sci, 2017, 62(11): 3050-3058.
[19] Zhao L, Sun H, Kong H, et al.The Lncrna-TUG1/EZH2 axis promotes pancreatic cancer cell proliferation, migration and EMT phenotype formation through sponging mir-382[J].Cell Physiol Biochem, 2017, 42(6): 2145-2158.
[20] Lu Y, Li T, Wei G, et al.The long non-coding RNA NEAT1 regulates epithelial to mesenchymal transition and radioresistance in through miR-204/ZEB1 axis in nasopharyngeal carcinoma[J].Tumour Biol, 2016, 37(9): 11733-11741.
[21] Che MW, Gong X, Zhang XJ, et al.Effects of LncRNA-ATB on human peritoneal mesothelial cells phenotypic transition and proliferation induced by high glucose[J].Med J Chin PLA, 2017, 42(11): 985-991.[车明文, 龚翔, 张小金, 等.LncRNAATB在高糖诱导的人腹膜间皮细胞表型转换及增殖中的作用[J].解放军医学杂志, 2017, 42(11): 985-991.]
[22] Wang ZY, Jiang FQ, Xu BX, et al.Effect of rotary cell culture system-simulated microgravity environment on the expression of lncRNA in mouse fibroblasts[J].Med J Chin PLA, 2017, 42(10): 876-882.[王占宇, 姜福全, 徐冰心, 等.旋转细胞培养系统模拟微重力环境对小鼠成纤维细胞lncRNA表达的影响[J].解放军医学杂志, 2017, 42(10): 876-882.]
