668例药品不良反应报告
2018-04-17孙国平王海飞
孙国平,王海飞
(南京市高淳人民医院药剂科,江苏 南京 211300)
*主管药师。研究方向:药事管理和临床药学研究。E-mail:sgp484320@163.com
#通信作者:主管药师。研究方向:临床药学。E-mail:rebirth_haifeisi@163.com
药品不良反应(adverse drug reaction,ADR)是指合格药品在正常用法与用量下出现的与用药目的无关的有害反应,对ADR进行监测可以了解其发生特点,以避免或减少其发生[1-2]。南京市高淳人民医院(以下简称“我院”)自2005年起开展ADR监测工作,已建立院内ADR上报系统,将其作为合理用药的重要工作内容之一[3]。现对我院近年来上报的ADR报告进行回顾性分析,为临床安全用药提供依据。
1 资料与方法
收集2016—2017年我院上报国家药品ADR监测系统的ADR报告668例,采用Excel软件对发生ADR患者的年龄和性别、ADR累及器官和(或)系统及临床表现、ADR涉及的药物类别和给药途径及引发ADR的抗菌药物类别进行统计分析;统计同期出院总病例数及性别分布,计算不同年龄段、不同性别患者的ADR发生率,不同年龄段或不同性别患者ADR发生率=ADR病例数/同期出院总病例数,进行Pearsonχ2检验,P<0.05表示差异有统计学意义,P<0.01表示差异有极显著统计学意义;统计不同抗菌药物的用药频度(defined daily dose system,DDDs),不同类别抗菌药物致ADR发生率=引发ADR病例数/该类抗菌药物DDDs。
2 结果
2.1 ADR级别分布
668例ADR中,新的ADR 56例(占8.38%),严重的ADR 29例(占4.34%);考虑为联合用药引起的ADR有37例(占5.54%)。
2.2 不同年龄段发生ADR患者的性别分布
668例发生ADR的患者中,男性336例,女性332例。同期出院总病例数为85 327例,计算得出男性患者ADR发生率为0.87%,明显高于女性患者的0.71%,差异有统计学意义(χ2=6.801,P<0.05);≥65岁患者254例,其ADR发生率为0.99%,明显高于其他组,差异有极显著统计学意义(χ2=20.138,P<0.01);15~<45岁女性患者85例,其ADR发生率为0.43%,明显低于同年龄段男性患者(χ2=14.225,P<0.01),也明显低于其他年龄段女性患者(χ2=37.143,P<0.01),差异均有极显著统计学意义,见表1。
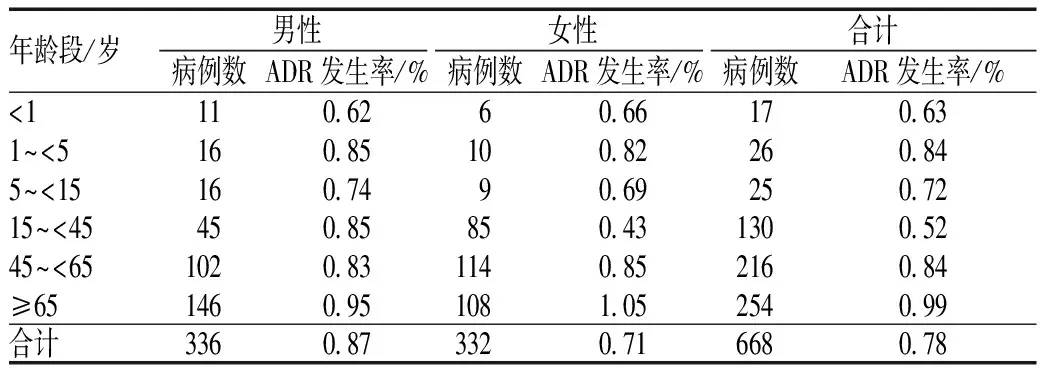
表1 不同年龄段发生ADR患者的性别分布Tab 1 Distribution of gender and age in ADR cases
2.3 发生ADR的给药途径分布
668例ADR中,静脉滴注给药发生的ADR最多,其次为口服给药,见表2。

表2 发生ADR的给药途径分布Tab 2 Distribution of ADR-inducing route of administration
2.4 ADR累及器官和(或)系统及临床表现
668例ADR累及器官和(或)系统合计728例次,主要为皮肤及其附件,其次为消化系统和全身性,见表3。
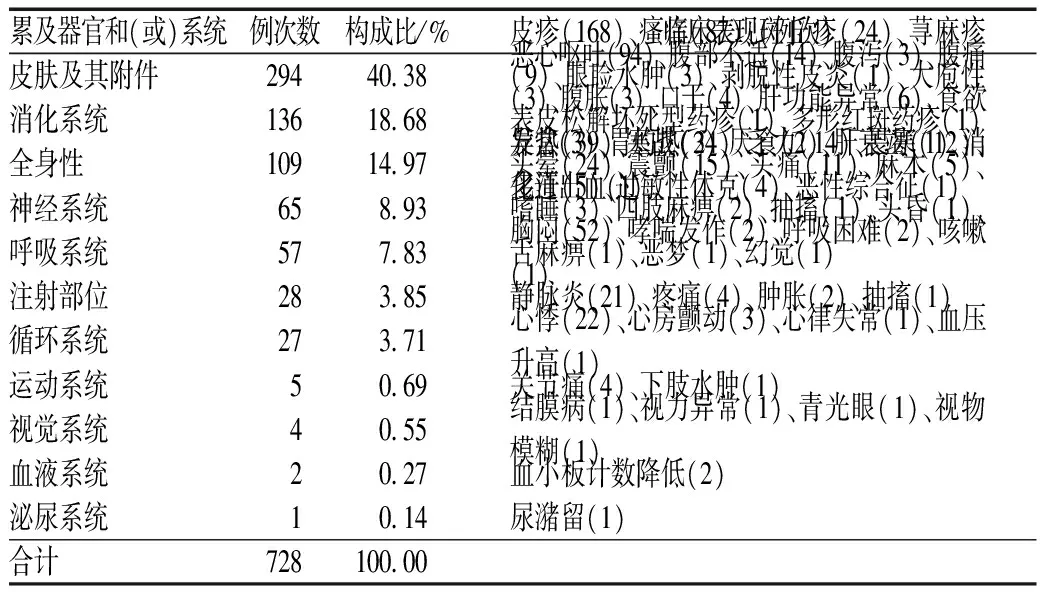
表3 ADR累及器官和(或)系统及临床表现Tab 3 ADR involved organs and (or) systems and clinical manifestation
注:部分ADR累及多个器官和(或)系统,故合计例次数>688
Note:some ADR may involve multiple organs and (or) systems, so the total number of cases>688
2.5 发生ADR的药物种类分布
668例ADR共涉及14类药物,主要为抗微生物药(其中抗菌药物致ADR 286例),其次为中成药,见表4。
2.6 发生ADR的抗菌药物种类分布及其发生率
286例抗菌药物致ADR中,氟喹诺酮类引发ADR病例数最多,其次为头孢菌素类;碳青霉烯类的ADR发生率最高,其次为氟喹诺酮类,见表5。
3 讨论
本调查结果显示,男性患者ADR发生率高于女性,与Shepherd等报道的男性较女性更易发生ADR一致[4]。考虑与男性工作生活压力大,酗酒、吸烟等不良习惯较女性多有关。目前,我国ADR报告分析在男性与女性ADR病例数方面存在差异,有文献报道,女性由于存在月经生理周期,感官较男性敏感,其发生ADR的病例数较男性多[1-2,5]。本调查中,发生ADR患者中,男女之比为1 ∶0.96,男性患者略多于女性患者。另外,老年人由于肝肾功能减退,药物代谢、消除减慢,容易发生药物及其代谢产物蓄积,从而导致其ADR发生率较高。本调查中,≥65岁患者ADR发生率高于其他年龄段。而15~<45岁女性患者ADR发生率显著低于同年龄段男性患者和不同年龄段女性患者,考虑其主要原因为该年龄段妊娠及围产期妇女较多,产前住院观察不用药或用药较少,产后用药也较少,故其ADR发生率较低。
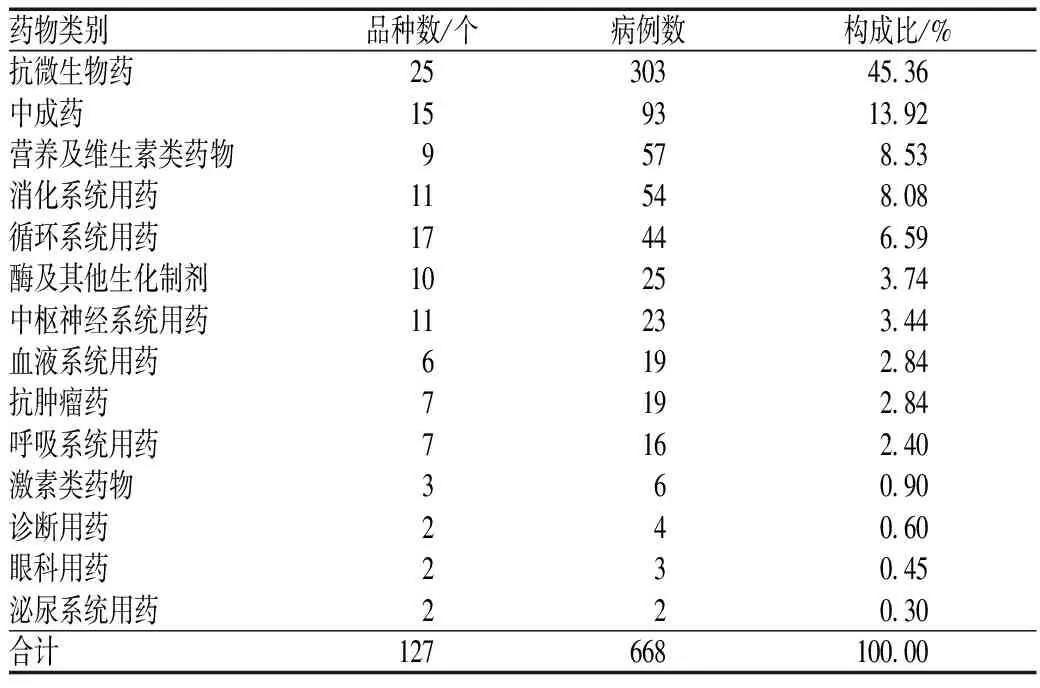
表4 发生ADR的药物种类分布Tab 4 Distribution of ADR-inducing drug categories
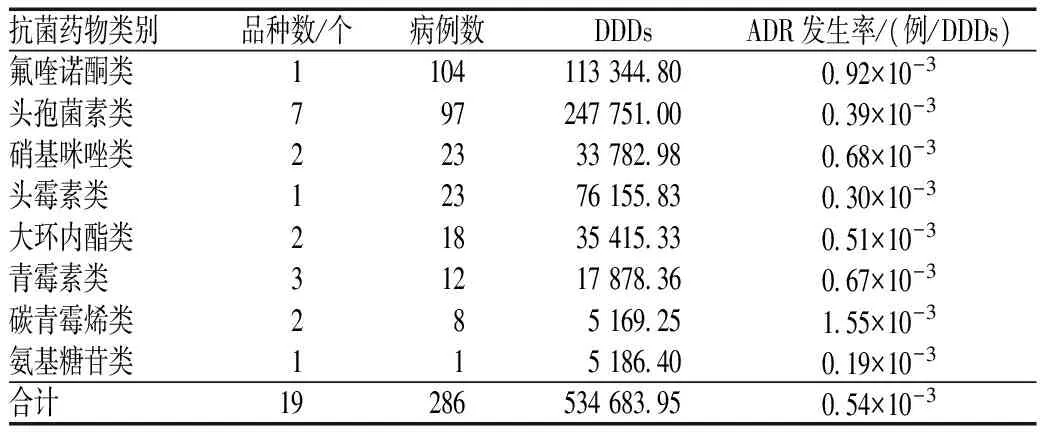
表5 发生ADR的抗菌药物种类分布及其发生率Tab 5 Distribution of ADR-inducing antibiotics and its incidence
由表3可见,ADR主要为皮肤及其附件损害、消化系统损害及全身性反应。(1)皮肤及其附件损害主要表现为皮疹、瘙痒,其临床观察较为直观,故上报较多。另有4例严重皮疹,分别为卡马西平片致多形红斑药疹、剥脱性皮炎、大疱性表皮松解坏死型药疹各1例及别嘌醇致严重皮疹1例。这2种药物多长期使用,药师在发药交代时应提醒患者发生皮疹时及时就诊。(2)消化系统损害主要表现为恶心呕吐。应引起注意的是,1例有乙型病毒性肝炎病史患者使用泼尼松片20 mg/d及硫唑嘌呤片、泼尼松片10 mg/d及以上剂量持续4周,上述药品为高风险免疫抑制剂,引起乙型肝炎病毒再激活的可能性>10%,应预防性给予核苷(酸)类似物[6],而该患者未预防性使用抗乙型肝炎病毒药,发生乙型肝炎病毒再激活致肝衰竭死亡。(3)全身性反应中,严重的ADR多为过敏性休克。应引起注意的是,1例为奥氮平引发的恶性综合征,该患者在初期出现高热等症状,误为肺部感染,提示临床需对使用抗精神病药的高热患者加强鉴别[7]。
《国家药品不良反应监测年度报告(2014年)》指出,按给药途径统计,静脉注射给药致ADR病例数占57.8%。我院静脉滴注给药致ADR病例数占85.78%,与相关报告相似[2,8-9]。静脉给药后药物直接进入血液循环,没有口服剂型的肝脏首过效应,生物利用度较高,医师和患者多认为其起效迅速,故在我国的使用率较高[10]。但注射剂中的内毒素、不溶性微粒,药物配置时的环境污染,药物使用时的侵入性及给药速度过快等原因均可能导致ADR发生[9]。
由表4可见,发生ADR病例数排序居前3位的药物分别为抗微生物药、中成药和营养及维生素类药物。抗微生物药致ADR病例数最多,考虑与医院感染性疾病患者较多导致抗菌药物使用率较高、使用量较大有关。抗菌药物中,氟喹诺酮类抗菌药物致ADR病例数最多,其ADR发生率也较高。氟喹诺酮类抗菌药物无需皮试,抗菌作用强,临床较常用,其致ADR的报道也较多[11-12]。尤其是老年患者,其肌酐清除率降低,肾功能减退,更易发生相关ADR,故应根据肌酐清除率调整氟喹诺酮类抗菌药物的剂量。本调查中,老年患者用药多未进行剂量调整,是导致氟喹诺酮类抗菌药物的ADR发生率高的原因之一。头孢菌素类抗菌药物的ADR发生率较低,但由于用量大,其致ADR病例数排序居第2位。头孢菌素类药物的ADR多为过敏反应,但由于其皮试符合率低,关于其是否需进行皮试国内尚无定论。《头孢类抗菌药物皮肤过敏试验专家共识》建议,药品说明书规定需进行皮试的必须进行皮试,未明确规定的,则依据患者过敏史及疾病状态等决定[13]。本调查中,碳青霉烯类抗菌药物的ADR发生率最高,其原因可能为碳青霉烯类为特殊使用级抗菌药物,使用者均为严重感染患者,机体状态差,且联合用药多,易发生ADR。
本调查中,发生ADR的中成药剂型均为注射剂。中药注射剂发生ADR的原因主要有:其组方和成分较为复杂,尤其是一些复方制剂,多含大分子物质[14];不同厂家在提取和生产过程中控制杂质的水平不同;加入药用辅料可能与中药提取物形成杂质[15];其在储存过程中易发生变化,在临床使用中与输液配伍可能导致不溶性微粒增加[15]。临床的不合理应用也会导致ADR的发生,如中成药与其他药物配伍使用、使用药品说明书规定之外的溶剂等均可能导致药物性状改变,影响其安全使用。此外,多数中成药的药品说明书中ADR项为“尚不明确”,患者和部分医师缺乏对中成药安全性的认知,导致中成药使用较多或发生ADR而不怀疑为中成药所致使ADR进一步加重等。为减少中成药致ADR的发生,应从多方面着手:医院应加强对中成药的管控,如我院注射用复方甘草酸铵2个月内连续发生3例过敏性休克,经药事管理与药物治疗学委员会讨论后停用该药;医师开具中成药时应严格遵循中医辨证论治原则;护师在配置中成药注射剂型时应现配现用等。此外,上级监管部门也应督促药品生产厂家根据中成药的ADR上报情况修改药品说明书。
综上所述,ADR的发生与多种因素有关,无法准确预测。临床应注意: 能使用口服药物治疗的先口服治疗,尽量减少使用注射剂;老年人用药应根据其肝肾功能进行适当减量;严格把握中成药注射剂的适应证,不得超说明书用药,以降低ADR发生率。医务人员应加强学习,加强对ADR的认识与鉴别,避免人为疏漏造成ADR乃至严重的ADR发生。
[1]钱先中,金惠静,杨娟,等.药品不良反应报告分析[J].中国医药,2015,10(4):573-577.
[2]孙美玲,李志荃,徐存军.医院药物不良反应分析[J].中国医药,2015,10(11):1683-1687.
[3]史红军,王海飞,翟文婷.某院药事管理与学科建设工作对合理用药的效果评价[J].抗感染药学,2015,12(2):235-236.
[4]Shepherd G,Mohorn P,Yacoub K,et al.Adverse drug reaction deaths reported in United States vital statistics,1999-2006[J].Ann Pharmacother,2012,46(2):169-175.
[5]王崇薇,刘琳琳,孙言才,等.某三甲医院2005—2011年10097例药品不良反应报告分析[J].安徽医药,2013,17(1):162-165.
[6]王贵强,王福生,成军,等.慢性乙型肝炎防治指南:2015年版[J].中华实验和临床感染病杂志:电子版,2015,9(5):570-589.
[7]王海飞.多巴丝肼与奥氮平及氯丙嗪合用致抗精神病药恶性综合征[J].药物不良反应杂志,2015,17(1):67-68.
[8]马洪峰.我院383例药品不良反应回顾分析[J].安徽医药,2013,17(1):165-166.
[9]李家田.162例药品不良反应报告分析[J].中国医院用药评价与分析,2013,13(10):938-941.
[10]傅明强,向会,陆萍,等.住院患者注射剂临床应用横断面调查[J].临床合理用药杂志,2015,8(16):93-95.
[11]李星如,毕凤兰.浅析氟喹诺酮类药物的安全性现状[J].中国药物警戒,2013,10(1):44-46.
[12]郭会娟.178例氟喹诺酮类抗菌药物致药物不良反应分析及合理应用[J].临床合理用药杂志,2015,8(33):170-171.
[13]赵志刚.头孢类抗菌药物皮肤过敏试验高端论坛专家共识[J].临床药物治疗杂志,2008,6(4):1-2.
[14]苗明三,李艳,祝侠丽,等.中药注射剂临床应用中存在的问题及安全应用策略[J].中国药师,2015,18(10):1739-1743,1746.
[15]杨小骏,谢海棠,汪慧芳.176例新的、严重的药品不良反应报告分析[J].中国药房,2014,25(14):1301-1303.
