犬DEA1. 1 血型抗原保存的研究
2018-04-16朱雨凝姜忠玲丰艳妮曹荣峰田文儒李华涛
朱雨凝, 丛 霞, 姜忠玲, 丰艳妮, 曹荣峰, 田文儒, 李华涛
(青岛农业大学动物医学院, 山东 青岛266109)
血型(Blood groups)是指由基因控制的血液各成分的表面抗原在个体间存在的差异。 目前发现的犬血型系统已超过12 个,经国际标准确定的主要的犬血型为8 种[1]。 近些年来,由于人们对犬血型系统和血型鉴定方法的研究不断进步,使得临床上犬输血疗法的使用范围和数量不断扩大,尤其是DEA1.1 血型(Dog erythrocyte antigen 1.1,DEA1.1)对于犬的临床输血具有重要意义[2]。 然而在我国的动物疾病诊疗中,由于缺乏用于犬血型分型以及针对供血与受血动物血型的检测方法,大大增加了因血型不合引起的输血风险。
目前,在兽医临床上缺乏准确、简便且低价的犬血型鉴定试剂。 由于红细胞常规保存方法较短,针对多种不同血型的红细胞又很难收集并用于免疫血清和单克隆抗体的筛选,我国兽医临床对犬血型检测与鉴定的研究很少,关于犬血型DEA1.1 抗原生化特性的研究几近空白,目前还不能通过常规分子生物学方法获得较大量犬血型抗原。 杜国浩[3]等用犬体免疫犬DEA1.1 血型阳性红细胞的方法成功制备犬DEA1.1 血型多克隆血清,这种血清不但可以避免大量的非血型抗原的影响,并且产生的多克隆抗血清能够用于犬DEA1.1 血型鉴定。本研究在其研究基础上,应用甘油冻存、醛化固定等处理方法探索相对合适的犬DEA1.1 血型抗原保存方法,为犬的血型鉴定和制备犬DEA1.1 血型检测抗体提供依据。
1 材料与方法
1.1 材料和试剂 犬血液样本分别从广州、东莞、深圳和佛山流浪犬收留中心以及多个动物医院采集,并 按 照 QuickVet®/RapidVet Canine DEA1.1 Blood Typing Test(美国dmslaboratories)说明书对犬DEA1.1 血型进行检测。 多聚甲醛,戊二醛,甲醛,均购自Sigma 公司。 EDTA 抗凝真空采血管,购自福州长庚医疗器械有限公司。 犬DEA1.1 血型多克隆血清由杜国浩[3]等人制备。
1.2 犬红细胞甘油化冻存 采集抗凝血,将全血在3 000 r /min(4℃)离心12 min,制备成浓缩红细胞。 然后配制浓度分别为3%、6%、10%、20%、30%和40%(w/v)的甘油溶液。 取血型检测后的DEA1.1 阴阳性犬红细胞两等份,均分后分别与3%、6%、10%、20%、30%和40%(w/v)的甘油溶液以1 ∶3 的比例混匀,摇床内混匀,离心,弃上清[4]。 甘油化处理后的红细胞一份放入含有异丙醇的细胞冻存盒里再放入-20 ℃冰箱里冻存(程序降温组),另一份直接放入-20 ℃冰箱里冻存(快冻组)。
1.3 犬红细胞去甘油化及质量检测 采用依次递减甘油浓度的梯度离心洗涤法,用0.9% 氯化钠溶液、9% 氯化钠溶液经反复洗涤6 ~7 次后,以适量生理盐水悬浮红细胞,制备解冻脱甘油洗涤红细胞[5]。
1.3.1 犬甘油化红细胞溶血率、回收率和形态学检测 用生物显微镜作细胞计数,甘油化后红细胞回收率=(冻存后去甘油化红细胞总数/冻存前去甘油化红细胞总数) ×100%,并在光学显微镜下观察红细胞颜色、形态特征、大小、有无粘附、破损率、折光性等物理性状并肉眼观察其溶血情况以评价甘油化红细胞[6]。
1.3.2 犬甘油化红细胞血型抗原滴度检测 采用抗球蛋白试验检测去甘油红细胞的抗原保存效果,用配制的2% DEA1.1 阴、阳性新鲜红细胞和去甘油化红细胞作为待检细胞,并用DEA1.1 多抗血清作为检测抗体,梯度稀释26、27、28、29、210、211、212,进行抗球蛋白试验。
1.3.3 犬甘油化红细胞保存期的测定 将冻存甘油化红细胞置于-20 ℃冰箱保存,每3 个月取出一份去甘油化后配置成2%红细胞悬液,检测甘油化红细胞的血凝效价,同时检测其回收率,评价冻存甘油化红细胞保存期。
1.4 犬红细胞醛化固定 分别选择终浓度为0.25%、0.5%的戊二醛,1.5%、3%甲醛和0.5%、1%多聚甲醛于常温下固定犬红细胞30 min。 最后用生理盐水配制成2% 红细胞悬液,4 ℃保存备用[7]。
1.4.1 醛化红细胞DEA1. 1 抗原滴度检测 取100 μL 2% 醛化犬红细胞加入到各个管中,加100 μL相同稀释倍数的DEA1.1 多克隆血清,37 ℃孵育45 min,室温下3 000 r/min 离心10 min,取上清液100 μL 转移到另一个管中。 之后进行抗球蛋白试验,检测上清液的抗体滴度(醛化固定红细胞的DEA1.1 抗原滴度=多克隆血清滴度-2 ×上清滴度)。
1.4.2 醛化红细胞抗原性检验 用0.5%戊二醛固定56 只犬的红细胞,在此之前,56 只犬DEA1.1血型经间接抗球蛋白试验检测确定血型。 用杜国浩[3]等制备的DEA1.1 多克隆抗血清检测醛化红细胞的抗原性并与新鲜红细胞抗原性对比。
2 结果
2.1 去甘油化红细胞质量检测
2.1.1 去甘油化红细胞溶血情况 冻存的甘油化红细胞解冻后,直接观察红细胞溶血情况,所有试验组均出现不同程度的溶血(见中插彩版图1)。其中3%,6%,10%甘油浓度组红细胞均全部溶血,无完整红细胞。 20%、30%和40%甘油浓度组呈现部分溶血,并随甘油浓度增加,上清颜色逐渐变浅。 相比两种冻存方法,相同甘油浓度下,程序降温冻存组红细胞破损率较低,溶血率较低。
2.1.2 物理性状及细胞形态观察 甘油冻存后去甘油化红细胞颜色鲜红,无粘附性,轻晃易散开,与新鲜红细胞相似。 经冻存红细胞完全去甘油化并置于生理盐水后,红细胞破损率低,并且仍能维持良好的形态特征,大小均一,呈双凹圆盘形,折光性好,与新鲜红细胞相比体积变化不大,仅有少量红细胞表面折光性弱,轮廓不清(图2)。

图2 去甘油化红细胞物理性状及形态
2.1.3 红细胞回收率检验 甘油化红细胞解冻后,检测红细胞回收率,结果显示,两种冻存方式红细胞均有不同程度的减少,各个组回收率见表1,其中两种冻存方式,3%和6%甘油组对红细胞冻存无保护作用,回收率均为0;10%、20%和30% 甘油浓度组,随甘油浓度增加,回收率逐渐升高,30%甘油浓度下,快冻组和程序降温组回收率分别高达42%和51%,40%甘油浓度回收率呈现减少趋势,快冻组和程序降温组分别为33%和36%。
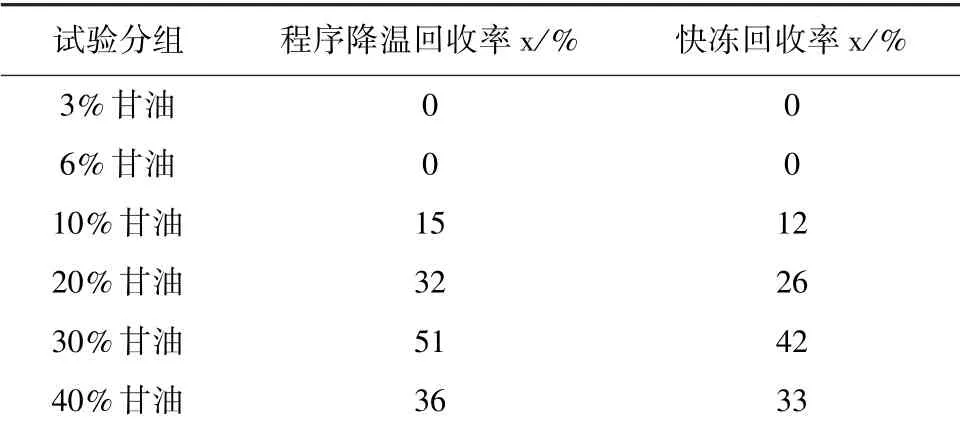
表1 不同冷冻速度和不同甘油浓度处理红细胞回收率/%
2.1.4 犬DEA1.1 抗原效价检测 由表2 可知,用不同滴度的42 份DEA1. 1 多抗血清,检测新鲜DEA1.1 阳性红细胞和去甘油化DEA1.1 阳性红细胞抗原滴度,测得的血凝效价有差异,但波动性不大,如果把相差一个滴度视为基本符合,符合率为93%。 由此可知,甘油化冻存DEA1.1 阳性红细胞基本可以作为检测DEA1.1 血型抗体类红细胞。 而冻后DEA1.1 阴性细胞和冻前DEA1.1 阴性红细胞血凝值均为0,甘油处理后冻存对于DEA1.1 阴性红细胞无影响。
2.1.5 犬甘油化红细胞保存期检测 将30%甘油慢冻甘油化的DEA1.1 阳性红细胞置于-20 ℃冰箱中保存18 个月,每3 个月检测一次抗原性和回收率,保存时间延长,抗原效价逐渐降低,与新鲜红细胞相比,保存18 个月,符合率达90%(见表3)。 回收率检测结果显示,随保存时间延长,甘油化红细胞回收率逐渐降低,保存12 个月以后,回收率明显降低。 保存18 个月,回收率降低至32%(表4)。
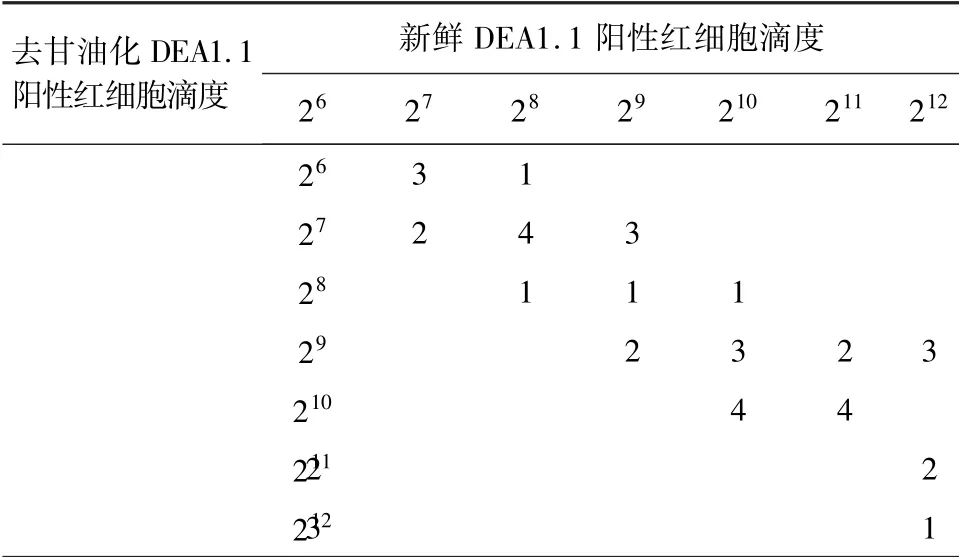
表2 去甘油化DEA1.1 阳性红细胞与新鲜DEA1.1阳性红细胞血凝检验符合率结果
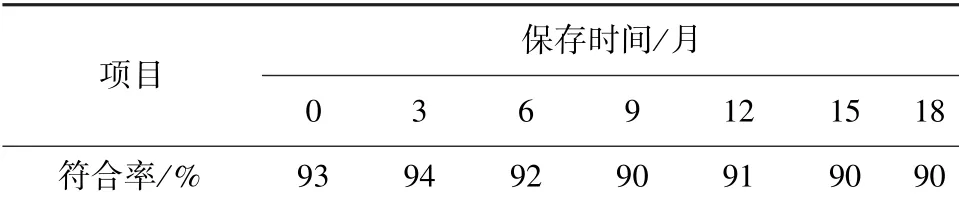
表3 不同保存时间甘油化红细胞血凝效价符合率
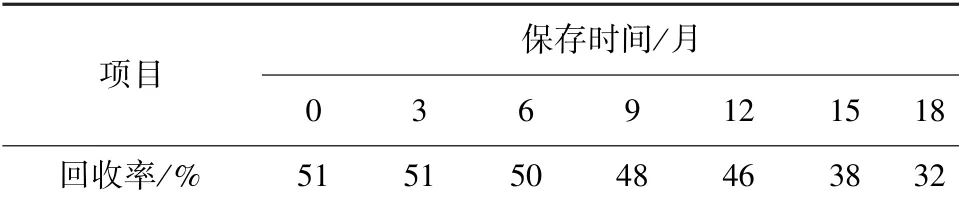
表4 不同保存时间甘油化红细胞回收率
2.2 醛化红细胞对犬DEA1.1 血型的影响
2.2.1 醛化红细胞稳定性 用甲醛(1.5%,3%)和多聚甲醛(1%,2%)固定的红细胞,在做抗球蛋白试验洗涤过程中,出现了不同程度的溶血。 在甲醛和多聚甲醛固定红细胞溶血均出现早于非固定红细胞。 用戊二醛固定的红细胞初时呈鲜红色,固定后逐渐变成棕色。 用等渗生理盐水或PBS 反复洗涤,细胞不发生溶血,形态保持稳定,不溶解,不变形。 120 天后对醛化固定红细胞进行溶血率评价结果如图3。
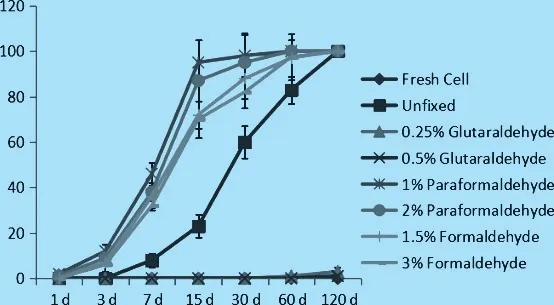
图3 醛化固定红细胞溶血率的变化
2.2.2 醛化犬红细胞对DEA1.1 抗原滴度的影响 三种不同的醛化方法,经抗球蛋白试验检测,都可以很好的保留犬DEA1.1 血型抗原。 然而,多聚甲醛和甲醛醛化的红细胞在洗涤过程中损失严重,在做抗原滴度检测的结果时,没有参考意义。 戊二醛固定犬红细胞,在4 ℃下用含1∶10 000 硫柳汞贮藏固定红细胞4 个月,反复洗涤过程中强韧而稳定,不发生溶血。 但是戊二醛固定后的红细胞长期保存沉降后粘着性较大,使用时需要反复吹打方可使用。 甘氨酸封闭对戊二醛的粘着性具有很好的缓解。 在保存120 d 内,戊二醛固定对犬DEA1.1 抗原的敏感性基本不变,抗原滴度基本未减少,维持在25左右(表5)。
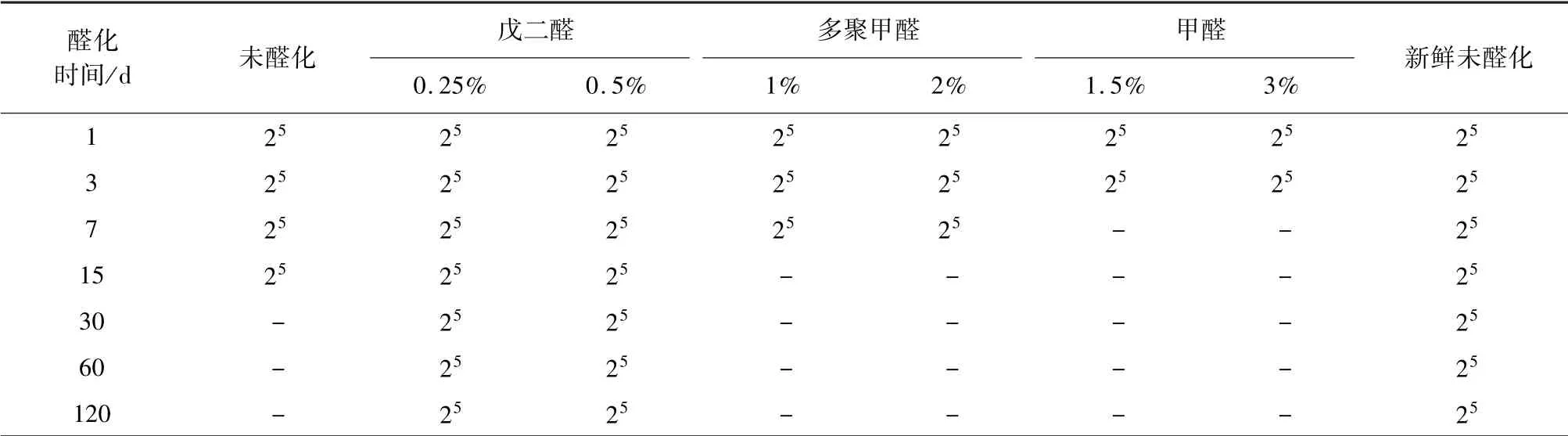
表5 醛化后犬DEA1.1 抗原效价检测
2.2.3 醛化犬红细胞对DEA1.1 抗原性影响 用抗球蛋白试验法检测的56 份戊二醛固定犬红细胞的DEA1.1 抗体显示,其与RapidVet-H Canine 试剂盒的结果符合率为100%。 在13 份不同的DEA1.1多抗血清的验证中,使用抗球蛋白试验法检测戊二醛固定的红细胞的结果与使用该犬的新鲜红细胞的结果符合率为100%。 戊二醛固定的红细胞并没有改变犬红细胞DEA1.1 血型抗原性。
3 讨论
DEA1.1 血型系统是犬输血过程中最主要的溶血因素[8],临床上,严重的输血反应现象通常会发生在受血犬为DEA1.1 阴性,两次接受的血液均为DEA1.1 阳性血液的情况下,此时产生的抗DEA1.1抗体极有可能破坏献血者的红细胞,产生严重的输血反应。 因此,犬在输血前的血型鉴定是非常有必要的,检测用犬DEA1.1 血型红细胞的保存工作成为需要攻克的又一难题。 本研究对DEA1.1 阴阳性红细胞进行甘油化冻存,30%甘油处理红细胞溶血较少、回收率较高且红细胞的形状、颜色、粘附性等都与新鲜红细胞相似。 经冻存红细胞完全去甘油化置于生理盐水后,红细胞破损率低,仍能维持良好的形态特征,30%甘油冻存的红细胞可以应用于将来的犬DEA1.1 血型的保存工作中。 同时,甘油化的红细胞和新鲜红细胞同样具有检测抗体的功能,其可以作为检测DEA1.1 血型抗体类红细胞,为今后制备犬红细胞特异性抗体工作打下基础。
目前,科研人员正在积极探索和寻找能够引起特定红细胞抗原凝集的抗体。 但是,由于犬的血型系统复杂,品种繁多,又缺乏强大的抗体制备和筛选技术,所以抗体制备工作进展并不顺利[9]。 至今国际上存在的仅有Andrews 等在1992 年研制出了DEA1.1 血型定型单克隆抗体。 Hara 等1991 年研制出DEA3 血型定型单克隆抗体[10-11]。 现今,对犬血型则可用多克隆免疫抗体鉴定,但是所制备多克隆免疫抗体必须用已知血型红细胞进行筛查方可应用于临床。 在血细胞的应用过程中,某些试验中的血凝指示剂以及未知抗体的筛选与鉴定通常都是采用新鲜红细胞。 但是在红细胞保存过程中,不同的保存条件和保存时间会使红细胞表面发生一系列结构性与功能性的变化,从而致使新鲜红细胞发生溶血、破裂,且极易吸附免疫球蛋白等物质。 还会因洗涤不彻底、个体间差异、保存期较短等因素影响实际临床检验和科研应用[12]。 有研究指出,新鲜红细胞可用醛类固定处理,以便长期保存使用。醛化处理能够保持细胞骨架的完整性,增加细胞膜的硬度,使细胞不易破裂,同时保留血凝活性,并可消除不同个体间红细胞的差异,重复性好,醛化后保存期长,可批量制备,条件恒定,使用方便[13-14]。本研究中发现,用不同的醛化剂对红细胞固定后,均没有影响犬DEA1.1 血型的抗原性,并且没有改变抗原的数量。 醛化红细胞不仅可以固定红细胞膜上的抗原,而且使红细胞的耐渗透压能力增加,溶血率降低,同时保存条件简单,只需放在4 ℃下冷藏保存备用,而不会破裂、溶血。 戊二醛固定红细胞易于储存在4 ℃条件下,并且可在120 d 内保存。经长时间贮存,血细胞聚集在一起时仅需要晃动以获得均匀的悬浮液所需的活力。 因此,戊二醛固定的红细胞不仅可以在HA 试验代替新鲜血红细胞,而且也完全可以筛选和鉴定多克隆抗体。 同时,它为制备DEA1.1 单克隆抗体提供了基础。
尽管此次研究在试验方法及其他方面的尝试等问题上还不够完善,但是本研究为国内犬源红细胞的冻存技术以及醛化保存打下了基础,同时为临床犬DEA1.1 血型抗体检测及血型分型工作提供了数据支持。 关于醛化对不同抗原影响的本质问题以及醛化后血凝活性与新鲜红细胞是否完全一致还有待进一步研究和改善。 希望随着这些问题的解开,犬血液保存以及DEA1.1 单克隆抗体的制备和犬DEA1.1血型的抗原检测等问题能够得到有效的解决。
