猪瘟和猪蓝耳病混合感染的诊断与防控
2018-04-16牛绪东冯学俊马洪超张元瑞刘建柱
牛绪东 ,冯学俊 ,任 禾 ,马洪超 ,张元瑞 ,刘建柱 *,,
(1.山东农业大学 动物科技学院,山东 泰安 271018;2.中国动物疫病预防控制中心,北京 100125;3.山东省动物生物工程与疾病防治重点实验室,山东 泰安 271018;4.山东省畜禽疫病防制工程技术研究中心,山东 泰安 271018)
猪瘟(CSF)是由黄病毒科瘟病毒属猪瘟病毒(CSFV)引起的一种急性、热性、高度传染性疾病[1],是世界动物卫生组织(OIE)规定通报的疫病;猪繁殖与呼吸综合征(PRRS)又名猪蓝耳病,是动脉炎病毒科动脉炎病毒属猪繁殖与呼吸综合征病毒(PRRSV)引起的一种繁殖障碍和呼吸道症状的疾病,是OIE规定通报的疫病,我国规定为二类动物疫病[2]。近年来,猪群中猪病多以2种或2种以上的病原微生物共同作用,引起严重的混合感染,简称混感。猪病的复杂性给猪场疾病的诊断和防治工作带来较大困难。作者于2017年5月30日在山东农业大学动物保健医院接诊了一例来自山东省泰安市侯某某带来的4头病死猪,经临床初步诊断和实验室RT-PCR和PCR技术检测,确诊其为猪瘟病毒和猪蓝耳病病毒混合感染。现将该病例的诊断情况总结如下:
1 发病情况
经询问畜主得知,该猪场是在原来废弃6年多的旧猪场场址上几乎是重新建设的新猪场。畜主于5月16日从山东某大型种猪场购来第1批1000头(23~30日龄)刚断奶的仔猪,5 d后仔猪开始出现咳嗽、腹泻,个别出现神经症状,种猪场技术人员诊断为肠炎和链球菌病,让畜主立即在饲料内拌入氟苯尼考和多西环素治疗5 d,投药后未见明显效果,仍继续发病并开始出现死亡。随后又在饲料内拌入硫酸黏菌素和硫酸新霉素治疗4 d,仍未见效果。此时,发病率和死亡率明显增加,畜主见病情严重,遂来本医院进行诊治。据悉,购进仔猪已两周,大约有三分之一的仔猪发病,并已死亡70余头。
畜主购进的这批仔猪是与这家种猪场所在的某集团总公司签订了供销合同,当确诊有猪瘟后,畜主于6月1日自行紧急免疫了两栏相对健康的89头仔猪,一周内仅死亡3头,其余86头仔猪经喂服多西环素和维生素C4d后基本正常。场内还有接近800多头仔猪,一周内又死亡300余头,由于种猪场所在集团总公司内部的未知原因,直到6月8日才对剩余的其中400余头仔猪进行了猪瘟细胞苗免疫注射。6月16日回访,大约仅存活不到200头,该批仔猪购进一个月其死亡率就高达80%以上,损失惨重。
2 临床症状
病仔猪呆立,精神沉郁,喜卧扎堆,采食量减少或废绝;体温多在40.8~41.6 ℃之间;结膜潮红,眼睑水肿(见图1);轻微咳嗽且气喘;多数排出稀软粪便(见图2),有的排带有黏液的干粪(见图3);皮肤可见点状出血,有的局部皮肤呈现紫红色,特别是耳廓、颈部和后躯等部位(见图4);站立不稳,行走摇摆,濒临死亡的病猪出现肌肉震颤、角弓反张现象;病仔猪很快脱水、贫血、消瘦,最后衰竭死亡。
3 病理剖检
尸体贫血、消瘦、脱水(见图5)。全身淋巴结肿大,周边出血其切面呈“大理石样”花纹(见图6、图7)。心包积有少量淡黄色液体(见图8),心内、外膜均出血(见图9),左心耳严重出血(见图10)。肝脏轻度肿大、淤血、出血。脾脏肿大,边缘有出血性梗死灶(见图11)。肺脏淤血、出血,在尖叶、心叶、膈叶前下部和副叶呈现“肉样”实变(见图12)。肾脏轻度肿大,其被膜下可见多量针尖状出血点,肾乳头明显出血,输尿管扩张(见图13)。胃底黏膜潮红、出血,可见少量小的出血性溃疡(见图14);小肠壁变薄,其内容物为黄色稀薄液体(见图15);结肠圆锥肠系膜轻度水肿,通过浆膜可看到许多白色坏死灶(见图16),其黏膜弥漫性出血(见图17)。
4 实验室诊断
分别采取病死猪的淋巴结、肝脏、肺脏和脾脏,以备病料中4种病毒基因组的提取。
对猪瘟病毒(C SFV)、猪繁殖与呼吸综合征病毒(PRRSV)和猪传染性胃肠炎病毒(TGEV),按照RNA提取试剂盒(购自上海生工生物公司)说明书进行RT-PCR检测诊断。这3种病毒的特异性引物均由北京伟嘉集团山东检测中心提供。扩增片段大小分别为272 bp、511 bp、528 bp,产物通过0.8%的琼脂糖凝胶电泳观察,在该病料中CSFV核酸和PRRSV核酸均出现目的条带(见图18),说明病料中两病毒阳性。而TGEV核酸未出现目的条带即该病毒阴性。
对猪圆环病毒2型(PCV2)进行PCR检测法诊断。按照DNA提取试剂盒(购自上海生工生物公司)说明书,对采取的病料进行DNA提取。根据董亚清等[3]报道设计PCV2引物序列,上游引物序列:5’-CGTTGGAATGGTACTCCTC-3’;下游引物序 列:5'-TATGGAAATTCAGGGCATG-3'。目的片段大小515 bp。采用25μL PCR体系:DNA样本1μL;2×Taq master Mix12.5μL;上 下 游引物各0.5μL;灭菌ddH2O 11.5μL。PCR 程 序:95 ℃5min;95 ℃30s、48 ℃25s、72 ℃30s,32个 循 环;72 ℃10min,4 ℃保存。PCR产物通过0.8%的琼脂糖凝胶电泳观察结果,该病料中PCV2核酸没有出现目的条带(见图18),说明病料中PCV2阴性。
5 结论
根据流行病学、临床症状和病理剖检,初步诊断为CSFV、PCV和PRRSV的混合感染性疾病。经实验室RT-PCR和PCR检测得知,CSFV和PRRSV为阳性,PCV为阴性。因多数仔猪腹泻,又通过PCR技术检测了TGEV,结果为阴性。经以上检测及综合分析,该病例最后确诊为CSFV和PRRSV的混合感染。
6 讨论与小结
6.1 发病原因简析
1)据曹剑等研究表明[4],猪瘟母源抗体与母猪体内的猪瘟抗体水平基本呈正相关。经流行病学调查得知,该发病仔猪购自的种猪场由于人员更替造成管理混乱,免疫工作未按免疫程序做到位,可能出现免疫拖延及漏免现象,加之免疫监测缺失,这样就造成了母体内CSF的特异性抗体下降,累及哺乳仔猪从初乳中获得的母源抗体维持时间缩短,使之21日龄断奶后很快出现疫病。
2)据杜善忠等研究表明[5],猪瘟母源抗体从28日龄开始下降加剧,半衰期为17 d左右;猪蓝耳病母源抗体21日龄开始下降加剧,半衰期9 d左右。该病例中的仔猪开始发病的日龄(28~35日龄)符合此研究中两种疫病母源抗体下降的规律。
3)PRRS V属于免疫抑制性病原,一旦感染就会造成机体免疫力降低[6],从而影响猪瘟疫苗的免疫效果,容易诱发CSFV等病原微生物的感染。
4)由于21日龄的早期断奶应激和长途运输及环境突变应激,使断奶仔猪的免疫力及母源抗体降低,从而诱发多种疫病[7]。

图1 眼睑水肿

图2 排出稀软粪便并污染后躯

图3 排干粪球并附有黏液

图4 仔猪扎堆,耳廓呈蓝紫色

图5 尸体贫血、消瘦、脱水

图6 右下颌淋巴结肿大,出血呈大理石样花纹

图7 左膝前淋巴结髓样肿大、周边出血
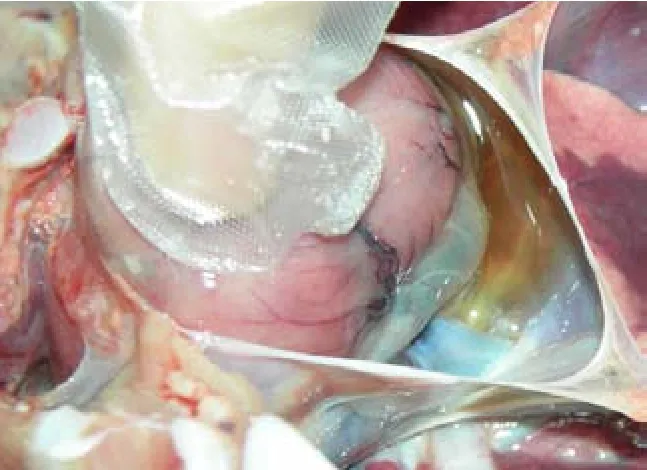
图8 心包积有少量淡黄色液体
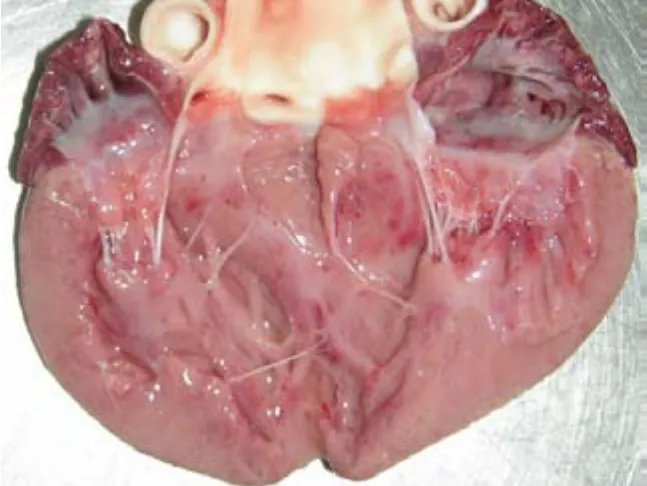
图9 心内膜出血

图10 心外膜出血,左心耳严重出血
6.2 本次病例高死亡率的原因简析
1)复杂的多病因混合感染。本次病例在CSFV和PRRSV协同作用下,很快便引起了断奶仔猪严重的发病和死亡。

图11 脾脏肿大且边缘有出血性梗死灶

图12 肺尖叶、心叶、膈叶前下部和副叶呈“肉样”实变
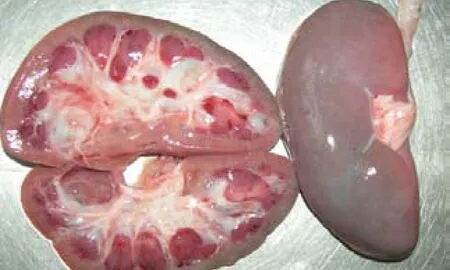
图13 肾脏肿大其被膜下有针尖状出血点,肾乳头明显出血

图14 胃底黏膜潮红且有小的出血性溃疡
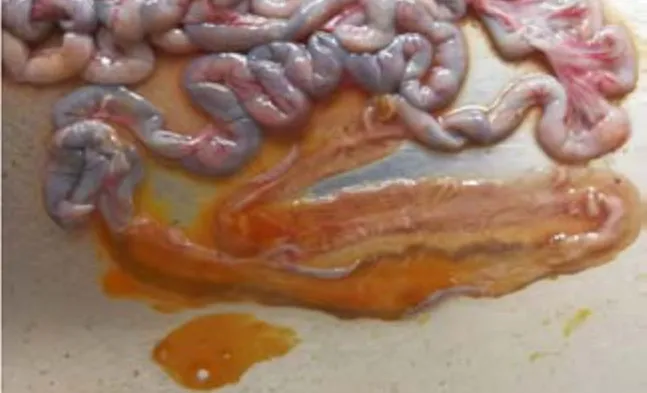
图15 小肠内容物为黄色稀薄液体

图16 结肠系膜轻度水肿,通过浆膜可见白色坏死灶

图17 大结肠黏膜弥漫性出血,也可看到白色坏死点
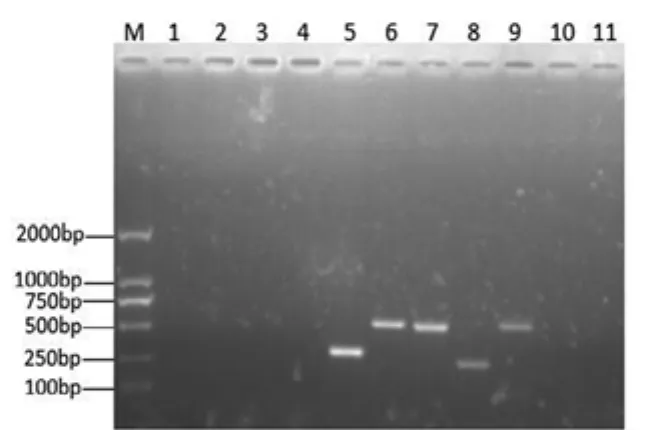
图18 PCR扩增产物电泳结果
2)确诊不及时。畜主在仔猪群发病初期没有到权威兽医诊疗机构去诊断,自行治疗十余天无效且越来越严重,才决定来本医院进行诊断,作者于2 d内给予确诊。
3)紧急免疫不到位。该病例在本医院确诊后,畜主与种猪场技术人员对提出的紧急免疫方案不知何原因迟迟不去执行,又拖延一周之后才进行了半数猪只的猪瘟细胞苗的紧急免疫注射。此时其感染率、发病率和死亡率猛增,作者认为已为时已晚。
4)幼小仔猪免疫力不健全。特别是早期断奶的仔猪抗病力更差,更需要畜主做好生物安全工作,并精心饲养与管理。幼小仔猪一旦发生疫病,如果防治不及时则后果非常严重。
6.3 PRRSV有2个基因型,欧洲型和美洲型
欧洲型通常引起经典性猪蓝耳病,使猪免疫力低下,继发感染,长期带毒;美洲型通常引起猪高致病性蓝耳病(HP-PRRSV),通常诱导产生严重的炎性反应,造成猪急性的肺脏炎性损伤,导致猪的急性死亡,对猪群危害严重[8]。据江松泽等对2011-2014年江西省境内所选取的8份阳性血清中检测的PRRSV毒株均属于美洲型毒株[9]。说明我国现在流行的猪蓝耳病主要是高致病性蓝耳病。根据本病例仔猪发病后的一系列病理变化,其感染的PRRSV基因型可能也是美洲型毒株。作者没有对PRRSV做更进一步的遗传进化分析。
6.4 CSF和PRRS的预防重点是通过抗体监测来准确知道两病的免疫时间和免疫效果
1)CSF抗体监测的判定标准:抗体滴度为1∶32~64时进行攻毒可获得100%保护,当抗体滴度下降到1∶16~32时能达到80%保护,当抗体滴度下降到1∶8时则完全不能保护[10],由此可见1∶16的抗体滴度是最低保护的临界值;采用ELSIA抗体检测法检测,其保护值OD450nm值0.41是最低保护的临界值[11]。
2)PRRS抗体监测的判定标准:采用ELSIA抗体检测法检测,通过计算样品孔与阳性孔OD630nm比值S/P值来判定被检血清PRRSV抗体的结果,当S/P值>0.42,判定被检血清猪蓝耳病病毒抗体阳性;当S/P值<0.42,则判定被检血清猪蓝耳病病毒抗体阴性[12]。但猪蓝耳病ELISA检测抗体水平的高低与攻毒保护率之间无明显的正相关关系,无论是IDEXX的抗体检测试剂盒,还是LSI的猪蓝耳病抗体检测试剂盒,即使两项抗体检测均为阳性的猪群,攻毒后仍然会出现发病甚至死亡。所以,我们不能将猪蓝耳病ELISA抗体检测作为是否提供有效保护的依据,而是通过ELISA抗体水平对猪群的感染状况进行评估,即在免疫猪群中可以通过抗体水平的离散度、抗体值的高低等间接评价疫苗的免疫效果[13]。
6.5 发生CSF和 PRRS混感后的处理措施
1)猪群应该紧急免疫注射2~4头份猪瘟细胞苗,同时注射2~4 mL猪高致病性蓝耳病灭活苗。据杜善忠等(2010)研究证实,猪高致病性蓝耳病灭活苗对猪瘟弱毒苗免疫无干扰作用,两者可以同时免疫;猪蓝耳病弱毒苗与猪瘟弱毒苗同时免疫,才对猪瘟疫苗的免疫有极显著的干扰作用。
2)使用抗菌药物防止继发感染,如多西环素,按每吨饲料加入150~250 g;或氟苯尼考,按每吨饲料加入60~100 g。同时加入维生素C用于增强免疫力,按每吨饲料加入400~600 g,连用5~7 d。
3)及时淘汰病情严重的仔猪,并与病死猪一起做无害化处理;对发病较轻的仔猪可以进行隔离治疗观察、精心护理。
4)及时清理(如冲刷)猪只排泄物,对猪场内外环境及用具等进行全面严格消毒,如使用0.1%~0.2%三氯异氰尿酸钠溶液,也可带猪消毒。
6.6 小结
1)CSF诊断要点:病猪皮肤出现紫斑及出血点;排稀粪或干粪,干粪表面附有黏液;淋巴结肿大、出血,横断面呈现“大理石样”花纹;肾脏贫血且有针尖状出血点;脾脏有出血性梗死;亚急性或慢性CSF于回盲口及大肠黏膜上出现“扣状”溃疡灶。确诊需要进行实验室诊断,如RT-PCR检测等。
2)PRRS诊断要点:病猪咳嗽、气喘,常见排稀粪,个别出现呕吐现象;耳廓常见蓝紫色;淋巴结髓样肿大;气管内可见泡沫状液体,肺脏出现淤血、出血、水肿,呈现片状实变现象。确诊需要进行实验室诊断,如RT-PCR检测等。
3)CSF和PRRS混感的防控要求:重视并严格执行生物安全措施,做好两病的免疫注射及免疫效果监测。搞好饲养管理,增强猪只抗病能力,切实保障猪群健康。如果发现猪群猪只有异样,应到具备实验室诊断技术的诊疗机构进行及时确诊,并及时采取科学有效的处理方案,最大限度地减少损失。该批断奶仔猪刚刚购进一个月,其死亡率就高达80%以上,确实始料未及,损失如此惨重,值得我们深思。
[1] 刘建柱,牛绪东.猪病鉴别诊断图谱与安全用药[M].北京:机械工业出版社,2017.
[2] 陆承平.兽医微生物学[M].5版.北京:中国农业出版社,2013.
[3] 董亚青,郭广富,朱爱萍,等.猪圆环病毒2型PCR检测方法的建立及应用[J].黑龙江畜牧兽医,2016,27(11):126-128.
[4] 曹剑,张磊,李岩.规模化猪场仔猪猪瘟母源抗体效价动态检测[J].新疆农垦科技,2012(2):26-28.
[5] 杜善忠,胡旭进,楼芳芳,等.猪瘟和蓝耳病母源抗体消长规律及疫苗免疫的干扰作用[J].浙江农业科学,2010(5):1118-1120.
[6] 吴九州.猪蓝耳病与猪瘟并发的诊治[J].当代畜牧,2016(3):102-103.
[7] 张健,高俊,任凯.猪瘟的诊断与防治[J].中国畜牧兽医文摘,2015,31(12):113-114.
[8] 陈泽芳,赵爱莉.猪蓝耳病的研究进展[J].畜禽业,2017,28(3):1-3,6.
[9] 江松泽,汪 志,师东方,等.2011—2014年江西地区猪繁殖与呼吸综合征病毒的分子流行病学调查[J].广东畜牧兽医科技,2016,41(6):34-37,43.
[10] 范有明,猪瘟的预防措施[J].中国畜牧兽医文摘,2014,30(12):110-111.
[11] 戢泽双,李影,刘彪,等.仔猪猪瘟母源抗体消长规律的研究[J].吉林农业科技学院学报,2010,19(3):9-10,21.
[12] 刘清源.猪蓝耳病灭活疫苗与弱毒疫苗免疫后的抗体水平比较[J].广东畜牧兽医科技,2017,42(2):32-34.
[13] 代洪波,李 琰,林艳,等.猪蓝耳病疫苗现状及其免疫效果评价方法[J].猪业科学,2016,33(12):96-97.
