TGF-β1对γδT细胞TLR-4受体及IL-2、IFN-γ水平的影响
2018-04-16杜发旺刘红梅何正光杜先智罗晓斌
杜发旺,刘红梅,何正光,杜先智,罗晓斌
(1.四川省遂宁市中心医院 呼吸内科,四川 遂宁 629000;2.重庆医科大学附属第二医院 呼吸内科,重庆 400010)
糖尿病患者血清转化生长因子β1(transforming growth factor-β1,TGF-β1)浓度高于健康人群[1-2]。TGF-β1能抑制免疫细胞的增殖与分化,介导炎症反应与机体免疫应答,但作用机制仍不明确[1-3];γδT细胞除直接杀死病原菌外,还能分泌多种淋巴因子,在机体的细胞免疫、体液免疫中发挥重要作用[4-5]。为探讨TGF-β1对γδT细胞功能的影响,本研究采脂多糖(Lipopolysaccharide,LPS)作用于γδT细胞,加入TGF-β1干预,检测γδT细胞分泌淋巴因子干扰素γ(Interferons-γ,IFN-γ)、白细胞介素2(Interleukin 2,IL-2)的变化,观察TGF-β1对γδT细胞Toll样受体4(Toll like receptor 4,TLR-4)表达的影响,从细胞信号通路的角度探讨TGF-β1抑制细胞炎症反应的可能机制。
1 材料与方法
1.1 材料
RPMI 1640干粉剂(美国Gibco公司),胎牛血清、LPS、TGF-β1、酶联免疫吸附法(enzyme linked immunosorbent assay,ELISA)试剂盒购自美国Sigma公司,RNA提取、cDNA制取、逆转录聚合酶链反应(reverse transcription-polymerase chain reaction,RTPCR)等相关试剂购自日本TaKaRa公司,PCR引物(大连宝生生物工程有限公司),Western blot检测相关试剂盒(上海碧云天生物技术有限公司),淋巴细胞分离(中国生命科学研究院),Anti-human γδTTCR–FITC、阴性空白对照试剂Mouse IgG1 K Isotype Control购自美国eBioscience公司,TLR-4抗体(美国Abcom公司)。
1.2 方法
1.2.1γδT细胞的获取取健康志愿者外周血100 ml,使用肝素抗凝,采用Ficoll密度梯度离心法分离出单个核细胞[3],将所得的外周血单个核细胞细胞用PBS调整细胞浓度至1×108个/ml,加入Antihuman γδT-TCR–FITC抗体标记的γδT细胞,恒温培养箱孵育30 min后离心,以Mouse IgG1 K Isotype Control为阴性空白对照,使用流式细胞仪分离、纯化γδT细胞。
1.2.2不同浓度的TGF-β1刺激γδT细胞将分离纯化的γδT细胞培养于6孔板中,每组设置3个复孔,重复3次。在6孔板中分别加入不同浓度的TGF-β1,使TGF-β1终浓度分别为0、5、10、20和50 mmol/L。在每孔中加入浓度为300 pg/ml的唑来膦酸,并将6孔板置于37℃、5%CO2恒温培养箱,换细胞培养液1次/2 d。第12天,采用ELISA法检测上清培养液中IFN-γ、IL-2的含量,并用Western blot和PCR检测TLR-4的蛋白表达及基因转录。
1.2.3LPS、TGF-β1刺激γδT细胞将分离纯化的γδT细胞培养于6孔板中,每组设置3个复孔,重复3次,分4组培养:①空白对照组;②LPS组(LPS 100 ng/ml); ③ LPS+TGF-β1组(LPS 100 ng/ml+TGF-β120 mmol/L); ④ TGF-β1组(TGF-β120 mmol/L)。并在每孔中加入浓度为300 pg/ml的唑来膦酸,并将6孔板置于37℃、5%CO2恒温培养箱,换细胞培养液1次/2 d。第12天,采用ELISA法检测上清培养液中IL-2、IFN-γ的含量,并用Western blot和PCR检测TLR-4的蛋白表达及基因转录。
1.2.4RT-PCRRT-PCR检测TLR-4的转录。将γδT细胞按1.2.2、1.2.3中的实验步骤培养12 d后,参照说明书步骤提取总RNA、制取cDNA、配制PCR反应液及Real time反应体系,设置好扩增条件,最后绘制出熔解曲线(每组实验重复3次)。TLR-4正向引物:5’-CCTGTCCCTGAACCCTATGA-3’,反向引物:5’-TCTAAACCAGCCAGACCTTGA-3’;内参 GAPDH正向引物:5’-TGTTCGTCATGGGTGTGAACC-3’,反向引物 :5’-CATGAGTCCTTCCACGATACC-3’。
1.2.5Western blot检测Western blot检测TLR-4蛋白的变化。将γδT细胞按照1.2.2、1.2.3中的实验步骤培养12 d后,参照说明书提取总蛋白、检测蛋白浓度,并调整好浓度(4μg/μl),在沸水中加热5 min。进行SDS-PAGE电泳(加入蛋白样品15μl/孔),用5%脱脂奶粉封闭1 h,再加入按照稀释一抗(1∶1 200)或内参(1∶3 000),4℃恒温冰箱封闭12 h,次日再次洗膜3次,加入5%脱稀释加辣根过氧化物酶标记的山羊抗兔二抗(1∶5 000),37℃孵育1 h,再次洗涤后显影成像,并用Quantity One软件分析各条带灰度值,每组实验重复3次。
1.2.6ELISA法收集TGF-β1、LPS处理的各实验组上清液,按照ELISA双抗体夹心法试剂盒说明书测定上清液中IL-2、IFN-γ的浓度。
1.3 统计学方法
数据分析采用SPSS 16.0统计软件,计量资料以均数±标准差(±s)表示,用方差分析,方差分析的两两比较用LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1 γδT细胞的纯度
从外周血PBMC中用流式细胞仪分离出的γδT细胞,其纯度可达92.54%,该纯度可以满足γδT细胞的功能研究。图1A为同型阴性对照,图1B为γδT细胞在外周血中占的比例(6.25%)。见图1。
2.2 γδT细胞TLR-4 mRNA的表达
不同浓度TGF-β1组TLR-4 mRNA的转录水平比较,经方差分析,差异有统计学意义(F=6.826,P=0.018),TGF-β1对 γδT细 胞 的TLR-4基 因转录有抑制作用,且随TGF-β1浓度增加,TLR-4 mRNA的表达呈梯度下降;20和50 mmol/L TGF-β1组与0 mmol/L TGF-β1组比较,差异有统计学意义(P<0.05)。见图2。
分组培养后,各实验组TLR-4基因转录水平比较,经方差分析,差异有统计学意义(F=8.191,P=0.035),进一步两两比较经LSD-t检验,LPS组TLR-4基因转录水平与空白对照组比较,差异有统计学意义(P<0.05);LPS+TGF-β1组与空白对照组比较,差异有统计学意义(P<0.05),但较LPS组TLR-4基因转录水平下降(P<0.05)。见图3。
2.3 γδT细胞TLR-4蛋白的表达
不同浓度TGF-β1组 TLR-4蛋白的表达水平比较,经方差分析,差异有统计学意义(F=5.312,P=0.023),TGF-β1对γδT细胞TLR-4蛋白的表达有抑制作用,且随TGF-β1浓度增加,TLR-4蛋白的表达水平呈梯度下降;进一步两两比较经LSD-t检验,20和50 mmol/L TGF-β1组与0 mmol/L TGF-β1组比较,差异有统计学意义(P<0.05)。见图4。
分组培养后,各实验组TLR-4蛋白的表达水平比较,经方差分析,差异有统计学意义(F=6.215,P=0.016),进一步两两比较经LSD-t检验,LPS组TLR-4蛋白表达较空白对照组升高(t=4.893,P=0.008),TGF-β1组TLR-4蛋白表达较空白对照组降低(P<0.05),LPS+TGF-β1组 TLR-4蛋白表达较空白对照组升高(P<0.05),但较LPS组TLR-4蛋白表达水平下降(P<0.05)。见图5。
2.4 IFN-γ水平比较
不同浓度TGF-β1组的IFN-γ水平比较,经方差分析,差异有统计学意义(F=11.298,P=0.033),TGF-β1抑制IFN-γ的表达,且随TGF-β1浓度增加,IFN-γ水平越低;进一步两两比较经LSD-t检验,20和50 mmol/L TGF-β1组与0 mmol/L TGF-β1组比较,差异有统计学意义(P<0.05)。见图6。
分组培养后,各实验组的IFN-γ水平比较,经方差分析,差异有统计学意义(F=11.319,P=0.039),进一步两两比较经LSD-t检验,LPS组的IFN-γ表达较空白对照组增加(P<0.05),TGF-β1组的IFN-γ表达较空白对照组降低(P<0.05),LPS+TGF-β1组的IFN-γ表达较空白对照组增加(P<0.05),但较LPS组的IFN-γ表达水平下降(P<0.05)。见图7。

图1 γδT细胞的纯度

图2 不同浓度TGF-β1对γδT细胞TLR-4 mRNA表达的影响 (±s)

图3 各实验组TLR-4基因转录水平比较 (±s)

图4 不同浓度TGF-β1对γδT细胞TLR-4蛋白表达的影响

图5 各实验组TLR-4蛋白的表达
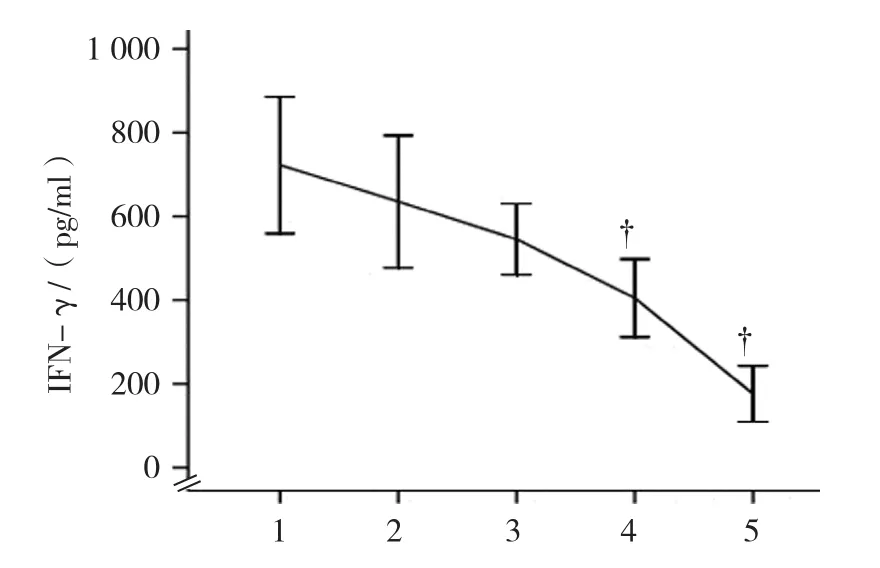
图6 不同浓度TGF-β1对IFN-γ水平的影响 (±s)
2.5 IL-2水平比较
不同浓度TGF-β1组的IL-2水平比较,经方差分析,差异有统计学意义(F=8.817,P=0.025),TGF-β1抑制IL-2的表达,且随TGF-β1浓度增加,IL-2水平越低;进一步两两比较经LSD-t检验,20和50 mmol/L TGF-β1组与0 mmol/L TGF-β1组比较,差异有统计学意义(P<0.05)。见图8。
分组培养后,各实验组的IL-2水平比较,经方差分析,差异有统计学意义(F=7.948,P=0.012),进一步两两比较经LSD-t检验,LPS组IL-2的表达较空白对照组增加(P<0.05),TGF-β1组的IL-2表达较空白对照组降低(P<0.05),LPS+TGF-β1组的IL-2表达较空白对照组增加(P<0.05),但较LPS组的IFN-γ表达水平下降(P<0.05)。见图9。

图7 各实验组IFN-γ水平比较 (±s)

图8 不同浓度TGF-β1对IL-2水平的影响 (±s)

图9 各实验组IL-2水平比较 (±s)
3 讨论
γδT细胞属于CD4-、CD8-双阴性细胞,抗原的提呈及激活不受MHC限制,作用介于固有免疫与适应性免疫之间,识别抗原后,通过一系列的信号转导机制,活化及促进炎症因子IFN-γ、IL-2、TNF-α、IL-17等的分泌[4-6],直接或间接参与机体细胞免疫及体液免疫,在抗感染早期及启动机体免疫应答过程中发挥重要作用。
IFN-γ、IL-2是炎症反应及免疫反应过程中的重要因子,IFN-γ具有很强的免疫调节作用,能够激活及增强机体免疫细胞,并介导相关抗炎机制,增强对病原微生物及感染细胞的杀伤作用[5-6],国内外大量研究显示,γδT细胞是机体早期产生IFN-γ最主要的细胞,同时也能分泌较多的IL-2,IL-2具有多种生物功能,最引人关注的是能激活T细胞,并维持T细胞的活化及增殖,调节机体免疫应答,促进抗体产生,参与炎症反应及杀灭病原微生物[7],本研究ELISA结果显示,加入LPS后,IFN-γ、IL-2水平升高,得出相似的结论。
TGF-β1属于多功能的生长调节因子,能调节免疫细胞的增殖与分化、介导炎症反应与机体免疫应答,改变机体的免疫能力[8-9],近年来研究表明,TGF-β1能抑制TLR-4受体信号传导途径及诱导免疫细胞凋亡[10-11],但是其具体的作用机制仍需进一步探讨。Toll样受体是一类天然免疫受体,能识别某些病原体或者其产物的分子结构,然后启动炎症信号通路,促进炎症介质的释放,激活免疫系统。TLR-4主要识别革兰阴性菌LPS,激活免疫系统相关跨膜通道,释放大量的IFN-γ、IL-2、TNF-α、IL-17等炎症因子[12-13]。本研究使用LPS刺激γδT细胞后,TLR-4的转录及表达增强,且γδT细胞产生IFN-γ、IL-2的能力提高。加入TGF-β1后,IFN-γ、IL-2水平较LPS组下降,同时TLR-4在基因转录及蛋白表达水平下降,这提示TGF-β1能够下调LPS对γδT细胞的刺激作用。同时观察到,γδT细胞总数下降,并且γδT细胞的增殖向Vδ1γδT细胞偏倚,提示TGF-β1可能通过某种机制抑制γδT细胞的增殖及改变γδT细胞的亚群,对γδT细胞起负性调节作用,同时也在一定程度上解释了糖尿病患者免疫低下、易感的机制,可能与免疫细胞增殖抑制、细胞亚群改变、抗炎因子减少等有关。本实验还发现,尽管LPS+TGF-β1组γδT细胞分泌产生的IFN-γ、IL-2及TLR-4转录、表达水平较LPS组下降,但是仍较空白对照组增加,提示LPS对γδT细胞的刺激作用除与TLR-4途径密切相关外,还可能通过其他途径对γδT细胞起刺激促进作用,需进一步研究。
本实验研究发现,TGF-β1能减弱γδT细胞分泌IFN-γ、IL-2等淋巴因子,并减少γδT细胞TLR-4蛋白的转录及表达,下调LPS对γδT细胞的刺激促进作用,并改变γδT细胞的增殖及分化,这从一定程度解释了炎症反应、细胞免疫与细胞信号通路的关系,有助于对病原微生物的免疫逃避、机体免疫调控的理解,也从一方面解释了糖尿病患者易感染的可能机制,但其具体的抑制分子机制仍不明确,需进一步研究。
参 考 文 献:
[1]DANESHMANDI S, KARIMI M H, POURFATHOLLAH A A. TGF-β1transduced mesenchymal stem cells have profound modulatory effects on DCs and T cells[J]. Iran J Immunol, 2017,14(1): 13-23.
[2]张巧慧, 李平. 老年2型糖尿病肾病患者血清TGF-β1与IL-18水平变化及临床意义[J]. 实用糖尿病杂志, 2015(6): 13-14.
[3]QIAO Y C, CHEN Y L, PAN Y H, et al. Changes of transforming growth factor beta 1 in patients with type 2 diabetes and diabetic nephropathy: a PRISMA-compliant systematic review and metaanalysis[J]. Medicine (Baltimore), 2017, 96(15): DOI: org/10.1371/journal.pone.6583.
[4]GU Y, HU Y, HU K, et al. Rapamycin together with TGF-β1, IL-2 and IL-15 induces the generation of functional regulatory γδT cells from human peripheral blood mononuclear cells[J]. J Immunol Methods, 2014, 402(1/2): 82-87.
[5]MA H, YUAN Y, ZHAO L, et al. Association of γδ T cell compartment size to disease activity and response to therapy in SLE[J]. PLoS One, 2016, 11(6): DOI: org/10.1371/journal.pone.0157772.
[6]CORPUZ T M, STOLP J, KIM H O, et al. Differential responsiveness of innate-like IL-17- and IFN-γ-producing γδ T cells to homeostatic cytokines[J]. J Immunol, 2016, 196(2): 645-654.
[7]韦国玉, 杨莉, 周红. 肺炎支原体肺炎患儿治疗前后血清IL-2, IL-10, IL-18和D-D检测的临床意义[J]. 放射免疫学杂志,2013, 26(06): 720-722.
[8]KUHN C, REZENDE R M, M’HAMDI H, et al. IL-6 inhibits upregulation of membrane-bound TGF-β 1 on CD4+T cells and blocking IL-6 enhances oral tolerance[J]. J Immunol, 2017, 198(3):1202-1209.
[9]HOSSEINI H, LI Y, KANELLAKIS P, et al. Toll-like receptor (TLR)4 and MyD 88 are essential for atheroprotection by peritoneal B1a B cells[J]. J Am Heart Assoc, 2016, 5(11): DOI: org/10.1371/journal.pone.002947.
[10]AL-MULLA F, LEIBOVICH S J, FRANCIS I M, et al. Impaired TGF-β signaling and a defect in resolution of inflammation contribute to delayed wound healing in a female rat model of type 2 diabetes[J]. Mol Biosyst, 2011, 7(11): 3006-3020.
[11]ETOH T, KIM Y P, OHSAKI A, et al. Inhibitory effect of erythraline on Toll-Like receptor signaling pathway in RAW264.7 cells[J]. Biol Pharm Bull, 2013, 36(8): 1363-1369.
[12]KANG G D, KIM D H. Poncirin and its metabolite ponciretin attenuate colitis in mice by inhibiting LPS binding on TLR4 of macrophages and correcting Th17/Treg imbalance[J]. J Ethnopharmacol, 2016, 189: 175-185.
[13]DING Y, YANG H L, XIANG W, et al. CD200R1 agonist attenuates LPS-induced inflammatory response in human renal proximal tubular epithelial cells by regulating TLR4-MyD88-TAK1-mediated NF-κB and MAPK pathway[J]. Biochem Biophys Res Commun, 2015, 460(2): 287-294
