帕金森病患者周期性肢体运动相关的心率变化研究
2018-04-14齐自娟徐江涛新疆军区总医院神经内科新疆乌鲁木齐830000广州军区广州总医院癫痫科广东广州5000
齐自娟,王 荣,徐江涛新疆军区总医院 神经内科,新疆乌鲁木齐 830000;广州军区广州总医院 癫痫科,广东广州 5000
帕金森病(Parkinson's disease,PD)是世界范围内主要神经退行性疾病之一[1-2]。除运动性症状外,PD患者多发精神障碍、认知障碍和睡眠障碍等症状[3-5]。流行病学研究发现,PD伴睡眠障碍主要包括睡眠呼吸障碍、不宁腿综合征、快动眼睡眠行为障碍和睡眠周期性肢体运动(periodic limb movements during sleep,PLMS)等[6-8]。临床研究表明,PLMS会导致心率波动:腿动发作时,患者心率会表现“心动过速-过缓”的变化模式,提示交感神经兴奋性增强。交感神经的反复兴奋会导致心率和血压的不稳定,增加氧化应激和炎症反应的风险,诱导心脑血管疾病的发生[9-11]。PD患者自主神经功能障碍较为常见,PD会导致心脏交感神经的去神经化,且这种变化一般会早于PD典型运动症状[12]。已知PD患者在觉醒状态下会发生自主神经功能障碍,但睡眠期间PD患者的自主神经功能变化尚无文献报道,PD合并PLMS患者的心率变化特征也未见报道。此外,PLMS在不同疾病(如快速眼动睡眠行为障碍)、不同人群(如不同性别、不同年龄)中,心率变化模式显著不同[13-16],说明研究PD合并PLMS患者的心率变化模式具有一定临床意义。本文通过对PD合并PLMS患者和原发性PLMS患者腿动相关睡眠数据的比较分析,研究PD患者PLMS相关的心率变化特征,以期为PD合并PLMS患者的临床监护和诊治提供依据。
对象和方法
1 研究对象 选取PD合并PLMS患者(病例组)和原发性PLMS患者(对照组)作为研究对象。病例组来自于2014年3月- 2015年9月在新疆军区总医院神经内科的PD住院患者,PD的临床诊断参考1992年英国帕金森病协会(UKPD)脑库制订的原发性PD诊断标准[17]。对自述发生睡眠障碍的PD患者进行整夜多导睡眠图(polysomnography,PSG)监测,PD患者PLMS的诊断参考美国睡眠医学学会(ASDA)提出的诊断标准[18]:睡眠期单次肢体运动事件持续时间为0.5 ~ 5 s,肌电活动振幅>25%,连续发生≥4次肢体运动,相邻两个肢体运动事件的间隔时间为5 ~ 90 s,整晚每小时周期性肢体运动指数(periodic limb movement index,PLMI)>5。排除标准:患有心律失常,其他睡眠障碍(如阻塞性睡眠呼吸暂停综合征或发作性睡病等),服用对心率变异性(heart rate variability,HRV)有影响的药物(如β-受体阻滞剂,抗心律失常药物,巴比妥类药物,钙通道抑制剂等),有可能并发自主神经衰竭的疾病(如糖尿病)。对照组样本来自于来新疆军区总医院神经内科同期住院或门诊PSG诊断为原发性PLMS的患者,其纳入标准和排除标准参考PD患者中PLMS的纳入和排除标准。
2 方法 收集所有样本的基线资料(年龄、性别、身高、体质量等)和PSG监测数据。根据PLMS诊断标准,从PSG数据中选取符合条件的腿动记录:对于每次腿动记录,选取腿动发生前5个R-R间期(T-5~ T-1)、腿动发作时(Tonset)和腿动发生后19个R-R间期(T+1~ T+19)研究心率变化。R-R间期通过公式:心率=60/R-R间期,换算成心率。多次腿动记录的相同R-R间期时间位点的心率均值作为该时间点的心率水平。T-5~ T-1的心率均值定义为心率基线值。每个R-R间期的心率与心率基线的差值用来研究腿动相关的心率变化模式和幅度。
3 统计学分析 统计分析采用SPSS17.0。计量资料满足正态分布且方差齐性以-x±s表示,组间比较采用两独立样本t检验;组内多时间位点比较采用单因素重复测量资料的方差分析;计数资料组间比较采用Fisher确切概率法。P<0.05为差异有统计学意义。
结 果
1 一般情况 根据纳入标准,共纳入患者20例,其中病例组7例(男性5例,女性2例),对照组13例(男性8例,女性5例);根据排除标准,病例组和对照组各有2个有心律不齐等症状的样本被排除。研究最终共纳入16个样本,其中病例组5例,对照组11例(表1)。

表1 纳入样本的一般资料Tab. 1 General information of included patients
2 两组心率变化模式分析 研究中共测量腿动次数1 179次,病例组共406次,对照组共773次。病例组PLMI为21.96±15.17次/h,对照组PLMI为23.98±19.64次/h,两组间PLMI无统计学差异(P=0.82)。腿动发生前5个时间点的心率比较分析结果显示,病例组腿动发生前心率水平保持不变(P=0.231);对照组心率水平在T-5~ T-2内保持不变(P=0.947),在腿动前1个时间点开始上升(P<0.001)。腿动发生导致两组心率水平显著上升(图1)。对照组心率水平在T-1时开始增高,在T+4时达到峰值(70.98/min),之后逐渐下降,在T+9~ T+10时降至基线水平,“心动过速”(与基线相比)发生于T-1~ T+8,“心动过缓”在T+10以后。病例组心率在T+5时达到峰值(70.08/min),随后逐渐下降,在T+14和T+15时降至基线水平,“心动过速”发生于Tonset ~ T+15,“心动过缓”发生在 T+15以后 (图1)。这说明PLMS合并PD较原发性PLMS心率变化幅度较小,但心动过速持续时间较长。
3 两组间心率的比较分析及波幅分析 PLMS合并PD患者心率最大增幅(约1.38/min)明显低于原发性PLMS患者(约4.24/min)。通过对不同R-R间期心率波幅的比较分析发现,腿动发生前T-1两组心率波幅有显著差异;T+1~ T+5两组均出现心动过速,对照组心率波幅显著高于病例组;T+12~T+18对照组出现心动过缓,心率变化幅度仍显著高于病例组(图1)。
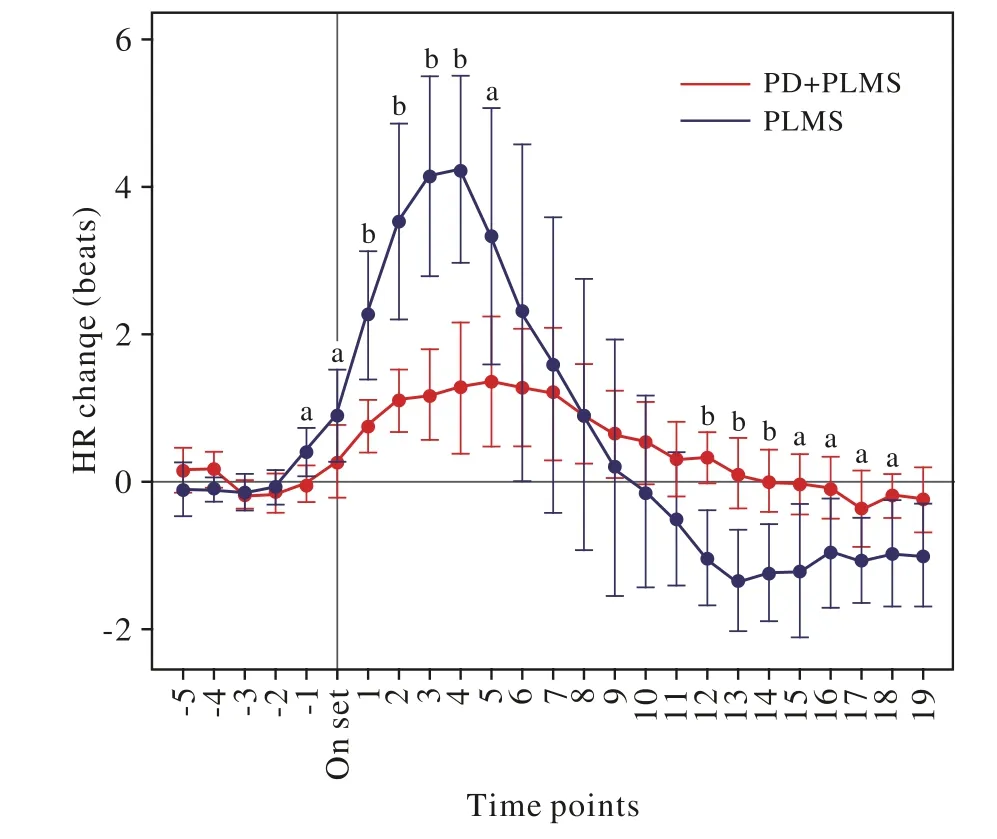
图1 PLMS相关的心率变化模式及两组间的比较 (aP<0.05,bP<0.01)Fig. 1 Patterns of PLMS related HR change in two groups (aP<0.05,bP<0.01)
讨 论
本研究通过对PD合并PLMS患者与原发性PLMS患者的PSG比较分析,研究了PD患者PLMS相关的心率变化特点。证实了PD患者PLMS相关的心率变化模式与原发性PLMS诱导的心率变化相似:腿动发作时,平均心率表现出“心动过速”-“心动过缓”的典型模式。但PD患者心动过速的幅度显著低于原发性PLMS患者,且PD患者在达到心动过速的峰值后,需要更长的时间恢复到心率的基线水平或心动过缓。
实际上,我们的研究中关于原发性PLMS患者的心率变化模式与既往研究相同。至今为止,原发性PLMS典型的心率变化固定模式的原因是由于交感神经激活,并且该假设已经被心率变异性分析所证实。Guggisberg等[19]通过对每次PLMS发生前、后10 s的HRV研究发现,伴随腿动的发生,HRV出现3个明显的震荡过程:1)轻度的自主神经系统活化,此过程中交感神经系统和副交感神经系统活化水平相同,因此它们对HRV的影响相互抵消;2)交感神经增高;3)迷走神经活性增高。对于腿动相关的心率变化模式,心动过速部分考虑是交感神经激活的结果,而心动过缓部分认为是副交感神经激活的结果。据此,Guggisberg等[19]认为PLMS发生是由于位于脑干的锥体外系运动网潜在的功能障碍周期性地被交感投射激活,脊髓损伤或者锥体外系统功能障碍如帕金森病,交感神经活动的正常波动可能就足够触发PLMS,而自主神经系统仅负责运动的周期性。快速动眼睡眠行为障碍患者自主神经功能异常、高龄患者脑干发生器功能减退,导致PLMS相关心率变化幅度降低,恢复时间延长可以证明这一假设[20-21]。
PD合并PLMS和原发性PLMS心率波幅的不同,我们推测可能是由于PD患者支配心脏的交感神经和副交感神经丛中出现Lewy小体、神经细胞的脱失、胶质细胞增生等[22]提示自主神经功能障碍的变化,且患者年龄较大,可能存在脑干发生器功能减退等。但这种波幅变化的临床意义和生理原因,需要进一步扩大样本量的相关生理病理学研究进行证实。
1 Beitz JM. Parkinson's disease: a review[J]. Front Biosci (Schol Ed), 2014, 6 : 65-74.
2 Aarsland D, Påhlhagen S, Ballard CG, et al. Depression in Parkinson disease--epidemiology, mechanisms and management[J]. Nat Rev Neurol, 2011, 8(1): 35-47.
3 Klingelhoefer L, Reichmann H. Pathogenesis of Parkinson disease--the gut-brain axis and environmental factors[J]. Nat Rev Neurol,2015, 11(11): 625-636.
4 张丽娟, 邵海涛, 王跃秀, 等 . 帕金森病研究进展[J]. 生命科学,2014, 26(6): 560-570.
5 Nalls MA, McLean CY, Rick J, et al. Diagnosis of Parkinson's disease on the basis of clinical and genetic classification: a population-based modelling study[J]. Lancet Neurol, 2015, 14(10): 1002-1009.
6 Jahan I, Hauser RA, Sullivan KL, et al. Sleep disorders in Parkinson's disease[J]. Neuropsychiatr Dis Treat, 2009, 5 : 535-540.
7 Menza M, Dobkin RD, Marin H, et al. Sleep disturbances in Parkinson's disease[J]. Mov Disord, 2010, 25 Suppl 1 : S117-S122.
8 Sleep disorders in Parkinson's disease: Diagnosis and management[J]. Ann Indian Acad Neurol, 2011, 14(Suppl 1): S18-S20.
9 Manconi M, Ferri R, Zucconi M, et al. Effects of acute dopamineagonist treatment in restless legs syndrome on heart rate variability during sleep[J]. Sleep Med, 2011, 12(1): 47-55.
10 Bonomini F, Tengattini S, Fabiano A, et al. Atherosclerosis and oxidative stress[J]. Histol Histopathol, 2008, 23(3): 381-390.
11 Alessandria M, Provini F. Periodic Limb Movements during Sleep : A New Sleep-Related Cardiovascular Risk Factor[J]. Front Neurol,2013, 4 : 116.
12 Schrag A, Horsfall L, Walters K, et al. Prediagnostic presentations of Parkinson's disease in primary care : a case-control study[J].Lancet Neurol, 2015, 14(1): 57-64.
13 Dauvilliers Y, Pennestri MH, Whittom S, et al. Autonomic response to periodic leg movements during sleep in narcolepsy-cataplexy[J].Sleep, 2011, 34(2): 219-223.
14 Ren R, Huang G, Zhang J, et al. Age and severity matched comparison of gender differences in the prevalence of periodic limb movements during sleep in patients with obstructive sleep apnea[J].Schlaf & Atmung, 2016, 20(2): 821-827.
15 Koo BB, Mehra R, Blackwell T, et al. Periodic limb movements during sleep and cardiac arrhythmia in older men (MrOS sleep)[J].J Clin Sleep Med, 2014, 10(1): 7-11.
16 Palma JA, Alegre M, Valencia M, et al. Basal cardiac autonomic tone is normal in patients with periodic leg movements during sleep[J].J Neural Transm (Vienna), 2014, 121(4): 385-390.
17 Gelb DJ, Oliver E, Gilman S. Diagnostic criteria for Parkinson disease[J]. Arch Neurol, 1999, 56(1): 33-39.
18 Pockett C, Kirk V. Periodic limb movements in sleep and attention deficit hyperactivity disorder: Are they related[J]. Paediatr Child Health, 2006, 11(6): 355-358.
19 Guggisberg AG, Hess CW, Mathis J. The significance of the sympathetic nervous system in the pathophysiology of periodic leg movements in sleep[J]. Sleep, 2007, 30(6): 755-766.
20 Gosselin N, Lanfranchi P, Michaud M, et al. Age and gender effects on heart rate activation associated with periodic leg movements in patients with restless legs syndrome[J]. Clin Neurophysiol, 2003,114(11): 2188-2195.
21 Ferini-Strambi L, Oertel W, Dauvilliers Y, et al. Autonomic symptoms in idiopathic REM behavior disorder: a multicentre casecontrol study[J]. J Neurol, 2014, 261(6): 1112-1118.
22 韦礼华, 黄德生, 韦仕荣,等. 帕金森病自主神经功能障碍的研究进展[J]. 医学信息, 2015(13):334-335.
