肿瘤相关低磷软骨病3例报道并文献回顾
2018-04-14金文胜王欣璐
李 佳,金文胜,王欣璐
广州军区广州总医院,广东广州 510010 1内分泌科;2核医学科
肿瘤相关低磷软骨病(tumor induced osteomalacia,TIO)是一组以低血磷、尿磷异常升高、骨转换活跃、不同程度骨质疏松为特点的少见代谢性骨病[1-2]。通常成人隐匿起病,表现为不明原因的渐进性乏力、活动障碍、骨痛,明确诊断前通常辗转多家医院、多学科就诊,但临床一旦明确肿瘤定位[3-4],手术切除后效果好。本文旨在通过总结本院内分泌科收治的3例TIO的临床特点及影像学检查资料,以提高临床医生对该病的认识。
病例资料
病例1:患者男性,17岁,因“双下肢反复乏力、行走困难两年余”于2011年7月于我院就诊。患者于2009年无诱因出现晨起双下肢乏力、不能直立,如行走下肢疼痛难忍,至广州市人民医院发现“右股骨下端黏液纤维瘤”行手术切除后未见好转;后渐出现下肢肌肉萎缩;至香港皇家医院就诊,查血磷0.52 mmol/L,碱性磷酸酶1 295 IU/L;考虑甲状旁腺功能亢进症、代谢性骨病。补磷片剂口服对症治疗后,患者双下肢乏力、行走疼痛减轻。后患者为明确病因再次至市人民医院检查,全身间碘苄胍扫描未见异常,颈胸部CT未见异位甲状旁腺,全身骨显像未见异常骨代谢。复查血磷0.55 mmol/L,24 h尿磷43.18(23 ~48) mmol/L;尿糖阳性;血钙2.34 mmol/L;至湘雅二院复查血磷0.48 mmol/L,甲状旁腺素升高,考虑“范可尼综合征,继发性甲旁亢”,建议继续补磷治疗(维持在0.8 ~ 1 mmol/L),辅以活性维生素D、钙剂等。患者出院后补磷片剂由最初3片,逐渐加至6片、9片,可进行正常活动。2011年因鼻出血至我院耳鼻喉科,行PET-CT提示左侧内胸壁占位,请我科会诊,考虑“低磷血症,TIO待查”转入我科。入科后查体:生命体征平稳,身高158 cm,体质量40 kg,体质量指数(body mass index,BMI) 16.02 kg/m2;胸廓对称,扁平胸,有肋骨串珠,胸骨无压痛、叩击痛;心肺腹未见异常。入院检查:口服补磷情况下血磷0.82(0.97 ~ 1.62) mmol/L;血钙正常,24 h尿磷 37 ~ 113(80 ~ 113) mmol/L,尿常规未见异常,碱性磷酸酶527(35 ~ 125) U/L。PET-CT:左侧内胸壁(左侧第5肋骨旁)条状组织影,伴代谢增高(图1);枕骨、右侧锁骨头、双侧髂骨及左侧坐骨多发囊性骨质缺损区(图2),代谢未见升高,考虑良性骨病。骨密度未见异常。综合患儿病史,17岁男性,起病隐匿,病程长,血磷低,尿磷不恰当升高,低磷血症诊断明确,可排除摄入下降、分布异常等因素,考虑磷排出增加相关疾病。肾排磷异常疾病包括范可尼综合征、肾小管酸中毒、甲状旁腺功能亢进症、成纤维细胞生长因子-23(FGF-23)相关TIO、维生素D相关软骨病。结合病史及辅助检查资料高度怀疑TIO,病变来自左侧内胸壁第5肋骨,于2011年7月19日安排患者转胸外科行左侧第5肋骨切除术。术后病理:左胸壁肿瘤为梭形细胞肿瘤,细胞间可见管腔大小不一、管壁厚薄不均的血管,部分血管呈裂隙样或树枝状,结合形态学及免疫组化,符合低度恶性血管周细胞瘤、孤立性纤维瘤,肿瘤侵犯骨组织,肋骨两侧断端未见肿瘤。免疫组化 :CD34 (+);SMA (+);Vimentin (+)(图3)。术后停止补磷治疗。术后3 d、7 d、8 d、9 d复查血磷依 次 为 0.44 mmol/L、1.00 mmol/L、1.06 mmol/L、1.1 mmol/L;术后7 d、9 d复查24 h尿磷27 mmol/L、19 mmol/L。术前肾小管回吸收磷率69.09%;术后肾小管重吸收磷率85.98%(正常值75% ~ 95%,甲旁亢45% ~ 83%)。术后1周,患者双下肢乏力、行走困难逐渐改善,2周后出院。电话随访至2017年12月,患者目前在美国求学,未再发生双下肢乏力,行走运动正常。
病例2:患者女,60岁,因“反复多关节疼痛2年余”于2012年11月入我院血液科。患者2010年出现髋部骨痛,活动加重,后出现全身多处骨痛,呈进行性加重,当地医院诊断为“骨质疏松”,予补钙、维生素D等治疗但骨痛症状反复。2012年3月30日外院PET-CT提示右侧髋臼溶骨性破坏、FDG代谢增高、多发肋骨骨折。2012年4月6日右髋臼活检,病理回报骨间叶来源肿瘤。2012年11月为明确骨痛病因入我院血液科。入院后检查提示血磷低、甲状旁腺素素升高,拟“低磷软骨病”转入我科。转科后评估血磷0.25 ~ 0.34(0.97 ~ 1.62) mmol/L,24 h 尿磷 16 ~ 17(80 ~ 113) mmol/L,血钙2.2(2.15 ~ 2.55)mmol/L,碱性磷酸酶262(35 ~125) U/L,肾小管重吸收磷率64%(75% ~ 95%)。铟111-奥曲肽扫描、锝99-奥曲肽显像未见异常。盆腔SPECT、CT局部断层融合显像见右侧髂骨溶骨性改变,未见异常生长抑素受体分布。我院复查PET-CT回报:1)右侧髋臼结节状高代谢病灶,骨质呈溶骨性破坏,考虑为骨原发病变(图4);2)右侧髂骨体类圆形低密度影(图5A),代谢未见增高,考虑为良性病变(脂肪瘤);3)双侧肋骨、双侧耻骨多发陈旧性骨折(图5B);4)左肺上叶良性小结节;右侧少量胸腔积液。结合患者病史及影像学资料,考虑TIO,病变部位在右侧髋臼,于2012年11月27日转骨科行“右髋臼肿物切除+微波灭活+植骨骨水泥填充术”。术后病理会诊报告“血管内皮梭形细胞肿瘤”。术后患者规律口服骨化三醇及补钙,自觉多关节疼痛渐改善,可行基本家务。出院时血磷0.6 mmol/L,2013年1月-2013年5月定期监测血磷逐渐上升至1.0 mmol/L。2013年6月患者自觉右髋部疼痛较前加重,当地医院查血磷降至0.36 mmol/L。2013年7月8日入住我院骨科,PET-CT检查提示右髋臼肿瘤术后复发。再次行“右髋臼肿瘤切除骨水泥填充术”。术后复查血磷0.35 mmol/L。2013年9月为复查入我科,考虑右髋臼肿瘤再次术后复发请骨科会诊,骨科考虑肿瘤所在解剖位置有手术困难,未再行手术治疗。后长期口服补磷,随访至2017年12月,监测血磷0.66 ~ 0.8 mmol/L。患者仍诉全身骨痛,右髋部最为显著。
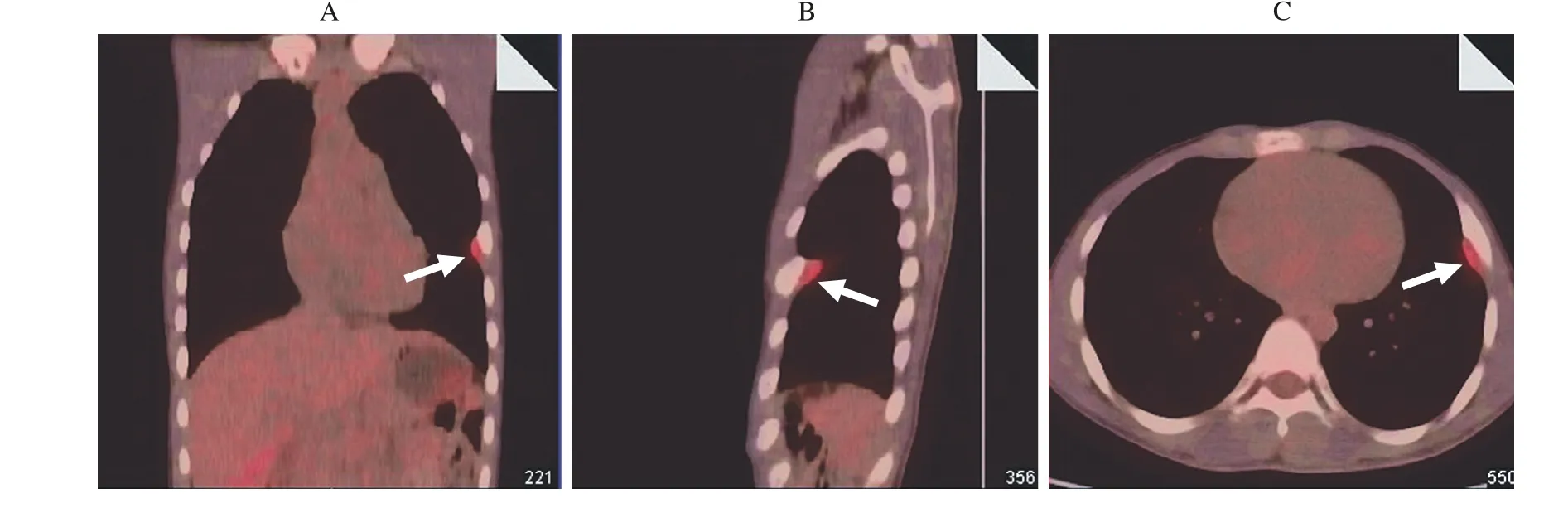
图1 病例1患者PET-CT,箭头方向示左侧第五肋骨旁高代谢病灶 冠状位(A),矢状位(B),横断位(C)Fig. 1 PET-CT imaging of case 1, the arrows showed hyper-metabolic lesion in the left 5th rib Coronal scan(A), sagittal scan (B), horizontal scan (C)
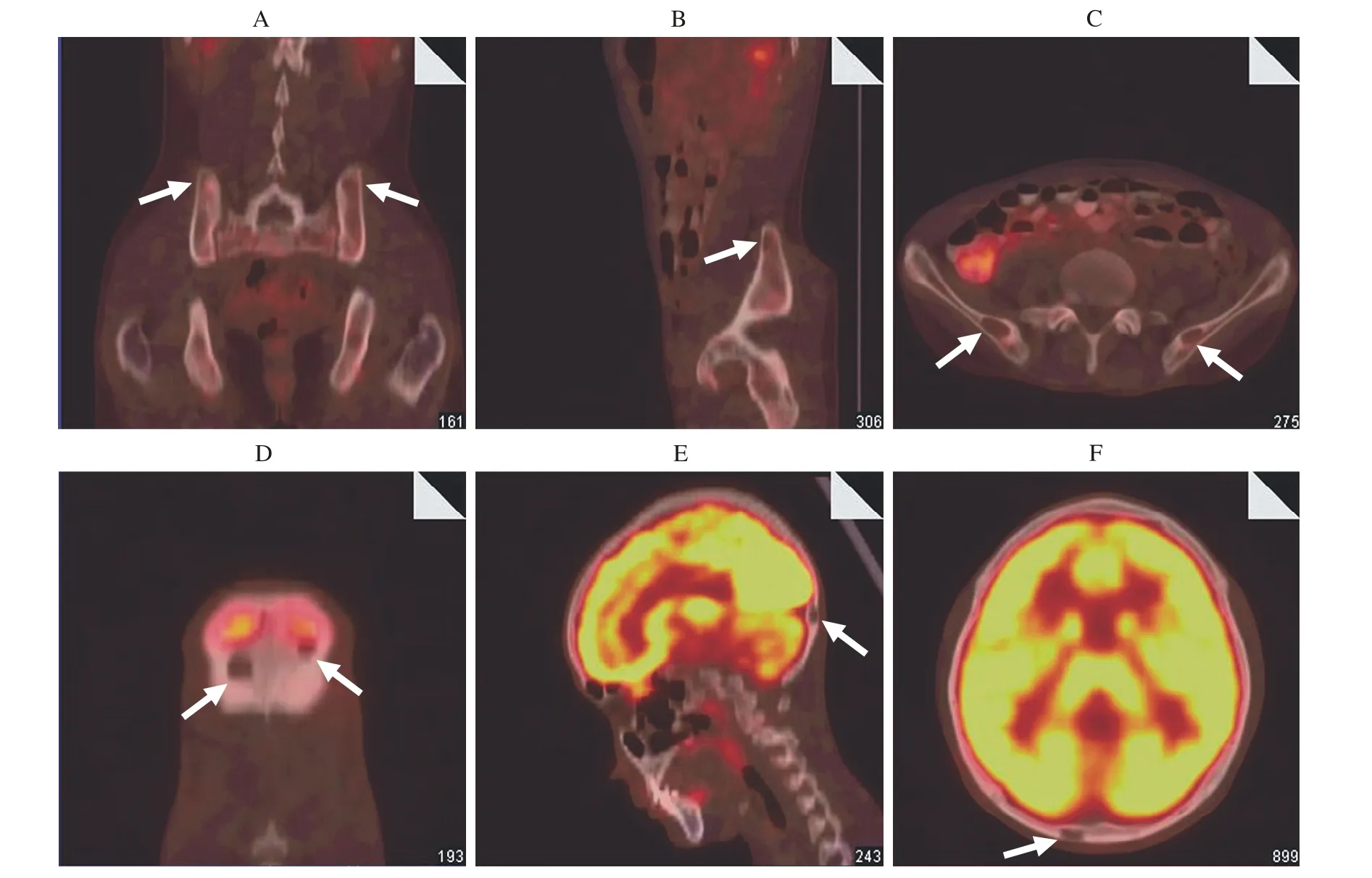
图2 病例1患者PET-CT显示双侧髂骨及左侧坐骨见多发类圆形囊性骨质缺损区及枕骨多发囊性骨缺损区的冠状位(A、D)、矢状位(B、E)、横断位(C、F)Fig. 2 PET-CT imaging of case 1, multiple round cyctic bone defects were found in ilium, ischium and occipital bone Coronal scan (A, D), sagittal scan (B, E), horizontal scan (C, F)

图3 病例1患者左胸壁梭形细胞肿瘤病理HE示梭形细胞肿瘤(A);免疫组化示Vimentin阳性(B)Fig. 3 Spindle cell tumor involved in left chest wall was diagnosed by pathology in case 1 HE staining showed the spindle cell tumor (A); Immunohistochemistry showed Vimentin positive (B)
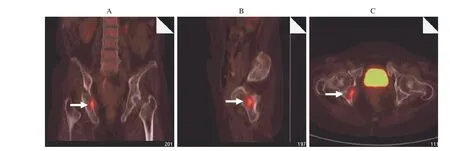
图4 病例2患者PET-CT,右侧髋臼见一结节状放射性摄取异常增高影,大小约2.2 cm×1.7 cm×3.1 cm 冠状位(A),矢状位(B),横断位(C)Fig. 4 PET-CT imaging of case 2, the hyper-metabolic lesion was found in the right side of the acetabulum, the size was about 2.2×1.7 cm×3.1 cm Coronal scan (A), sagittal scan (B), horizontal scan (C)
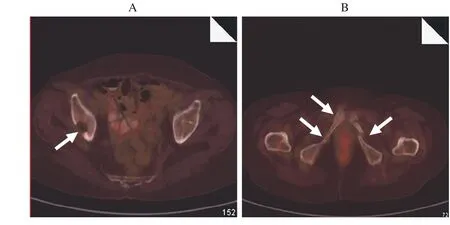
图5 病例2患者PET-CT,左侧髂骨体见一类圆形低密度影(A),双侧耻骨见多处、 多段骨质中断、移位,放射性摄取未见明显异常增高(B)Fig. 5 PET-CT imaging of case 2, the low density area was shown in the left side of ilium (A),multiple fractures were found in bilateral pubic (B)

图6 病例3患者PET-CT示右侧大腿半膜肌内一代谢稍增高圆形灶冠状位(A)、矢状位(B)、横断位(C)Fig. 6 PET-CT imaging of case 3, the hyper-metabolic lesion was shown in the semimembranosus of the right thigh , coronal scan (A), sagittal scan (B), horizontal scan(C)
病例3:患者男性,63岁,因“双下肢乏力、全身多发骨痛2年余”于2017年4月入我院骨科。患者于2014年下半年无诱因出现腰痛,伴右后踝部疼痛及左外踝前方疼痛,于2015年1月于广州市番禺区中医院就诊。X线及CT示腰4椎体滑脱并腰4、5双侧椎弓根峡部裂。完善相关检查后行“腰椎滑脱后路减压植骨融合内固定术(L4/5、L5/S1)”。出院后双季肋部仍刺痛,半年后逐渐出现双下肢乏力,期间摔倒3次,后乏力加重,行走时抬腿困难,伴双下肢麻木疼痛,以双侧大腿为主。2016年7月至市人民医院CT、MRI示1)腰椎退行性变,腰4/5、骶1融合术后改变,内固定装置未见明显松动;2)腰4椎体向前Ⅰ度滑脱;3)腰3椎体右份片状异常密度影,考虑良性病变,拟血管瘤可能。行“腰椎后路内固定取出术”,术后腰痛及双下肢乏力症状稍好转出院,但双季肋仍刺痛。出院后3个月患者再次因左下肢乏力摔伤,随后出现双下肢乏力加重,行走时抬腿困难,严重时不能行走,伴季肋区刺痛。于2017年4月拟“双下肢乏力查因”至我院脊柱骨科。骨科完善相关检查后发现患者重度骨质疏松,转至骨科综合病区行骨质疏松治疗。后请我科会诊考虑患者低磷血症,不排除TIO转入我科。查体:身高165 cm,体质量75 kg,BMI 27.55 kg/m2,肋骨压痛明显;双上肢肌力正常,双下肢肌力Ⅳ-级。入院期间监测血磷 0.4 ~ 0.52 mmol/L,24 h 尿磷 18 ~ 23 mmol/L,血钙 2.02 ~ 2.2 mmol/L,维生素 D 30.5 ~ 46.4 nmol/L,PTH 8.9 pmol/L。根据病例1和病例2的经验,我们进行了18F-FDG标记的PET-CT全身扫描,但第1次未见异常代谢增高影像。与PET-CT中心充分沟通患者病情,再次进行了18F-FDG标记的PETCT的补充扫描,在右侧大腿半膜肌发现一代谢稍增高圆形灶。进一步通过68Ga-TATE核实,右侧大腿中部半膜肌肉内可见圆形高代谢灶,较常规18F-FDG标记的PET-CT代谢明显增强(图6),考虑原发间叶组织来源肿瘤可能性大。2017年5月超声及双下肢磁共振证实,右大腿中段半膜肌与大收肌间隙异常信号,考虑血管瘤可能。综合病史及诸影像学资料,考虑右侧大腿中部半膜肌内占位导致TIO。转骨科于5月18日行右大腿中部半膜肌肉内占位切除术,在大收肌和半膜肌之间钝性剥离一大小约1 cm×2 cm×1 cm、质韧、界限清楚的包块。术后病理回报梭形细胞间叶源性肿瘤,符合高磷酸盐尿间叶瘤,混合结缔组织型。术后第4天(2017年5月22日),患者双下肢疼痛、乏力明显改善;术后第7天,可持拐杖站立;术后第10天可放弃拐杖,缓慢步行数步。术后复查肾小管重吸收磷率87.67%,术前及术后血磷变化见图7。截至2017年8月,即术后3个月,复查血磷1.35 mmol/L,已可放弃拐杖,独立行走,生活自理,无不适主诉。
讨 论
以上3例发病时分别为青少年男性、绝经后女性、老年男性,表现为不同程度的无力、行走困难、全身骨痛,伴或不伴多发骨折,血磷低,而尿磷异常升高,碱性磷酸酶升高,骨密度提示不同程度骨密度下降至重度骨质疏松。我们可以看到TIO因起病及病灶隐匿,病情发展缓慢,且较罕见,未被临床认识,故常被诊断为低磷血症未被重视,明确诊断前常需辗转多家医院甚至多科室。低磷血症这一类疾病,临床上分为原发性:X连锁显性遗传性低磷性骨软化症,常染色体显性遗传性低磷性骨软化症;继发性:肿瘤相关低磷软骨病[1]。1947年McCance[5]首次报道TIO。1959年Prader等[6]最先报告肿瘤为骨软化症的致病因素,肿瘤切除后,病情缓解。1980年协和张孝骞等[7]报告我国首例TIO病例。截至2016年底全球报道约350例[8]。尽管TIO诊断困难,但一旦明确诊断,发现病灶,肿瘤切除后治疗效果好,故临床上遇到成人起病,无家族史的低磷软骨病患者,应通过多种检查手段排查TIO[9]。
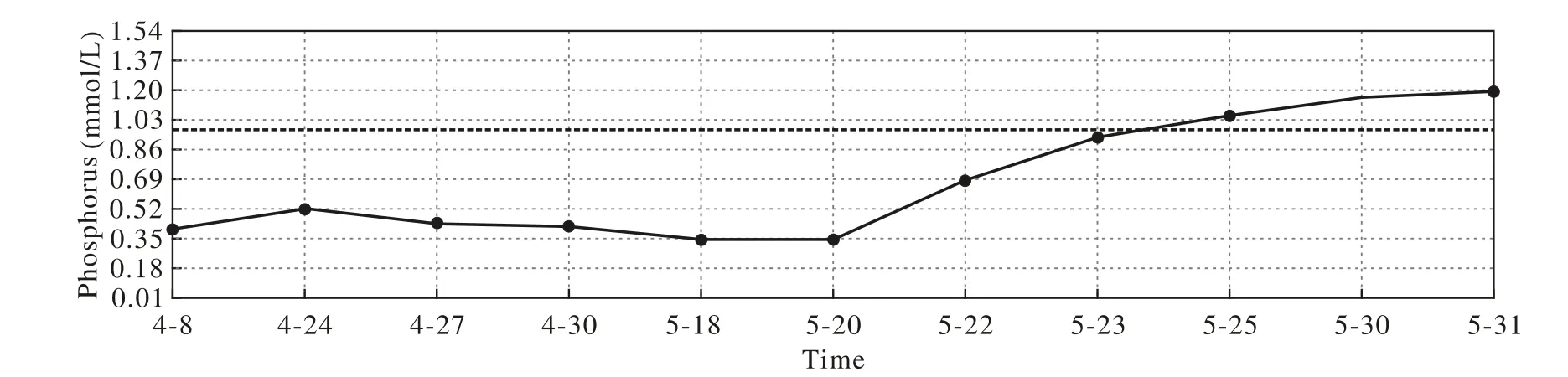
图7 病例3手术前后血磷变化 (手术日期2017年5月18日)Fig. 7 Level of phosphorus in case 3 before and after surgery (the date of surgery is May, 18th, 2017)
该病发病机制是组成肿瘤的梭形细胞分泌成纤维细胞生长因子-23,抑制近端肾小管钠磷转运蛋白,造成肾重吸收磷减少而致尿磷增加,血磷下降[2]。其病理分型统称为磷酸盐尿性间叶肿瘤(phosphaturic mesenchymal tumor,PMT)[10-12]。 又 可以分为4种亚型:混合结缔组织型(最常见,病理形态多样),骨母细胞样型,骨化纤维瘤样型,非骨化纤维瘤样型。也有学者认为具有典型形态者称其相应诊断名称(如血管内皮细胞瘤等),不典型者则结合其临床称为PMT。病例1病理考虑血管周细胞瘤,而病例2病理结论为血管内皮细胞瘤,病例3则因其不典型病理表现称为PMT。PMT因其浸润性生长方式,手术往往不易完整切除,部分病例有复发可能,病例2即为病变部位解剖结构复杂不易切除,第1次手术切除后再次复发。
对肿瘤进行定位及定性诊断是TIO治疗的前提和关键。目前临床广泛认可的是奥曲肽显像(99m Tc-OCT)[13-14]。但由于奥曲肽显像主要与生长抑素受体的2、5亚型亲和力高,少部分表达生长抑素受体1、3、4亚型的肿瘤可能出现奥曲肽检查阴性的结果[2,4,15];因此即便OCT阴性亦不能排除TIO,还应利用CT、MRI、PET-CT进一步排查[4,16]。本文中的3例患者均如此,常规的检查均为阴性,但通过PET-CT的检查均可发现高代谢病灶;尤其第3例行常规PET-CT时由于病变位置靠下,提示代谢轻度升高,在第1次漏诊情况下,利用68Ga标记的DOTA-TATE生长抑素受体阳性的肿瘤显像[17-19]最终发现了病灶,手术切除后病人痊愈。而关于68Ga-TATE-PET-CT目前国内尚处研究阶段,我们通过本院病例已发现该检查对于TIO诊断有较高的敏感性,为在以后的临床工作中隐匿病灶的TIO提供了新的检测手段。
1 Hautmann AH, Hautmann MG, Kölbl O, et al. Tumor-Induced Osteomalacia : an Up-to-Date Review[J]. Curr Rheumatol Rep,2015, 17(6): 512.
2 ADHR Consortium. Autosomal dominant hypophosphataemic rickets is associated with mutations in FGF23[J]. Nat Genet, 2000, 26(3):345-348.
3 El-Maouche D, Sadowski SM, Papadakis GZ, et al. 68Ga-DOTATATE for Tumor Localization in Tumor-Induced Osteomalacia[J]. J Clin Endocrinol Metab, 2016, 101(10): 3575-3581.
4 Breer S, Brunkhorst T, Beil FT, et al. 68Ga DOTA-TATE PET/CT allows tumor localization in patients with tumor-induced osteomalacia but negative 111In-octreotide SPECT/CT[J]. Bone, 2014, 64 :222-227.
5 McCANCE RA. Osteomalacia with Looser's nodes (Milkman's syndrome) due to a raised resistance to vitamin D acquired about the age of 15 years[J]. Q J Med, 1947, 16(1): 33-46.
6 Prader A, Illig R, Uehlinger E, et al. [Rickets following bone tumor][J]. Helv Paediatr Acta, 1959, 14 : 554-565.
7 张孝骞, 朱预, 刘彤华, 等. 间叶瘤合并抗维生素D的低血磷骨软化病一例报告[J]. 中华医学杂志, 1981, 60(3): 150-152.
8 Chong WH, Molinolo AA, Chen CC, et al. Tumor-induced osteomalacia[J]. Endocr Relat Cancer, 2011, 18(3): R53-R77.
9 Houang M, Clarkson A, Sioson L, et al. Phosphaturic mesenchymal tumors show positive staining for somatostatin receptor 2A (SSTR2A)[J]. Hum Pathol, 2013, 44(12): 2711-2718.
10 Imel EA, Peacock M, Pitukcheewanont P, et al. Sensitivity of fibroblast growth factor 23 measurements in tumor-induced osteomalacia[J]. J Clin Endocrinol Metab, 2006, 91(6): 2055-2061.
11 Agaimy A, Michal M, Chiosea S, et al. Phosphaturic Mesenchymal Tumors: Clinicopathologic, Immunohistochemical and Molecular Analysis of 22 Cases Expanding their Morphologic and Immunophenotypic Spectrum[J]. Am J Surg Pathol, 2017, 41(10):1371-1380.
12 Folpe AL, Fanburg-Smith JC, Billings SD, et al. Most osteomalaciaassociated mesenchymal tumors are a single histopathologic entity:an analysis of 32 cases and a comprehensive review of the literature[J].Am J Surg Pathol, 2004, 28(1): 1-30.
13 Paglia F, Dionisi S, Minisola S. Octreotide for tumor-induced osteomalacia[J]. N Engl J Med, 2002, 346(22): 1748-1749.
14 Jiang Y, Xia WB, Xing XP, et al. Tumor-induced osteomalacia :an important cause of adult-onset hypophosphatemic osteomalacia in China : Report of 39 cases and review of the literature[J]. J Bone Miner Res, 2012, 27(9): 1967-1975.
15 Jadhav S, Kasaliwal R, Lele V, et al. Functional imaging in primary tumour-induced osteomalacia: relative performance of FDG PET/CT vs somatostatin receptor-based functional scans: a series of nine patients[J]. Clin Endocrinol (Oxf), 2014, 81(1): 31-37.
16 Panagiotidis E, Alshammari A, Michopoulou S, et al. Comparison of the Impact of 68Ga-DOTATATE and 18F-FDG PET/CT on Clinical Management in Patients with Neuroendocrine Tumors[J]. J Nucl Med, 2017, 58(1): 91-96.
17 Abdulrezzak U, Kurt YK, Kula M, et al. Combined imaging with 68Ga-DOTA-TATE and 18F-FDG PET/CT on the basis of volumetric parameters in neuroendocrine tumors[J]. Nucl Med Commun,2016, 37(8): 874-881.
18 Florenzano P, Gafni RI, Collins MT. Tumor-induced osteomalacia[J].Bone Rep, 2017, 7 : 90-97.
19 Hofman MS, Lau WF, Hicks RJ. Somatostatin receptor imaging with 68Ga DOTATATE PET/CT: clinical utility, normal patterns, pearls,and pitfalls in interpretation[J]. Radiographics, 2015, 35(2):500-516.
