单纯钻孔引流与神经内镜辅助治疗慢性硬膜下血肿的临床分析
2018-04-13安文志王文成姬广福李继禄
安文志 王文成 陈 晨 姬广福 郑 伟 李继禄
(1.泰山医学院,山东 泰安 271000; 2.汕头大学医学院临床学院,广东 汕头 515000;3.泰山医学院第一临床学院神经外科,山东 泰安 271000)
慢性硬膜下血肿(chronic subdural hematoma,CSDH)指外伤后超过3周、位于硬脑膜与蛛网膜之间的血肿,为神经外科中的常见疾病,好发于50岁以上的中老年人[1-3]。其致病原因目前仍未完全明确,主要考虑与颅脑外伤、脑萎缩、凝血机制障碍等因素有关[4-5]。CSDH临床症状常表现为头晕、头痛、智力障碍、精神异常,有些患者还出现对侧肢体运动障碍、偏瘫、失语等[6]。药物保守治疗和手术治疗是CSDH的主要治疗方式,其中手术治疗术式多样,如钻单孔引流术、钻双孔引流术、小骨窗冲洗引流术、穿刺针微型穿刺引流术、血肿包膜剥脱术[7]。本研究主要回顾性探讨分析神经内镜辅助下和经典的单纯钻孔引流治疗CSDH的临床效果。
1 资料与方法
1.1 一般资料
纳入标准:(1)排除长期服用抗凝药物及凝血机制障碍的CSDH患者;(2)临床症状明显,严重影响患者日常生活,患者或家属同意行手术治疗并签署手术知情同意书者;(3)均经颅脑 CT或颅脑MRI确诊,血肿体积按多田公式计算均大于50ml的单侧CSDH患者(4)术后随访满1年 。将我院自2011年01月至2013年01月应用单纯钻孔引流治疗的54例CSDH患者作为对照组,将我院自2013年02月购入神经内镜后至2015年02月应用神经内镜辅助下钻孔引流治疗的52例CSDH患者作为实验组。两组患者主要症状为头晕、头痛,肢体运动障碍,失语,恶心、呕吐,意识模糊等。其中实验组男性42例,女性10例,年龄57~87岁,平均(68.75±8.198)岁,有明确外伤史者46例。GCS15分者7例,13分者3例,12分者2例。对照组男性40例,女性14例,年龄51~88岁,平均(66.78±8.711)岁,有明确外伤史者42例。GCS15分者45例,14分者2例,13分者5例,12分者2例。影像学资料:实验组颅脑CT示中线移位≥10 mm者31例,血肿量55~103 ml,平均(82.46±14.958)ml。血肿呈现稍高密度影者11例,等密度影者19例 ,低密度影者12例,高低密度混杂影者8例。对照组颅脑CT示中线移位≥10 mm者26例,血肿量为52~105ml,平均(82.69±14.442)ml。血肿呈现稍高密度影者8例,等密度影者28例 ,低密度影者13例,高低密度混杂影者5例。通常我们应用Markwalder神经功能分级评价CSDH患者术前、术后的神经功能情况。在临床工作中,Markwalder分级存在少许不足。苏少波[8]等将其与患者肌力、肌张力、意识水平及GCS评分情况结合,得出改良Markwalder分级[8],见表1。

表1 改良Markwalder分级
1.2 手术方法
(均在心电监护下行局部麻醉,对考虑术中可能不能完全配合者,由麻醉医生给予适当短效静脉镇静)
1.2.1实验组根据术前影像学资料大体确定血肿位置。麻醉成功后,调整头部位置使血肿最厚处位于最高点。常规消毒铺巾后,做一长约4cm纵行直切口(尽量避开侧裂及重要功能区),充分止血后头皮拉钩拉开皮肤,剥离骨膜,颅骨钻钻一枚直径约1.5 cm骨孔,扩大至2.5 cm左右,骨窗边缘涂抹骨蜡,适当悬吊硬脑膜,双极电凝硬脑膜后 “十”字切开,硬脑膜切缘电凝止血。引入30°神经内镜伸入血肿腔,沿颅骨内板在显示器直视下缓慢前行,避免镜头损伤大脑皮层,同时给予37 ℃生理盐水不断冲洗。若发现血肿分隔膜,沿内镜工作通道引入电凝破坏隔膜,冲净血肿或血性液体,若发现出血可用神经内镜双极电凝止血,至水环境中澄清为止。沿原通道退出神经内镜,用相同方法清除其他方向硬膜下血肿。关颅前血肿腔内充满生理盐水(排净空气)。留置颞枕部引流管(引流管含三个侧孔),另口出皮,固定牢靠,外接无菌引流瓶,清点器械无误后常规关颅。
1.2.2对照组“十”字切开硬脑膜并将切缘电凝止血后,用枪状镊向血肿腔置入引流管。边前行边用37℃生理盐水缓慢冲洗,至冲洗液澄清为止(如遇阻力立即停止前行)。沿原路径退出引流管后,用相同方法清除其他方向硬膜下血肿。其他方法与实验组基本相同。
两组患者术后:仰卧位,头高不超过30°,常规心电监护、吸氧24 h,给予患者常规补液2000~2500 ml(术前30 min内及术后24 h内各应用抗生素一次),同时鼓励患者增加饮水量,术后48h复查颅脑CT待引流液体减少或引流液体澄清拔除引流管。术后48h、7天、1月、3月、6月、12个月复查颅脑CT或颅脑MRI。
1.3 复发标准[9]
术后3个月内复查颅脑CT提示血肿量较术后1~3天再增加、临床神经症状更加严重被认为复发。
1.4 统计学处理
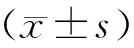
2 结 果
两组患者在年龄、性别、血肿量、颅脑CT下血肿密度等一般方面无明显差别(P>0.05)。实验组术中在神经内镜直视下见有血肿分隔者4例,均在不增加医源性损伤的情况下最大程度的破坏并清除血肿分隔,利用神经内镜双极对微小渗血进行止血。术后48h复查颅脑CT提示无急性出血患者,颅内少量积气者5例。术后7天颅脑CT提示积气完全吸收。术后3个月颅脑CT提示复发1例。对照组术后48 h复查颅脑CT提示脑挫裂伤者1例,颅内少量积气者6例。术后7天颅脑CT提示颅内出血者基本吸收,无需再次手术,积气完全吸收。3例患者残留少量低密度血性液体,无需手术。术后3月复查6例复发(其中3例再次于我院行手术治疗)。应用改良Markwalder分级评定神经功能,两组患者术后改良Markwalder分级均降低,神经功能较术前均有好转(P<0.05),但好转程度无明显区别(P>0.05)。另外,实验组较对照组手术时间长、住院时间短、术后复发率低(P<0.05),见表2、表3。

表2 两组神经功能、手术时间、住院时间情况
注:与术前相比P1<0.05,P2<0.05,与术后相比,P1>0.05;与对照组相比,P3<0.05,P4<0.05。

表3 两组复发与治愈情况
注:与对照组相比,P5<0.05,差异有统计学意义。
综上所述,两组患者术后神经功能好转程度无明显区别(P>0.05),差异无统计学意义。实验组较对照组手术时间长、住院时间短、术后复发率低(P<0.05),差异有统计学意义。
3 讨 论
CDSH是神经外科临床中常见病、多发病,但迄今为止其致病原因仍未完全明确,学者们虽提出过多种学说,但无法完全解释CSDH发病机制[1-2]。Virchow[9]于1857年首次对CSDH发病机制进行了阐述,提出了硬脑膜内层炎症学说。桥静脉血说认为发生颅脑外伤时,由于惯性原因使颅骨与脑组织产生相对位移,导致桥静脉等微小血管被牵拉、破裂,导致慢性渗血,逐渐形成CSDH[1,5]。另外,有研究证明外伤性硬膜下积液(traumatic subdural effusion,TSE)逐渐演化为CSDH[10]。神经内镜辅助下钻孔引流同单纯钻孔引流相比优势明显,它有一套照明及可视系统,同时拥有电凝及吸引器工作通道,这样可以在直视下观察CSDH情况,并利用其工作通道清除血肿[11];另外神经内镜可以发现单纯钻孔引流无法发现的血肿分隔,通过神经内镜双极电凝破坏血肿分隔并予以清除,避免无菌炎症的持续发生,降低CSDH复发的可能;也可以应用神经内镜尽可能止血,减少术后急、慢性出血、颅内感染等并发症[12]。神经内镜辅助下钻孔引流治疗CSDH也有弊端,比如手术时间相对较长,会增加脑组织的暴露时间。另外,如果神经内镜操作不熟练,会增加术中医源性损伤脑组织的风险,而钻孔引流术手术时间较短,操作较简单,手术效果尚可。对于硬质内镜,无法转弯,对于处于边角的血肿及隔膜无法完全清除,此时应用软质内镜可能会取得更好的手术效果[12]。
本研究体会:(1)对照组复发率高于实验组的原因,可能与钻孔引流组术中未完全清除血肿分隔或微小隔膜未予以破坏有很大关系。若血肿分隔未完全清除,无菌性炎症会持续存在,分隔中的微小血管持续缓慢渗血会促进慢性血肿及分隔的再次形成。(2)术后通过适当增加补液量、降低头位、头偏向患侧促进脑组织膨胀,对降低复发率可能有帮助。(3)术中保证骨窗位于最高处,术后关颅前颅内充满生理盐水常规留置引流管,可以减少气颅的发生。
参考文献:
[1]王忠诚.神经外科学[M].武汉.湖北科学技术出版社,2005:442-445.
[2]Borger V,Vatter H,Oszvald á,et al.Chronic subdural haematoma in elderly patients: a retrospective analysis of 322 patients between the ages of 65-94 years[J].Acta Neurochir (Wien),2012,154:1549-1554.
[3]Kageyama H,Toyooka T,Tsuzuki N,et al. Nonsurgical treatment of chronic subdural hematoma with tranexamic acid[J]. J Neurosurg,2013,119(2):332-337.
[4]Emich S,Richling B,McCoy MR,et al.The efficacy of dexamethasone on reduction in the reoperation rate of chronic subdural hematoma -the DRESH study:straightforward study protocol for a randomized controlled trial[J].Europepmc,2014,15:6.
[5]Liu W, Bakker NA, Groen RJ. Chronic subdural hematoma: a systematic review and meta-analysis of surgical procedures: a systematic review[J].Neurosurg,2014,121(3):665-673.
[6]Osuka K,Watanabe Y,Usuda N, et al.Inhibitory mechanism of the outer membrane growth of chronic subdural hematomas[J]. Neurotrauma,2017,34:1996-2000.
[7]Manickam A,Marshman LAG,Johnston R.Long-term survival after chronic subdural haematoma[J].Clin Neurosci, 2016,12(34):100-104.
[8]苏少波.慢性硬膜下血肿外膜超微结构和外周血EPCs的观测及临床特征分析[D].天津.天津医科大学,2010.
[9]KO B S,LEE J K,SEO B R,et al.Clinical analysis of risk factors related to recurrent chronic subdural hematoma[J].J Korean Neurosurg Soc,2008,43(1):11-15.
[10]Tanweer O,Frisoli FA,Bravate C, et al.Tranexamic acid for treatment of residual subdural hematoma after bedside twist-drill evacuation[J].World Neurosurg,2016,91:29-33.
[11]Cokluk C.The neuroendoscopic assisted microsurgical evacuation of chronic subdural hematomas[J].Clin Anal Med,2016,10.4328/JCAM.1353.
[12]Yokosuka K, Uno M,Matsumura K, Takai H, Hagino H, Matsushita N, Toi H, Matsubara S.Endoscopic hematoma evacuation for acute and subacute subdural hematoma in elderly patients[J].Neurosurg,2015,123(4):1065-1069.
