喷施茉莉酸甲酯对百合花香的影响
2018-04-13付宇辰闫子飞王少杰冷平生胡增辉
吴 琦, 付宇辰, 闫子飞, 王少杰, 冷平生,2, 胡增辉,2
(1.北京农学院园林学院,北京 102206; 2.北京林果业生态环境功能提升协同创新中心,北京 102206)
植物的花香被誉为“花卉的灵魂”,是植物花朵释放的次生代谢产物,主要是由许多低分子量、易挥发的化合物混合而成[1]。大多数花香物质属于三大类,即萜烯类化合物、芳香烃类化合物和脂肪酸衍生物,还包含一些氮或硫的化合物。挥发性香气成分主要来源于花瓣、蕊柱、花萼和蜜腺等,其他花器官也能散发少量的香气[2-3]。植物花香的组分及其相对含量与其自身的基因型、发育程度、释放部位、温度、光照和植物激素等有关。影响植物挥发物释放的植物激素种类很多,如乙烯、脱落酸类、水杨酸类、茉莉酸类等等[4-6]。目前研究的相对比较热门的激素之一是茉莉酸类激素,且已经有相应的试验结果证明茉莉酸类物质对调控植物的次生代谢作用具有显著的影响。
茉莉酸类化合物(JAs)是植物体内普遍存在的激素,包括茉莉酸(JA)及其衍生物,如茉莉酸甲酯(MeJA)及茉莉酸异亮氨酸复合物(JA-Ile)。茉莉酸最早由茉莉花中提取出来,可以作为信号分子广泛参与植物的生长发育、胁迫响应和防御反应,在植物细胞的生理过程中起着重要的信号作用[7-8]。在大多数的研究中,施用茉莉酸类激素的常用方法是用MeJA溶液均匀喷洒在植物体表面,使MeJA经过气孔进入植物体内并被在细胞质中的酯酶水解,最终以茉莉酸形式远距离进行信号传导,诱导植物产生代谢反应。
研究表明,MeJA能够影响植物挥发物的释放。桂连友等发现MeJA可以促进茶树新梢中的罗勒烯释放[9]。王立春等用不同浓度的MeJA喷洒马尾松后,发现单萜类物质α-蒎烯和β-蒎烯的释放都明显高于对照[10]。廖永翠对白木香悬浮细胞进行热激处理,使内源茉莉酸含量显著增加,进而诱导了3种沉香倍半萜的生成,说明茉莉酸信号与沉香倍半萜的合成有直接的关系[11]。花香是植物释放出的一类重要挥发性次生代谢物,但茉莉酸对植物花香影响的研究报道较少,其调控方式和机制还不清楚。
百合(Liliumspp.)是百合科(Liliaccae)百合属(Lilium)所有种的总称,其花朵硕大,花色丰富,常具有芳香气味,有很高的观赏价值,是世界五大切花之一。为了探索茉莉酸对花香释放的影响,本试验选用浓香型东方百合西伯利亚(Lilium‘Siberia’)为试验材料,经过不同浓度的MeJA溶液处理后,使用顶空套袋法采集花朵挥发物,利用自动热脱附-气质联用技术分析挥发物成分及含量,探究不同浓度MeJA溶液对西伯利亚百合花朵挥发物合成及释放的影响, 为揭示茉莉酸类激素的作用机制,进而对花香进行调控和育种提供依据。
1 材料与方法
1.1 试验材料
本试验使用荷兰进口的西伯利亚百合种球(北京荷景良苑贸易有限公司),直径14~16 cm,于2016年4月种植于北京农学院园林植物实践基地内。草炭和蛭石按1 ∶1的比例混合作为栽培基质,日光温室温度控制在23~26 ℃,湿度60%~70%,通风良好,每3 d浇一次水,生长周期大约为 90 d,待花蕾硕大并开始显色,即可准备采集花朵挥发物。选择长势健壮一致,无病虫害,且处于盛花期的植株采集花香。
1.2 处理方法
将购自Sigma公司的95%茉莉酸甲酯用5%的无水乙醇溶解,配制成50、200、600 μmol/L的MeJA溶液。选取晴朗无云的天气,于11:00—14:00对西伯利亚百合花瓣均匀喷施3种浓度的MeJA溶液,喷施后立即套袋熏蒸。熏蒸1 h后将熏蒸袋取下并用脱脂棉轻轻擦拭花朵,除去花瓣表面残留的液滴,进行花朵挥发物收集。设置未做任何处理的植株作为空白对照,每种处理设置3个生物学重复。
1.3 香气采集
采用动态顶空法进行花朵挥发物收集。将干净的采样袋(355 mm×508 mm,Reynolds,USA)套在百合花朵上,连接大气采样仪进行3次抽吸,进气过程经过装有活性炭的干燥塔除杂,完成全部抽吸后静置10 min。用无味硅胶管连接 Tenax-GR 吸附管(60-80 mesh,Chrompack),开启大气采样仪,设定采集流速为0.1 L/min,采样时长为20 min。采集花香挥发物前先采集棚内空气作为对照。
1.4 花香分析
采用自动热脱附-气质联用技术进行花香成分及含量的鉴定和分析。自动热脱附(TurboM-atrix 650,PerkinElmer)条件:260 ℃条件下一级热脱附10 min,-25 ℃冷却3 min,300 ℃保持5 min进行二级热脱附。气相色谱(Clarus 600,PerkinElmer)条件:色谱柱DB-5MS柱(30 m×0.25 mm×0.25 μm);载气He;运行程序为40 ℃保持2 min,4 ℃/min的速度升温至160 ℃,再以20 ℃/min升温至270 ℃,保持 3 min。质谱(Clarus 600T,PerkinElmer)条件:电离模式EI;电子能量70 eV;质谱扫描范围29~600 amu;接口温度250 ℃;离子源温度220 ℃。
1.5 香气成分鉴定与分析
使用TurboMass Ver5.4.2软件对总离子流分析,根据NIST08数据库的检索鉴定挥发物的成分,记录整理峰面积值。用α-蒎烯做外标,进一步确定各化合物成分的释放量。使用WPS表格统计分析结果并绘制表格。使用SPSS16进行显著性分析,显著性水平P<0.05。
2 结果与分析
2.1 西伯利亚百合花朵挥发物总释放量分析
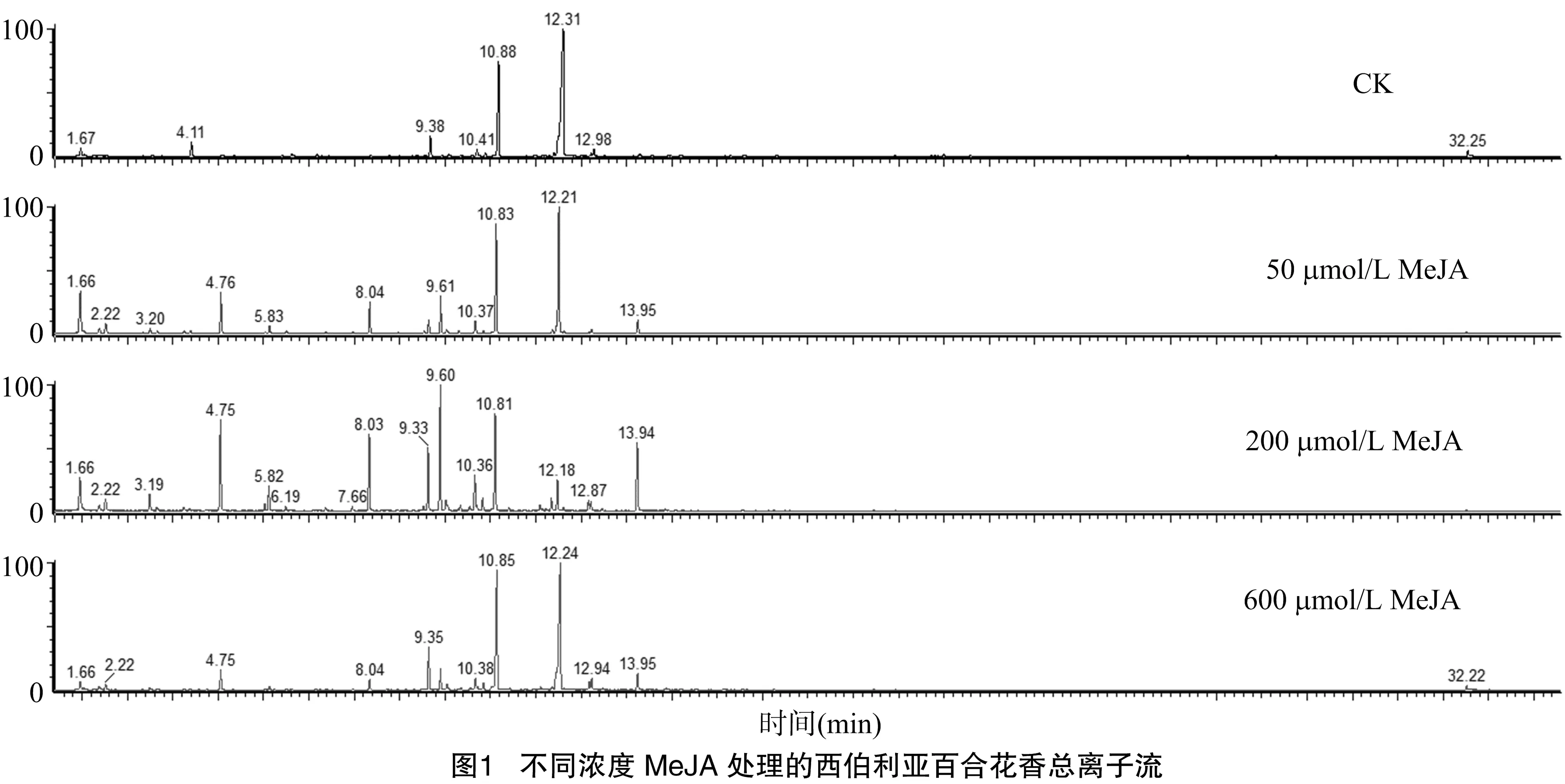
图1是不同浓度MeJA处理的西伯利亚百合花香总离子流图,经过MeJA处理的西伯利亚百合离子流图中的峰数量和峰面积比未经处理的对照组明显增多,200 μmol/L MeJA处理组最为突出。图2是对各个峰分析后得到的不同MeJA浓度下花香挥发物总释放量统计结果,结果显示,随着喷施的MeJA溶液浓度增加,花香挥发物总释放量呈先下降后上升的趋势。用50 μmol/L的MeJA溶液喷施花朵后,挥发物释放总量有明显的下降趋势,仅为空白对照的60%。而用 200 μmol/L和600 μmol/L的MeJA溶液喷施后,挥发物含量有显著的提高,特别是经过200 μmol/L的MeJA溶液喷施后,挥发物释放量比空白对照增加了1/5,效果最为明显。
2.2 西伯利亚百合花朵不同种类挥发物相对释放量的差异
表1显示了西伯利亚百合花香挥发物成分归类数量统计结果,其花香挥发物的成分主要可以分为萜烯类、酯类、醇类、脂肪烃类、芳香烃类、醛类、酮类和其他八大类,约50多种不同的挥发物成分,其中种类最多的是酯类,其次是萜烯类,占总体的一半以上。经过200 μmol/L和600 μmol/L的MeJA溶液喷施的西伯利亚百合释放物质种类基本持平,仅有个别物质出现轻微差异,均比对照组多。
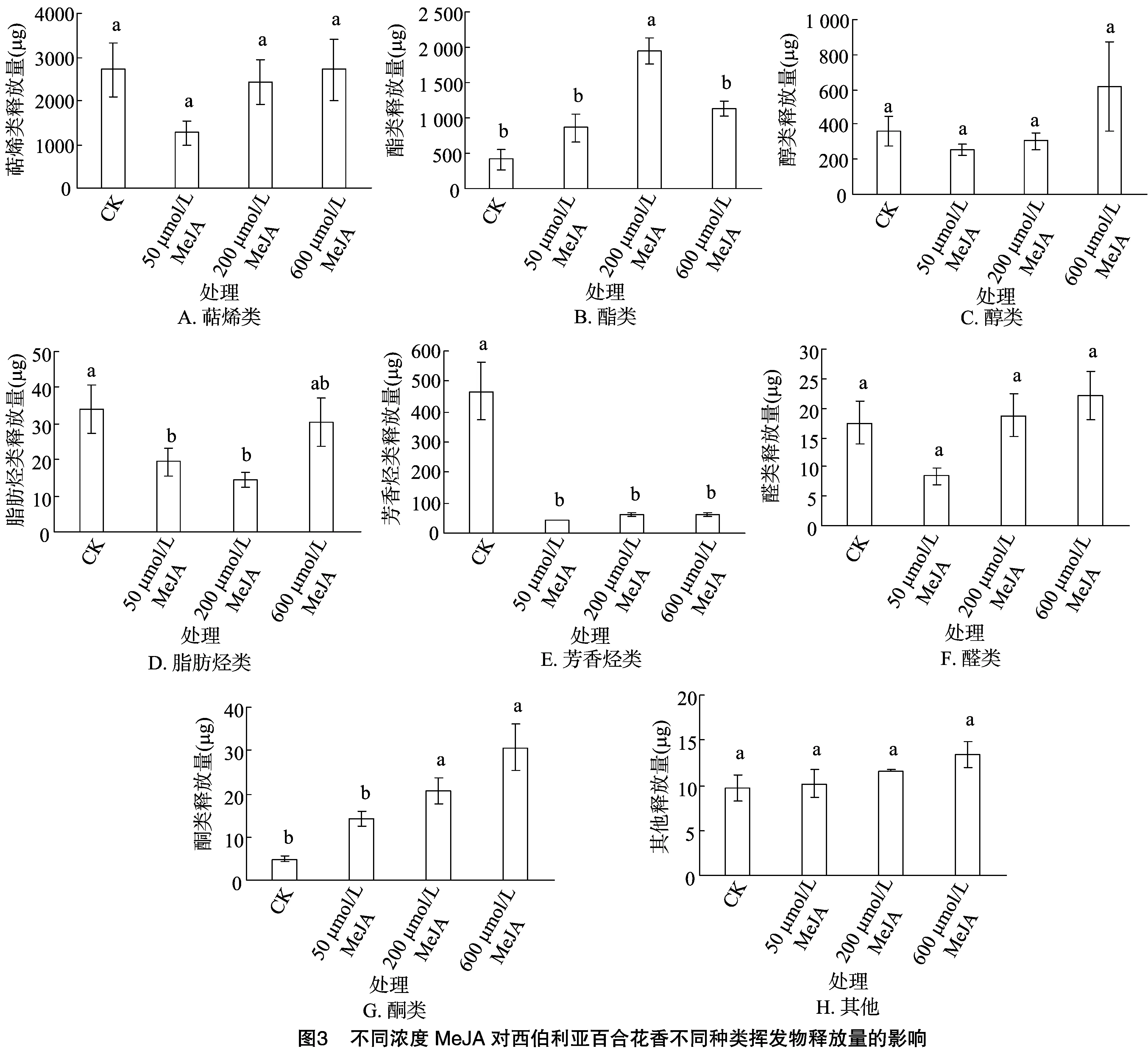
对物质进行归类和释放量的统计,发现花香挥发物中萜烯类和酯类的平均释放量相对较高,随着喷施浓度的增加,酮类、其他类物质的释放含量呈逐渐上升趋势(图3)。萜烯类(图3-A)是西伯利亚百合花香的主要物质,其次是酯类(图3-B),醇类(图3-C)、脂肪烃类(图3-D)、芳香烃类(图3-E)、醛类(图3-F)、 酮类(图3-G)和其他类物质(图3-H)的含量依次减少。经过不同浓度MeJA溶液喷施后,萜烯类、醇类、醛类、酮类和其他类物质随着MeJA含量的增加,释放量呈上升趋势,最高时可达到之前的2倍左右。酯类的释放量呈现先增高后下降的趋势,经过200 μmol/L的MeJA溶液喷施后, 其释放量几乎是空白对照的5倍。脂肪烃类物质随MeJA溶液浓度升高,释放量先下降后升高;芳香类的释放量对MeJA溶液浓度的改变几乎无响应,仅为对照的13%。部分类别的花香挥发物在经过50 μmol/L的MeJA溶液处理后,释放量有不同程度的下降,而随着浓度的增加,花香释放量逐渐增加。
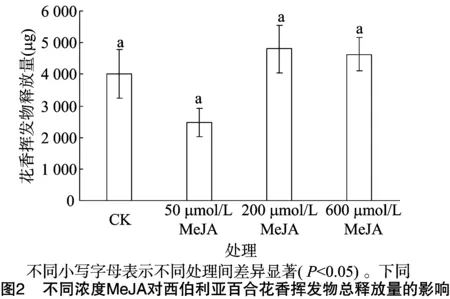
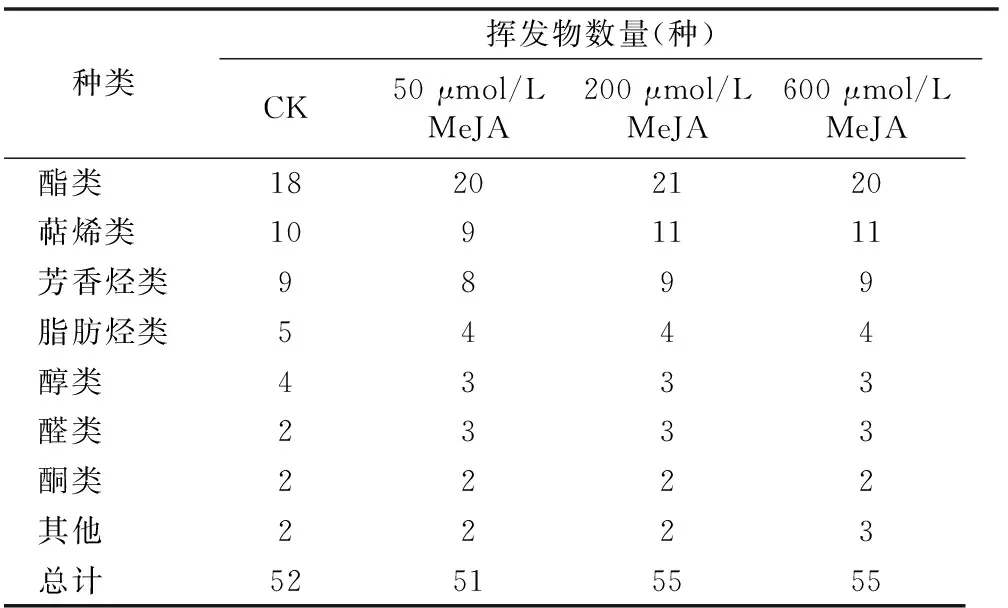
表1 不同浓度MeJA对西伯利亚百合花香挥发物种类数量的影响
2.3 西伯利亚百合花朵主要挥发物释放量随溶液浓度的变化
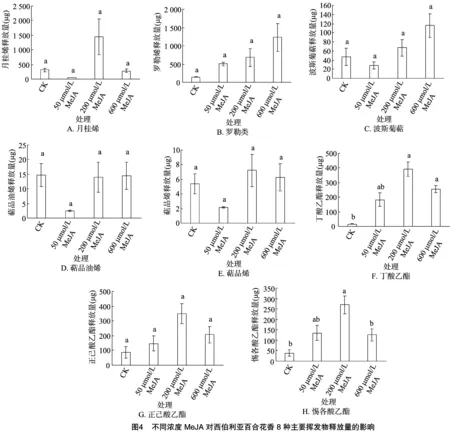
本研究从50多种不同的挥发物成分中筛选出了8种代表性成分,并对这8种成分的释放量进行分析。从图4可以看出,月桂烯和罗勒烯是西伯利亚百合最主要的花香成分,还包括有一些其他的萜烯类和酯类物质。大部分主要物质如月桂烯(图4-A)、萜品烯(图4-E)、丁酸乙酯(图4-F)、正己酸乙酯(图4-G)和惕各酸乙酯(图4-H)在经过不同浓度MeJA溶液喷施后,随着溶剂浓度升高,表现出先升高后下降的趋势,在200 μmol/L的MeJA喷施后,挥发量最高,大部分都比空白对照增加了3~6倍,甚至更多。罗勒烯(图4-B)和波斯菊萜(图4-C)的释放量随着MeJA浓度的升高逐渐升高,在600 μmol/L时达到最高,分别比对照提高了7倍和1.5倍。萜品油烯(图4-D)在200 μmol/L和600 μmol/L的MeJA溶液喷施后释放量没有特别明显的差异。
3 讨论
花香是通过植物次生代谢反应产生的,是花卉的重要观赏性状之一,决定着花朵整体的观赏价值,甚至比花色和花型更能影响消费者的决定[12],因此有关的花香研究和花香育种工作逐渐成为近些年研究的热点内容。
本试验用MeJA溶液喷施西伯利亚百合花朵,大部分花香挥发物的释放量都有一定程度的增加,这与巩莎等得到的结果[13]相似。在已有的研究成果中也发现花青素、生物碱、黄酮类、萜类[14-16]等次生代谢产物均受到茉莉酸信号的调控。
本研究中用不同浓度的MeJA对西伯利亚百合花朵进行喷施,大部分花香挥发物在经200 μmol/L或600 μmol/L的MeJA处理后,花香挥发物增加量比较明显,低浓度的MeJA溶液(50 μmol/L)反而对百合花瓣的挥发物释放产生了抑制。王焕发现高浓度(600 μmol/L)的MeJA溶液比低浓度(200 μmol/L)的MeJA溶液更能有效促进阳春砂果皮和种子团中萜类物质的积累,而在叶片中,高浓度的MeJA溶液(600 μmol/L)则产生了抑制作用[17]。因此推测不同浓度MeJA溶液对不同部位的作用效果不一致。
廖永翠发现在白木香愈伤组织中,茉莉酸核心合成酶基因脂氧合酶(LOX)、丙二烯氧化合酶(AOS)和丙二烯氧化物环化酶(AOC),JA信号转导途径中的冠菌素不敏感蛋白1(COI1)、茉莉酸ZIM结构域蛋白(JAZ)、JAZ互作子蛋白(NINJA)、转录因子MYC2等基因对MeJA的响应比热激伤害和机械伤害更为强烈,在0.5 h时基因的表达量急速增加,在4 h时表达量达到最高[11]。由此可以推断,这些基因的激活可以有效促进植物内源茉莉酸的积累,打破植物体原有的激素平衡,并进一步诱导植物次生代谢反应的进行,增加了如萜烯类等次生代谢产物的合成。也有研究表明,萜类骨架及挥发性萜类生物合成途径中部分基因的表达与JA信号转导密切相关,且均为正相关,如JAZ和MYZ2基因就和甲羟戊酸(MVA)途径中的乙酰乙酰辅酶A转移酶(AACT)、二磷酸甲羟戊酸脱羧酶(MVD)、羟基甲基戊二酰-CoA合成酶(HMGS)等基因;2-C-甲基-D-赤藓糖醇-4-磷酸(MEP)途径中的1-脱氧-D-木酮糖-5-磷酸还原异构酶(DXR)、1-脱氧-D-木酮糖-5-磷酸合酶(DXS)、1-羟基-2-甲基-2-(E)-丁烯基-4-磷酸合酶(HDS)等基因有极强相关性。Su等发现喷施MeJA溶液可以使倍半萜合成途径中的(反)-β-法呢烯基因的表达上调,且(反)-β-法呢烯的释放量也随之显著上升[18]。魏洁书通过试验验证得出MeJA可以有效诱导阳春砂MEP途径中萜类合成关键酶基因羟基甲基戊二酰-CoA还原酶(HMGR)和DXR的表达,特别是对低浓度MeJA溶液的响应非常敏感且明显[19]。因此,可以推测茉莉酸合成途径中的关键酶基因,如LOX、AOS和AOC等和萜类合成代谢途径中的某些基因具有很强的关联性,可以诱导萜类合成代谢中MVA途径和MEP途径中关键基因的表达,促进花香挥发物的合成和释放。
综上所述,茉莉酸类激素对西伯利亚百合花香的释放促进作用明显,但其对于萜烯类合成途径的调控机制还有待深入研究,因此,将茉莉酸合成途径中的关键基因作为切入点,探究其与萜烯合成途径中关键基因的表达情况之间的关系,是今后从基因水平上进行花香调控和花香育种的有效途径之一。
参考文献:
[1]孔滢,孙明,潘会堂,等. 花香代谢与调控研究进展[J]. 北京林业大学学报,2012,34(2):146-154.
[2]Dudareva N,Pichersky E. Biology of floral scent[M]. CRC Press,2006.
[3]Borda A M,Clark D G,Huber D J,et al. Effects of ethylene on volatile emission and fragrance in cut roses:The relationship between fragrance and vase life[J]. Postharvest Biology & Technology,2011,59(3):245-252.
[4]Lorenzo O,Solano R.Molecular players regulating the jasmonate signalling network[J]. Current Opinion in Plant Biology,2005,8(5):532-540.
[5]Degenhardt D C,Refi-Hind S,Stratmann J W,et al. Systemin and jasmonic acid regulate constitutive and herbivore-induced systemic volatile emissions in tomato,Solanum lycopersicum[J]. Phytochemistry,2010,71(17/18):2024-2037.
[6]Jiang Y F,Ye J Y,Li S,et al. Regulation of floral terpenoid emission and biosynthesis in sweet basil (Ocimumbasilicum)[J]. Journal of Plant Growth Regulation,2016,35(4):1-15.
[7]Zhu J H,Peng S Q. Jasmonic acid and its signal transmission[J]. Acta Botanica Boreali-Occidentalia Sinica,2006,26(10):200-206.
[8]Shitan N,Sugiyama A,Yazaki K. Functional analysis of jasmonic acid-responsive secondary metabolite transporters[J]. Jasmonate Signaling,2013,1011:241-250.
[9]桂连友,陈宗懋,刘树生. 外源茉莉酸甲酯处理茶树对茶尺蠖幼虫生长的影响[J]. 中国农业科学,2005,38(2):302-307.
[10]王立春,任琴,许志春,等. 茉莉酸甲酯对马尾松松针萜烯类挥发物及马尾松毛虫生长发育的影响[J]. 北京林业大学学报,2008,30(1):79-84.
[11]廖永翠. 茉莉酸信号途径参与调控沉香倍半萜生物合成的分子机制研究[D]. 北京:北京协和医学院,2015.
[12]Sexton R,Stopford A P,Moodie W T,et al. Aroma production from cut sweet pea flowers(Lathyrusodoratus):the role of ethylene[J]. Physiologia Plantarum,2005,124(3):381-389
[13]巩莎,张艳峰,薛皎亮,等. MeJA处理和蚧虫危害对枣树挥发物的影响[J]. 生物学杂志,2012,29(5):43-48.
[14]Chen H,Jones A,Howe G.Constitutive activation of the jasmonate signaling pathway enhances the production of secondary metabolites in tomato[J]. FEBS Letters,2006,580(11):2540-2546.
[15]胡龙娇. 诱导子及光质对半夏生长与次生代谢影响研究[D]. 南京:南京农业大学,2013.
[16]梁晓薇. 茉莉酸甲酯对甘草次生代谢的调控[D]. 广州:广东药科大学,2016.
[17]王焕. MeJA影响阳春砂挥发性萜类和转录组变化的研究[D]. 广州:广州中医药大学,2015.
[18]Su S,Liu X,Pan G,et al. In vitro characterization of a (E)-β-farnesene synthase fromMatricariarecutitaL. and its up-regulation by methyl jasmonate.[J]. Gene,2015,571(1):58-64.
[19]魏洁书. 基于阳春砂HMGR和DXR基因的萜类化合物生物合成调控研究[D]. 广州:广州中医药大学,2013.
