磷酸化P38在神经病理性疼痛大鼠背根神经节中的作用机制
2018-04-13解丽丽吕洪涛许瑞雪
解丽丽,吕洪涛,许瑞雪
(1. 大连市中心医院神经内科,辽宁 大连 116033; 2. 大连医科大学附属第一医院神经外科,辽宁 大连 116011)
丝裂素活化蛋白激酶 (mitogen activated protein kinase,MAPKs) 存在于细胞中,是在细胞信号转导通路中发挥重要作用的丝/苏氨酸蛋白激酶。P38蛋白是MAPKs家族中重要的一员,许多生理性与化学性刺激都能激活P38的磷酸化。JOHNSON等[1]研究发现,ERK、JNK、磷酸化P38(phosphorylated P38,p-P38)蛋白激酶所参与的细胞内信号转导通路在细胞增殖、分化、凋亡、神经元可塑性等多种生理病理过程中发挥重要作用。许力等[2]研究发现,脊髓中的P38与TNF-α活化,抑制P38磷酸化可以减少TNF-α,提示P38可能参与疼痛的中枢敏化。P38广泛存在于脊髓和背根神经节 (dorsal root ganglion,DRG) ,并在炎症反应中发挥着抗炎作用[3-4]。
慢性背根神经节压迫 (chronic compression of dorsal root ganglion,CCD) 模型是一种外周神经病理性疼痛模型,是研究外周神经不完全性损伤的常用动物模型,本研究检测CCD大鼠DRG中p-P38 表达情况,探讨p-P38在神经病理性疼痛大鼠DRG中的作用机制。
1 材料与方法
1.1 动物及分组
18只SD大鼠 (160~180 g,雌性) 由大连医科大学附属第一医院动物实验中心提供。室温饲养,12 h照明/12 h黑暗,水与鼠粮自由食用。实验前大鼠要适应实验室环境1 h。动物使用遵照大连医科大学动物管理委员会要求。大鼠随机均分为3组:假手术组(sham组) 、CCD组、CCD模型SB203580给药组 (治疗组) ,每组6只。分别于术后14 d测完行为学取材。
1.2 试剂
P38抑制剂,4-(4-氟苯) -2-(4-甲磺酰苯) -5-(4-吡啶基) -1氢-咪唑 (SB203580,美国Sigma公司) ;内参β-actin抗体、p-P38抗体与P38抗体 (美国Cell Signaling公司) 。
1.3 CCD模型制备
大鼠腹腔注射l%戊巴比妥钠 (40 mg/kg) 麻醉后,用剃毛刀将腰背部的毛剃光,铺上纸巾暴露出手术野,沿着右侧脊椎从L2-5切开皮肤、分离肌肉。将“L型” (长3 mm、直径0.6 mm) 的不锈钢棒,与背部正中线成30°角,与脊柱侧面水平线成15°。分别插入L3和L4椎间孔,观察到大鼠右后肢抽动即为插入成功。术后腹腔注射青霉素预防感染。鞘内置管在CCD手术前实施,打开L6的硬脑膜,将导管置入大鼠的蛛网膜下腔,大约位于L3-4,缝合后固定导管,等待大鼠恢复24 h后再进行CCD手术。
1.4 大鼠机械疼痛阈值测试
检测大鼠后足对Von Frey丝 (直径200 μm) 刺激的缩足反应,使用机械缩足阈值 (paw withdrawal mechanical threshold,PWMT) 衡量机械疼痛的程度。大鼠放置在1个10 cm×10 cm×15 cm的透明玻璃盒中,底部放置金属网 (0.5 cm×0.5 cm) 。使用Von Frey丝垂直扎大鼠的足底,当大鼠后足突然扬足、缩足或舔足反应为阳性,每次刺激间隔10 min,每只大鼠重复测量5次,取平均值。
1.5 大鼠热痛阈值测试
通过检测大鼠后足底对热刺激产生的缩腿动作时间( paw withdrawal thermal latency,PWTL) 来衡量热痛阈值。把待检测的大鼠单独放置于底部厚为0.22 mm的透明玻璃笼( 20 cm×20 cm×40 cm) 中,在安静环境下适应30 min后,使用热辐射疼痛刺激器( BME-410C,天津伯尔尼科技有限公司) 在玻璃板下固定距离聚焦大鼠后足底,当大鼠产生缩足或舔足停止照射,记录照射起止的间隔时间。每只大鼠重复测量5次,间隔时间>5 min,取平均值作为PWTL。为避免给大鼠足底皮肤造成损伤,设置最高阈值为20 s。
1.6 Western blotting检测大鼠DRG神经元中p-P38的表达
所有蛋白取自实验大鼠L3和L4的DRG。每个样品总蛋白25 μg,使用10%的SDS-PAGE进行电泳,在4 ℃转膜1 h到PVDF上,使用TBST( 20 mmol/L Tris-Cl,pH7.5,0.15 mol/L NaCl,0.05% Tween-20) 冲洗,共洗3次,每次10 min;接着用含10%脱脂牛奶的TBST室温封闭1 h,然后用一抗p-P38抗体( 1∶500) 4 ℃孵育过夜,第2天用TBST洗3次,每次10 min,之后应用二抗( 1∶1 000) 室温孵育1 h,使用发光试剂盒(英国ECL kit公司) 检测发光信号。所有实验使用等量蛋白进行P38( 1∶1 000) 和β-actin抗体( 1∶2 000)检测。p-P38和P38的蛋白条带灰度值用Image J软件(美国NIH公司) 分析。
1.7 统计学分析
使用统计软件SPSS 12.0进行数据处理。实验数据用±s表示,组内比较采用配对t检验,组间比较采用单因素方差分析。P< 0.05为差异有统计学意义。
2 结果
2.1 各组大鼠机械疼痛行为学结果比较
大鼠机械疼痛行为学结果显示,大鼠在进行CCD手术前对机械刺激的缩腿反应的基础阈值是20.5 g。与sham组比较,CCD组大鼠的机械缩腿阈值明显降低 (P< 0.01) ,并表现为时间依赖性,手术后1、3、5、7 d后持续降低,但手术后14 d大鼠的机械缩腿阈值增加,恢复近正常。与CCD组比较,治疗组大鼠除第1天外,其他时间点的机械缩腿阈值明显升高 (P< 0.05) 。3组大鼠在手术后14 d,机械缩腿阈值都恢复至正常,没有统计学差异 (P> 0.05) 。见表1。
2.2 各组大鼠热疼痛行为学结果比较

表1 3组大鼠对机械刺激、热刺激所产生缩足反应比较Tab.1 Comparison of the withdrawal response to mechanical stimuli and heat stimuli in the three groups
热刺激反应结果显示,大鼠在进行CCD手术前对热刺激缩腿反射基础阈值是13 s。与sham组比较,CCD组、治疗组大鼠对热刺激的缩腿反射时间明显缩短 (均P< 0.01) 。鞘内注射SB203580不能改变CCD引起的热痛觉过敏,见表1。
2.3 各组大鼠DRG中p-P38的表达
Western blotting结果显示,sham组大鼠DRG仅有少量p-P38蛋白表达。与sham组比较,CCD组大鼠手术14 d后DRG中p-P38蛋白表达明显增加 (P<0.01) 。与CCD组比较,治疗组大鼠手术14 d后DRG中p-P38蛋白表达明显减少 (P< 0.01) 。各组大鼠P38蛋白表达没有变化。见图1。
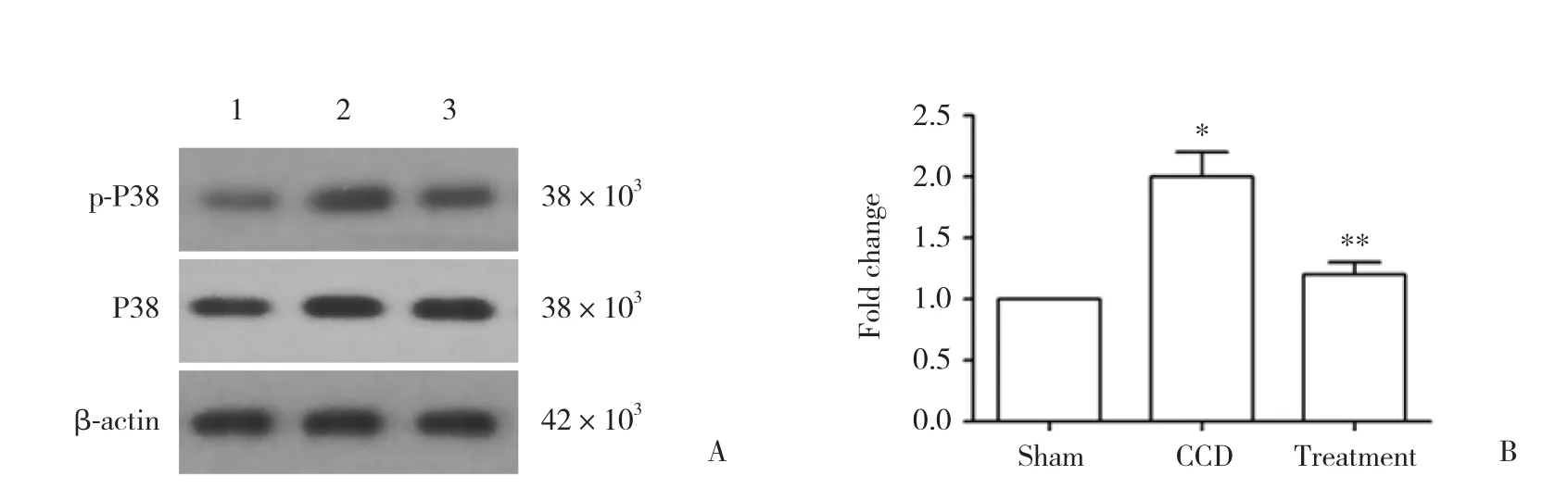
图1 各组大鼠DRG中p-P38和P38蛋白表达比较Fig.1 p-P38 and P38 protein expression levels in the DRG of rats
3 讨论
p-P38抑制剂是吡啶咪唑衍生物,主要有第一代SB202190、SB203580、SB220025,第二代SB239063等。其中,SB203580是可以通过细胞的分子,与ATP竞争性结合P38上的位点而发挥抑制作用。SB203580抑制P38磷酸化,减少脊髓中TNF-α合成,从而缓解神经病理性疼痛[2]。
本实验结果发现,CCD能引起大鼠对机械与温度刺激的痛觉异常。提前鞘内注射SB203580能够抑制机械刺激引起的痛觉异常,对热刺激引起的痛觉异常没有作用。PIAO等[6]研究发现,CCD引起三叉神经节损伤,激活胶质细胞与小胶质细胞中的p-P38,引起痛觉过敏。因此,SB203580可能在DRG的神经元细胞中具有相似功能,通过抑制P38的磷酸化来保护DRG中的神经元细胞,防止神经病理性疼痛的发生。
胡建雷等[7]报道,脊髓背角中P38磷酸化,能够引起CCD大鼠的神经病理性疼痛。韩光等[8]报道,高压氧可能通过活化脊髓中的P2X4受体,激活p38 MAPK信号通路,进而缓解CCI大鼠的机械痛与热痛。近年有学者[9-10]报道,MAPK信号通路中的P38在炎症细胞、应激、凋亡和神经病理性疼痛中发挥着重要作用。本研究结果显示,SB203580注射可以引起大鼠DRG中p-P38蛋白表达增加。P38只是MAPK信号通路中的作用蛋白,还需要对该信号通路的上下游进行深入研究,探讨其他蛋白的表达变化情况。SB203580有可能通过增加p-P38蛋白表达,从而调控下游信号通路,引起ERK-κ Bp65磷酸化,发挥缓解神经病理性疼痛的作用。
综上所述,SB203580能够减轻CCD所引起的机械痛,但对CCD所引起的热痛没有作用。p-P38蛋白可能是神经病理性疼痛的作用靶点,今后有可能指导临床用于缓解慢性疼痛。
参考文献:
[1] JOHNSON GL,LAPADAT R. Mitogen-activated protein kinase pathways mediated by ERK,JNK,and p38 protein kinases [J]. Science,2002,298 (5600) :1911-1912. DOI:10.1126/science.1072682.
[2] 许力,虞雪融,黄宇光.P38 MAPK抑制剂对神经病理性疼痛大鼠脊髓TNF-α合成的影响[J].基础医学与临床,2012,32 (10) :1126-1131.
[3] BORDERS AS,DE ALMEIDA L,VAN ELDIK LJ,et al. The p38 alpha mitogen activated protein kinase as a central nervous system drug discovery target [J]. BMC Neurosci,2008,9 (S2) :S12. DOI:10.1186/147-2202-9-s2-s12.
[4] KONDO T,SAKURAI J,MIWA H,et al. Activation of p38 MAPK through transient receptor potential A1 in a rat model of gastric distension induced visceral pain [J]. Neuroreport,2013,24 (2) :68-72.DOI:10.1097/WNR.0b013e32835c7df2.
[5] HU SJ,XING JL. An experimental model for chronic compression of dorsal root ganglion produced by intervertebral foramen stenosis in the rat [J]. Pain,1998,77 (1) :15-23.
[6] PIAO ZG,CHO IH,PARK CK,et al. Activation of glia and microglial p38 MAPK in medullary dorsal horn contributes to tactile hypersensitivity following trigeminal sensory nerve injury [J]. Pain,2006,12(3) :219-231. DOI:10.1016/j.pain.2005.12.023.
[7] 胡建雷,申文,曾因明.脊髓p38MAPK在大鼠背根节慢性压迫神经病理性疼痛中的作用[J].中国药理学通报,2008,24 (4) :530-533.
[8] 韩光,李璐,赵平.高压氧对神经病理性疼痛大鼠p38MAPK信号通路的影响[J].中国医科大学学报,2016,45 (8) :723-727.
[9] 张涛,杨承祥,王汉兵.p38MAPK信号通路与疼痛的关系 [J].中国疼痛医学杂志,2012,18 (3) :177-180.
[10] 王依慰,李伟彦.P38促分裂原活化蛋白激酶在神经病理性疼痛中的作用 [J]. 中国临床神经科学,2015,23 (4) :454-458.
