响应面法优化肠膜明串珠菌生物合成右旋糖酐工艺条件
2018-04-12袁宇蓝艳禹黄臣李媚廖安平
袁宇,蓝艳禹,黄臣,李媚,廖安平
(广西民族大学化学化工学院,广西多糖材料与改性重点实验室培育基地,广西高校化学与生物转化过程新技术重点实验室,广西南宁530006)
右旋糖酐是一种具有很高的生物相容性和生物水解性的、由简单的葡萄糖单元聚合而成的中性细菌胞外多糖[1],右旋糖酐的基本化学式是 H(C6H10O5)nOH,它是蔗糖在细菌胞外酶右旋糖酐蔗糖酶的作用下生成的一种α-葡聚糖[2]。右旋糖酐产品是一类亲水性很强的高分子化合物,合成的方法主要有微生物法和酶法[3],微生物法合成右旋糖酐的菌主要是嗜中温或嗜热细菌如明串珠菌、葡糖杆菌、链球菌、乳酸菌等[4-9]。右旋糖酐是第一个商业化的细菌胞外多糖[10],由肠膜明串珠菌合成的水溶性右旋糖酐广泛应用于制药、食品、农业和精细化工等领域[11],在低分子量药物的转化反应中,右旋糖酐的应用可提高药物的水溶性[12]。2015年4月,在WHO基本药物清单中,右旋糖酐T70被列为血浆代用品的基本药物[1]。右旋糖酐的合成受到一系列物理和化学因素的影响,如溶解度、黏度、比旋度以及培养液中的氮、磷离子等[13]。为使右旋糖酐的产量最大化,研究人员已经对生物合成条件进行了优化[14]。据报道,右旋糖酐的分子量大小和产量取决于各种反应过程变量如温度、蔗糖和受体的浓度等[15]。本试验采用肠膜明串珠菌(CICC-21725),在单因素试验基础上,采用响应面法对合成培养的工艺条件进行优化以提高蔗糖的转化率,为该菌的应用提供可靠数据。
1 材料与方法
1.1 材料与试剂
肠膜明串珠菌CICC-21725:中国工业微生物菌种保藏管理中心。
无水乙醇、蔗糖、磷酸二氢钾、磷酸氢二钠(均为分析纯):国药集团化学试剂有限公司;蛋白胨、琼脂粉(均为生物试剂):广东环凯微生物科技有限公司;乙腈(色谱纯):德国默克公司;水:自制二重蒸馏水。
1.2 仪器与设备
LDZX-30FBS立式压力蒸汽灭菌器:上海申安医疗器械厂;LT-XT摇床:瑞士Kuhner AG;ACB-4A1垂直流超净工作台:新加坡艺思高科技有限公司;SZ-97自动三重二次蒸馏水蒸馏器:上海亚荣生化仪器厂;LC20AD RID-10A高效液相色谱仪:日本岛津。
1.3 试验方法
1.3.1 培养基的配制
种子培养基组份(g/L):蔗糖130,蛋白胨2.0,磷酸氢二钠1.4,磷酸二氢钾0.3。
发酵培养基组份(g/L):蔗糖 80,蛋白胨 7.0,磷酸氢二钠1.4,磷酸二氢钾0.3。
1.3.2 液相色谱条件
色谱柱:Polaris 5 NH2柱,4.6 mm×250 mm,5 μm,安捷伦公司;流动相:乙腈/水=78∶22(体积比);流速:1.0 mL/min;柱温:35℃;检测器温度:40℃;进样量:20L。
1.3.3 蔗糖标准曲线的绘制
将蔗糖干燥至恒重后称取0.5g(精确至万分之一),用75%乙腈(体积比)定容至50 mL,蔗糖标准储备液的浓度为10mg/mL,稀释配制一系列浓度的蔗糖溶液,用0.22 μm的有机系针式过滤头过滤,放置备用。
1.3.4 转化过程中蔗糖的质量计算
从种子培养基中取10%(质量比)的种子液于发酵培养基中,以接种时刻为0点取样,之后每3个小时取样,用流动相稀释定容后在液相色谱中对蔗糖浓度进行分析,蔗糖质量的计算按照式1计算:

式中:m为取样时转化液中蔗糖的质量,g;m1为转化液的质量,g;c为从标准工作曲线上得到的被测组分的浓度,mg/mL;V为样品溶液定容体积,mL;m0为所取得转化液的质量,g。
蔗糖转化率按照式2计算:

式中:m初为接种时转化液中蔗糖的质量,g;m终为反应12 h后转化液中蔗糖的质量,g;m′为取出样品中蔗糖的质量,g。
2 结果与分析
2.1 蔗糖标准曲线
按照1.3.3中的试验方法,以峰面积/10 000为横坐标,蔗糖浓度为纵坐标,用origin拟合出蔗糖的标准曲线如图1所示。
由图1(a)可知:当蔗糖浓度在0.04 g/L~2.0 g/L时,线性回归方程为Y=0.051 02X+0.002 62,其中R2=0.999 94;由图1(b)可知:当蔗糖浓度在 0.8 g/L~10.0 g/L时,线性回归方程为Y=0.049 08X+0.056 51,其中R2=0.999 94。


图1 蔗糖标准曲线Fig.1 Standard curve of sucrose
2.2 转化过程中蔗糖的质量变化
按照1.3.4中方法对肠膜明串珠菌转化液进行取样分析,采用式(1)计算不同时间转化液中的蔗糖质量,结果见图2。
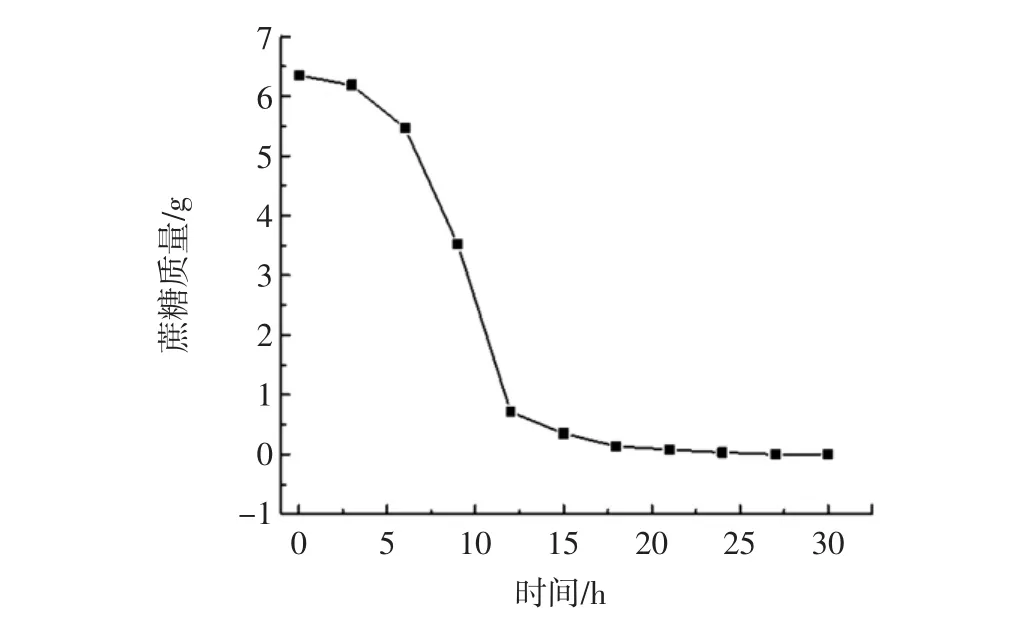
图2 不同时间转化液中的蔗糖质量Fig.2 The quality of sucrose at different time culture liquid
由图2可知,在接种前期蔗糖质量变化较为平缓,6 h~12 h之间蔗糖质量急剧下降且12 h时基本转化完全,12 h后变化平缓且最终为0。这是因为接种前期是肠膜明串珠菌生长的潜伏期,故变化不大,6 h后进入生长对数期,这时菌体快速生长蔗糖消耗极快,12 h后进入平稳期。因此,后续试验以12 h作为反应终点对蔗糖转化率进行分析。
2.3 单因素试验
2.3.1 蔗糖浓度对蔗糖转化率的影响
改变发酵培养液中蔗糖浓度为 50、60、80、90、100 g/L,蛋白胨、Na2HPO4、KH2PO4分别为 7、1.4、0.3g/L,以接种时为转化起点,在28℃、150 r/min摇床反应器中转化12 h后取样分析,考察蔗糖浓度对蔗糖转化率的影响,结果如图3所示。
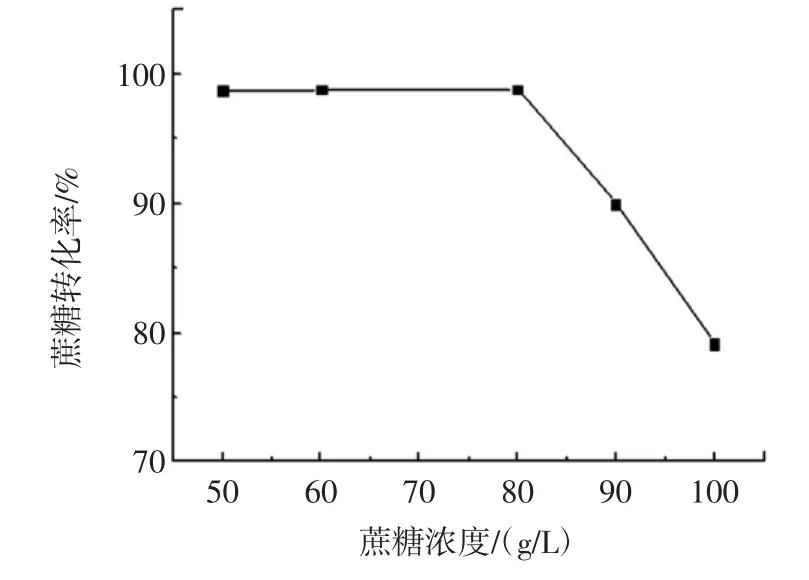
图3 蔗糖浓度对蔗糖转化率的影响Fig.3 The change of sucrose concentration on the influence of sucrose conversion
由图3可知,当蔗糖浓度不超过80 g/L时,在12 h内蔗糖基本能够转化完全,转化率较高;后随着蔗糖浓度的增大,蔗糖转化率降低,这是因为发酵液中过高的蔗糖浓度会影响菌体的生长,所以选择蔗糖浓度为80 g/L。
2.3.2 摇床转速对蔗糖转化率的影响
按照1.3.1中配制肠膜明串珠菌的发酵培养基,调节培养液pH值为7.1,反应温度28℃,摇床转速分别为 0、50、100、150、200 r/min,以接种时为转化起点培养12 h后取样,试验结果如图4。

图4 摇床转速对蔗糖转化率的影响Fig.4 The change of shaking speed on the influence of sucrose conversion
由图4可知,摇床转速对蔗糖转化率影响较小,低转速时蔗糖转化率较高,随着转速的升高,蔗糖转化率略有降低。摇床转速主要通过改变培养液中的溶氧量及传质过程来影响肠膜明串珠菌,氧气过多时会抑制其生长,增大摇床转速会增大发酵液中的溶氧量和物质之间的剪切力从而影响菌体生长,因此蔗糖转化率有所降低,综合考虑,转速选择100 r/min。
2.3.3 温度对蔗糖转化率的影响
按照1.3.1中配制肠膜明串珠菌的发酵培养基,调节培养液pH值为7.1,摇床转速150 r/min,培养温度分别为 20、25、30、35、40 ℃,以接种时为转化起点培养12 h后取样,试验结果如图5。

图5 温度对蔗糖转化率的影响Fig.5 The change of temperature on the influence of sucrose conversion
由图5可知,温度变化对蔗糖转化率影响较大,随着温度的升高蔗糖转化率先增大后减小,在30、35℃时蔗糖转化率较高。温度主要通过影响右旋糖酐蔗糖酶的活性来影响蔗糖转化率,温度过低会使得酶催化反应速率变慢,过高会使酶变性或失活,因此后续反应温度选择30℃。
2.3.4 初始pH值对蔗糖转化率的影响
按照1.3.1中配制肠膜明串珠菌的发酵培养基,调节培养液 pH 值分别为 6.1、6.5、7.1、7.6、8.0,摇床反应条件28℃,150 r/min,以接种时为转化起点培养12 h后取样,试验结果如图6。
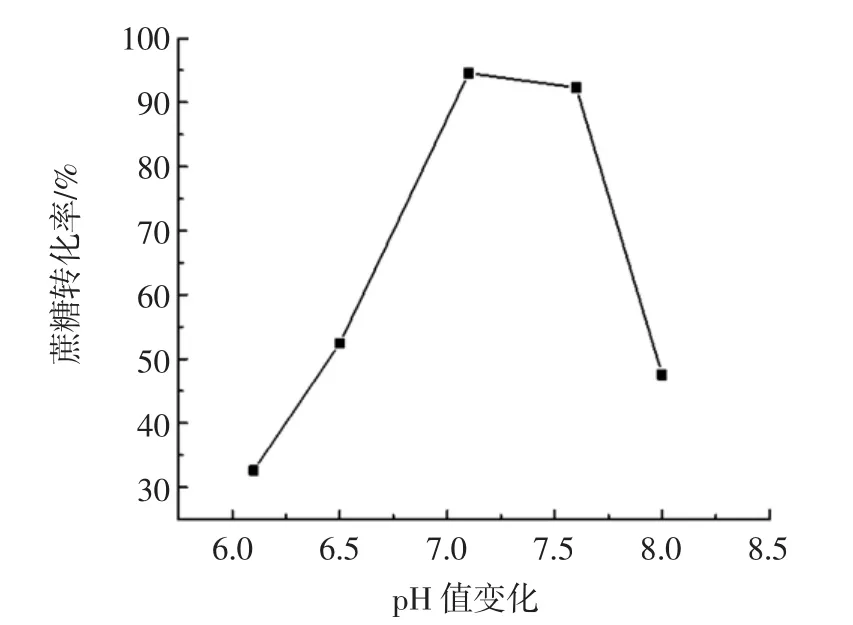
图6 初始pH值对蔗糖转化率的影响Fig.6 The change of initial pH on the influence of sucrose conversion
由图6可知,蔗糖转化率随初始pH值的升高先增大后降低且在pH值为7.1的时候有最大值。pH值的变会化引起菌体细胞膜电荷发生改变而影响菌体的生长,同时pH值变化会影响右旋糖酐蔗糖酶的活性。后续反应中初始pH值选择7.1。
2.4 响应面法优化肠膜明串珠菌发酵工艺条件
在上述单因素试验的基础上,采用响应面法考察蔗糖浓度、摇床转速、温度、初始pH值对蔗糖转化率的交互影响,以蔗糖转化率为响应值Y,设计四因素三水平响应面试验,试验设计见表1。
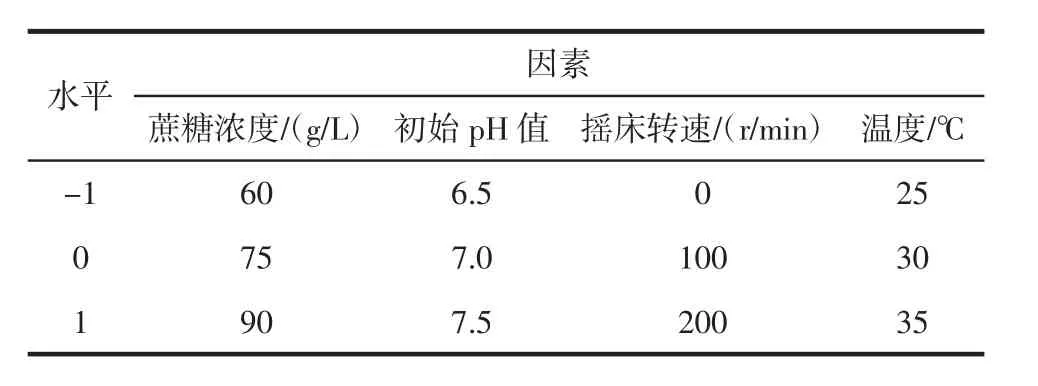
表1 响应面试验因素及水平表Table 1 Factors and levels of response surface method
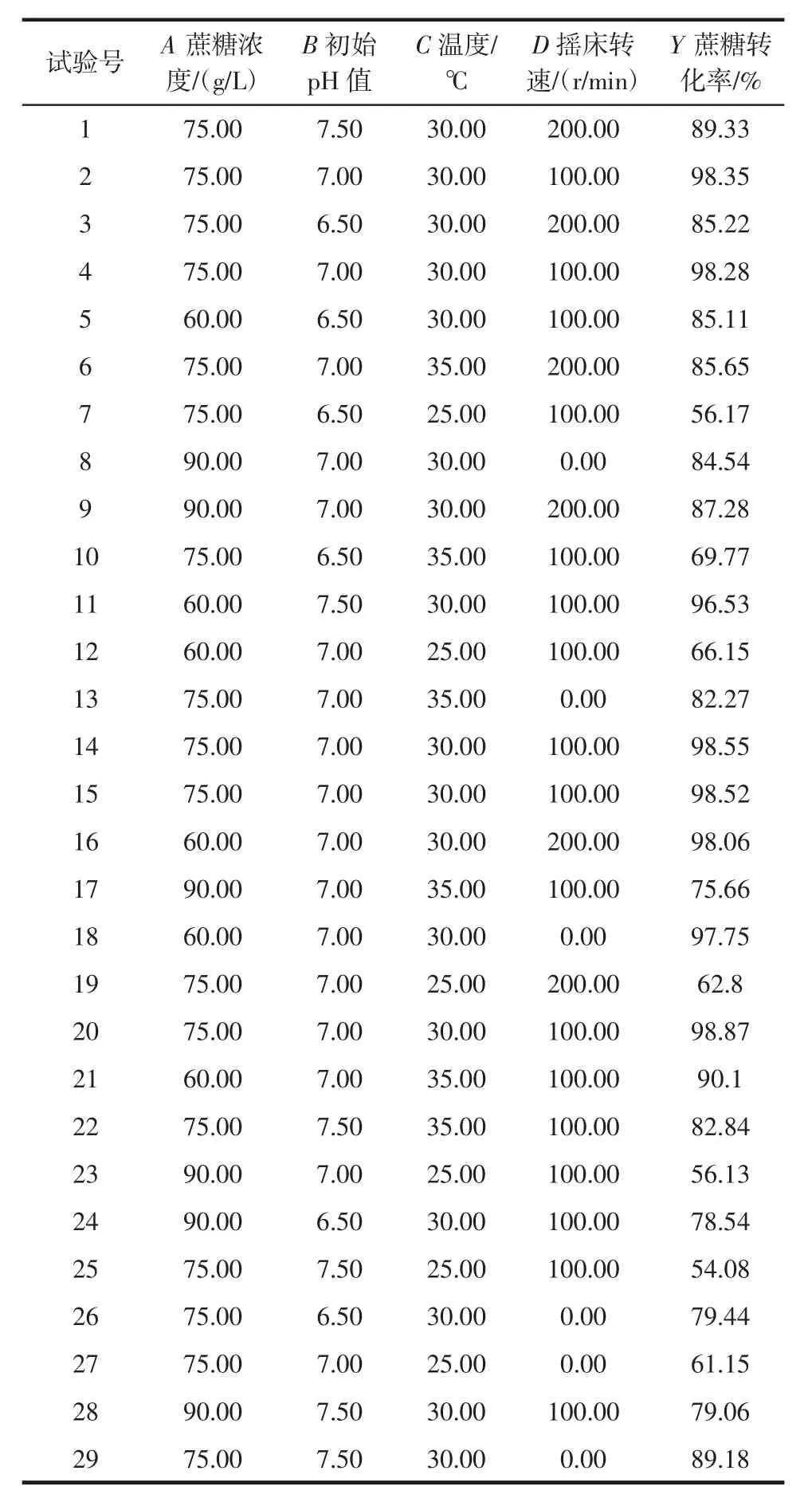
表2 响应面设计及试验结果Table 2 The design of experiment and result of response surface
通过Design Expert软件对表2中试验结果进行二次多元回归拟合,得到下列二次多元回归方程:

对上述二次多元回归模型进行方差分析,结果见表3。
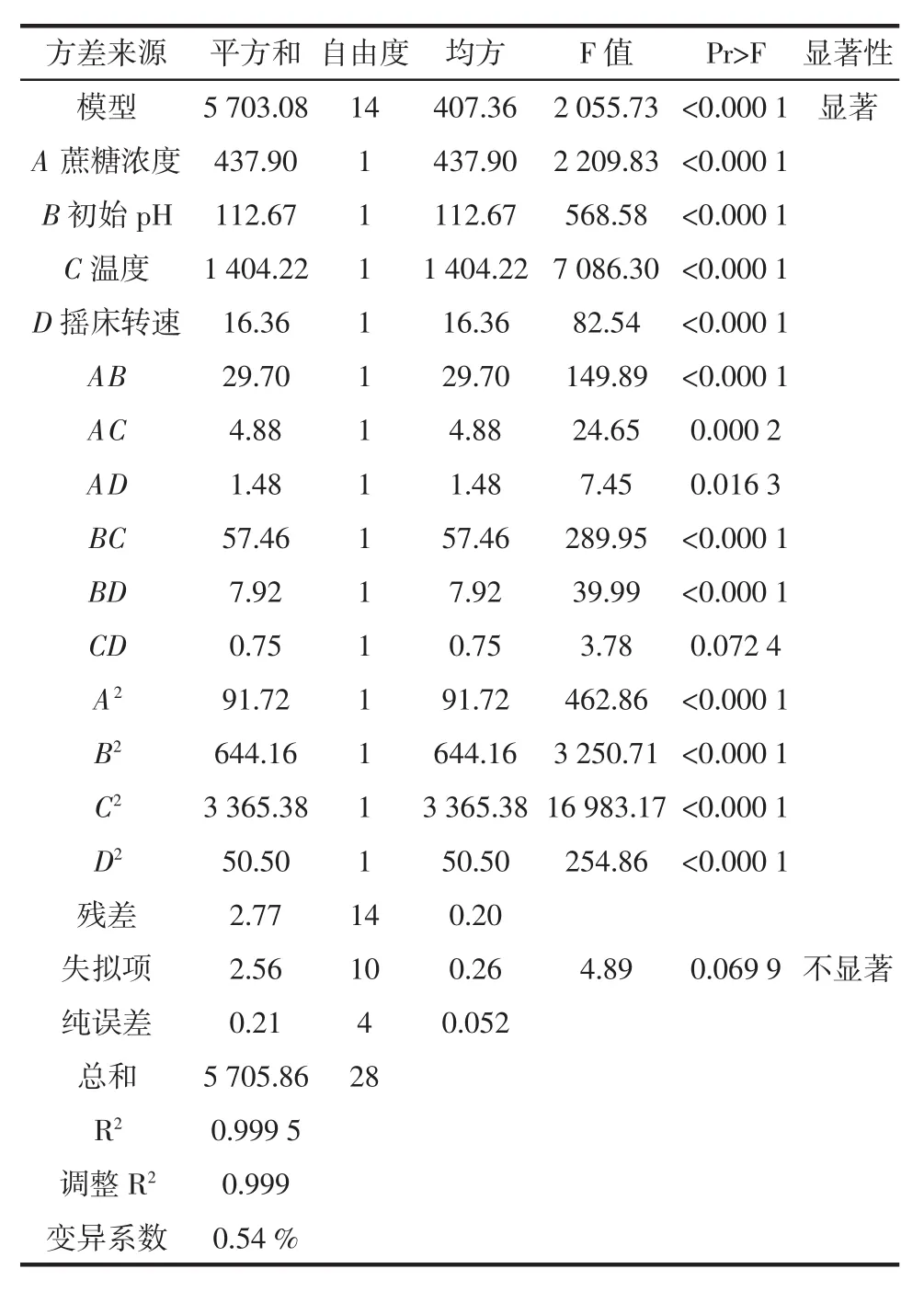
表3 回归模型方差分析表Table 3 Variance analysis for the regression model
由表3可知,回归拟合模型(Pr>F)值<0.000 1,拟合模型极显著;实验的失拟项(Pr>F)=0.069 9>0.05,差异不显著,表示此模型合理且不再引入更高次的项;模型拟合系数R2为0.999 5,调整R2为0.999,拟合模型能阐明99.9%的响应值的改变。变异系数为0.54%,较小,说明拟合模型置信度较高。因此拟合模型用于右旋糖酐合成的培养工艺条件分析和预测是可靠的。由表3中F值大小可知,各因素对右旋糖酐收率影响强度为C>A>B>D。因素A、B、C、D的交互作用与产率的响应面及其等高线见图7。
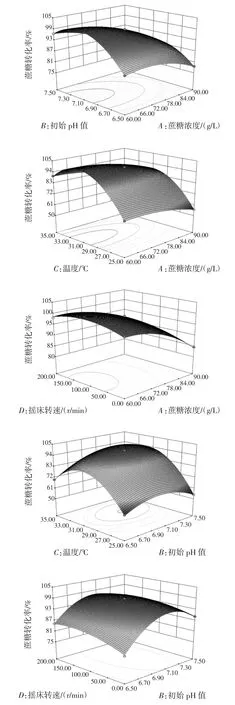
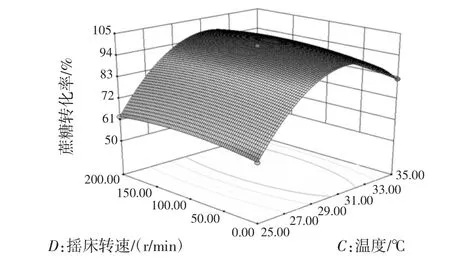
图7 各因素交互作用响应面曲线图Fig.7 Response surface of various factors interaction
图7为各因素之间两两交互作用的响应面曲线图,从图7及表3中可知,CD因素交互作用不显著,AB、AC、AD、BC、BD因素之间交互作用显著。从图7可以看出初始pH值和温度的交互作用对蔗糖转化率的影响最大,随着初始pH值和温度的增大蔗糖转化率也随之增高。本试验分析优化得到的最佳培养工艺条件为蔗糖浓度69.58g/L、初始pH 6.92、温度30.95℃、摇床转速153.21 r/min,考虑到实际操作的可行性,调整后的培养工艺条件为蔗糖浓度70 g/L、初始pH 7.0、温度30℃、摇床转速150 r/min。
2.5 验证试验
根据响应面试验结果,按照蔗糖、蛋白胨、磷酸氢二钠、磷酸二氢钾浓度分别为70、7.0、1.4、0.3 g/L配制肠膜明串珠菌发酵培养基,调整初始pH值为7.0,高温灭菌后接入10%(质量比)种子液,在摇床温度30℃,转速150 r/min条件下转化培养12 h,采用高效液相色谱法对培养液中的蔗糖进行定量。进行3次平行试验,结果表明蔗糖转化率为99.18%。
3 结论
通过肠膜明串珠菌(CICC-21725)培养工艺条件的单因素试验及Box-Behnken响应面设计试验和分析得到右旋糖酐的培养工艺条件为:蔗糖浓度70 g/L、初始pH 7.0、温度30℃、摇床转速150 r/min。配置肠膜明串珠菌培养基,在优化的培养工艺条件下反应12 h,对转化液中的蔗糖含量进行分析,得到蔗糖的转化率为99.18%,平行试验的相对误差较小,说明该条件可行且具有实际操作意义。
参考文献:
[1]BANERJEE A,BANDOPADHYAY R.Use of Dextran nanoparticle:a paradigm shift in bacterial exopolysaccharide based biomedical applications[J].International Journal of Biological Macromolecules,2016,87:295-301
[2]YAMAMOTO K,YOSHIKAWA K,OKADA S.Structure of Dextran Synthesized by Dextrin Dextranase from Acetobacter capsulatus ATCC 11894[J].Bioscience Biotechnology and Biochemistry,2008,57(9):1450-1453
[3]YANG Yanping,PENG Qian,GUO Yanyun,et al.Isolation and characterization of dextran produced by Leuconostoc citreum NM105 from manchurian sauerkraut[J].Carbohydrate Polymers,2015,133:365-372
[4]NAESSENS M,C An,W Soetaert,et al.Leuconostoc dextransucrase and dextran:Production,properties and applications[J].Journal of Chemical Technology and Biotechnology,2005,80(8):845-860
[5]SADAHIRO J,MORI H,SABURI W,et al.Extracellular and cellassociatedformsof Gluconobacteroxydans dextrandextrinasechange their localization depending on the cell growth[J].Biochemical and Biophysical Research Communications,2015,456(1):500-505
[6]LEE CG,PARK JK.Comparison of inhibitory activity of bioactive molecules on the dextransucrase from Streptococcus mutans[J].Applied Microbiology and Biotechnology,2015,99(18):7495-7503
[7]KRALJ S,VAN IG,FABER EJ,et al.Rational transformation of Lactobacillus reuteri 121 reuteransucrase into a dextransucrase[J].Biochemistry,2005,44(25):9206-9216
[8]BARUAH R,DEKA B,GOYAL A.Purification and characterization of dextransucrase from Weissella cibaria RBA12 and its application in in vitro synthesis of prebiotic oligosaccharides in mango and pineapple juices[J].LWT-Food Science and Technology,2017(84):449-456
[9]ESAWY MA,GAMAL AA,HELAL MM,et al.Enzymatic synthesis using immobilized Enterococcus faecalis Esawy dextransucrase and some applied studies[J].International Journal of Biological Macromolecules,2016,92:56-62
[10]SINGHA T K.Microbial extracellular polymeric substances:production,isolation and applications[J].IOSR Journal of Pharmacy,2012,2(2):276-281
[11]GRACIA R,MARRADI M,COSSIO U,et al.Synthesis and functionalization of dextran-based single-chain nanoparticles in aqueous media[J].Journal of Materials Chemistry B,2017,5(6):1143-1147
[12]WANG Y,GANZELmg,SCHWAB C.Exopolysaccharide synthesized by Lactobacillus reuteri decreases the ability of enterotoxigenic Escherichia coli to bind to porcine erythrocytes[J].Applied and Environmental Microbiology,2010,76(14):4863-4866
[13]LIU J,WANG X,PU H,et al.Recent advances in endophytic exopolysaccharides:Production,structural characterization,physiologicalroleandbiologicalactivity[J].Carbohydrate Polymers,2017,157:1113-1124
[14]DU Renping,XING Hanwen,YANG Yanping,et al.Optimization,purification and structural characterization of a dextran produced by L.mesenteroides isolated from Chinese sauerkraut[J].Carbohydrate Polymers,2017,174:409-416
[15]ZHANG Zhipeng,LIU Zhengqi,TAO Xueying,et al.Characterization and sulfated modification of an exopolysaccharide from Lactobacillus plantarum ZDY2013 and its biological activities[J].Carbohydrate Polymers,2016,153:25-33
