固相萃取-原子吸收法测定腌制品中的铅
2018-04-12
(天津出入境检验检疫局,天津300461)
腌制是将食盐大量渗入食品组织内达到保藏食品的目的,通过这种手段加工的食品称为腌制品。目前国家标准对腌制品中铅的检测并无特殊规定,一般采用普通食品检测所规定的石墨炉原子吸收法、电感耦合等离子体质谱法、二硫腙比色法、火焰原子吸收法等[1]。但是腌制品中通常含有较高浓度的氯化钠,当使用石墨炉原子吸收光谱法检测时,过高的氯化钠会在分析过程中产生明显的背景干扰[2-5],并且会缩短石墨管的使用寿命,提高检测成本;当使用电感耦合等离子体质谱法(Inductively coupled plasma mass spectrometry,ICP-MS)或电感耦合等离子原子发射光谱(Inductively Coupled Plasma Optical Emission Spectrom-etry,ICP-OES)检测时,盐分则容易在雾化器和椎孔处沉积对仪器带来损伤[6-8],同时也有可能带来多原子的干扰[9-10];当使用萃取-火焰原子吸收和二硫腙比色法时,操作复杂,重现性和选择性较差[11-12],并且需要使用挥发性较强的有机试剂,对操作人员的健康会产生一定的影响。此外,有研究通过添加基体改进剂[13-15]或基体匹配[16-17]的方法去除高盐分的干扰,但是基体改进剂法会在一定程度上增加样品空白,从而影响检出限;而基体匹配的方法并没有从根本上解决干扰的问题。
固相萃取方法是解决上述问题的有效途径之一[18-25]。固相萃取技术利用待测物在不同介质中被吸附能力的不同而将目标物与基体分离,实现待测物的提纯和浓缩,从而去除复杂基体在检测中带来的干扰,并可以大大提高痕量待测物的检出能力。本文基于上述原理,开发了一种固相萃取-原子吸收光谱法联用检测腌制品中铅的方法,使用螯合树脂作为固相萃取材料对腌制品消解液进行固相萃取,实现了铅离子与含高浓度氯化钠基体的有效分离,从根本上去除了基体的干扰。
1 材料与方法
1.1 主要仪器与试剂
AA900型原子吸收光谱仪:PE公司;MARS 5型微波消解仪:美国CEM公司;Milli-Q A10型超纯水制备仪:Millipore公司;ME 203型电子天平(万分之一):梅特勒公司。试验用超纯水、小型离子交换柱:自制;30%过氧化氢(Mos级):天津风船化学试剂科技有限公司;70%硝酸(电子级):默克公司;钠元素、铅元素标准储备溶液(1 000mg/L):国家钢铁材料测试中心钢铁研究总院生产国家标准试剂(GBW)。
1.2 仪器工作条件
1.2.1 微波消解仪工作程序
样品微波消解程序见表1。
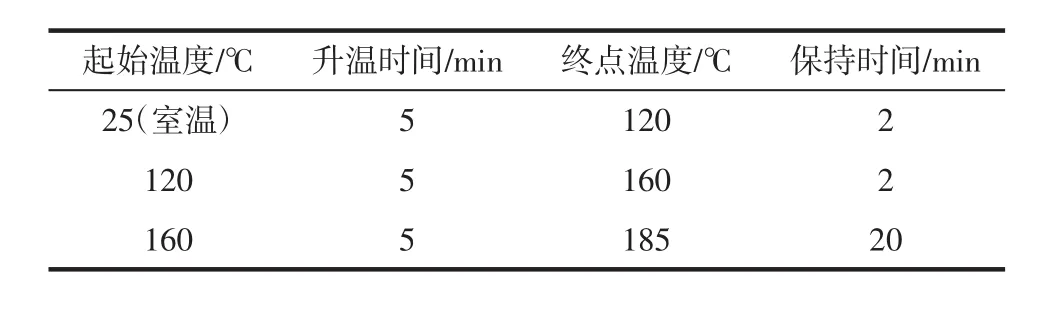
表1 样品微波消解程序Table 1 Microwave digestion process
1.2.2 原子吸收光谱仪测定铅的条件
灯电流10 mA,波长283.3 nm,狭缝0.7 nm,检测方式为石墨炉原子吸收。具体升温程序见表2。
1.2.3 原子吸收光谱仪测定钠的条件
灯电流8 mA,波长589.0 nm,狭缝0.2 nm,检测方式为火焰原子吸收,空气流量为10.0 L/min,乙炔气流量为2.5 L/min。
1.3 样品前处理方法
准确称取1.0 g腌制品,精确至0.001 g,置于微波消解管中,向微波消解管中依次加入2 mL过氧化氢、4 mL硝酸,室温放置30 min后,密闭微波消解管并放入微波消解仪,按照设定的消解程序进行消解。消解完毕后将消解管降至常温,将消解液进行赶酸处理,用去醋酸铵缓冲溶液将盐分溶解,并转移至50 mL塑料容量瓶中,用醋酸铵缓冲溶液涮洗消解管2次~3次,清洗液同样转移至容量瓶中,然后用醋酸铵缓冲溶液定容至刻度,摇匀后得测试液;同时做试剂空白。
1.4 固相萃取柱的制备
固相萃取柱选用5 mL针筒型聚丙烯管,先在柱底部垫一片多孔聚乙烯筛板,再将适量的树脂装入聚丙烯管内,最后在树脂上方用一片多孔聚乙烯筛板压实。树脂层高可根据实际需要自行选择,通常0.5 g即可。
1.5 固相萃取过程
首先用10 mL质量浓度为5%的稀硝酸清洗萃取柱,再用10 mL pH值为6、浓度为20 mmol的醋酸盐缓冲溶液活化萃取柱,最后用10 mL去离子水清洗萃取柱。取20 mL待测样液过已活化的固相萃取柱,流速控制在1 mL/min,弃去流出液,用10 mL去离子水冲洗固相萃取柱,再用10 mL 5%硝酸解吸重金属离子,收集流出液并定容至10 mL,固相萃取柱可经再次活化重复使用。
2 结果与分析
2.1 固相萃取材料的选择
为了找到最合适的吸附材料,考察了下列几种树脂,阳离子交换树脂(Bio Rad 50-X8);螯合树脂(亚氨基二乙酸型和硫脲型);萃淋树脂(TBP萃淋树脂、7402萃淋树脂、Amberlite类型的 XAD-3、XAD-4XAD-1180)等。阳离子交换树脂具有广谱性,无法去除碱金属和碱土金属的干扰;亚氨基二乙酸基团修饰的螯合树脂可以有效去除碱金属的干扰,并且能够去除90%以上的碱土金属的干扰;硫脲型离子交换树脂可以有效去除碱金属的干扰,但是无法去除碱土金属的干扰;萃淋树脂使用寿命较短,可重复性利用度不高。对比来看,亚氨基二乙酸型螯合树脂最适合试验要求,因而选定其为固相萃取材料。
2.2 螯合树脂的负载能力和适用pH值范围
利用螯合树脂进行溶液中铅离子的吸附时,为确保将铅离子全部吸附,防止出现吸附饱和,就需要测定其对铅离子的吸附容量,这对准确测定食品中重金属的含量有重要意义。称取1.0 g树脂于7个100 mL的具塞三角烧杯中,再加入不同pH值的溶液,然后分别加入1 000 μg待测离子,将三角烧瓶置于摇床动态吸附24 h后,测量溶液中剩余待测离子的浓度,计算溶液中残留待测离子量,并通过差值反推树脂吸附待测离子的总量,树脂吸附容量见图1。
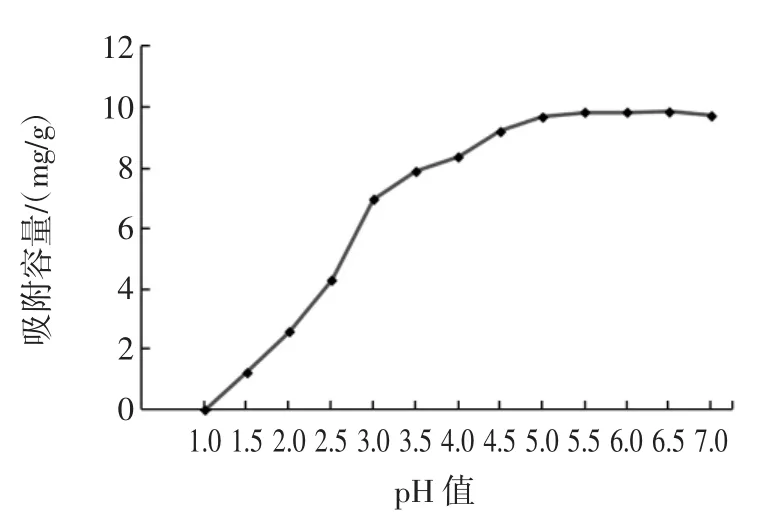
图1 溶液pH值与吸附能力关系Fig.1 Effect of pH on the adsorption capacity
由图1可以看出,亚氨基二乙酸基团修饰的螯合树脂对铅的吸附效果非常好,吸附容量在9.2mg/g~9.9mg/g,完全满足日常检测的要求。
螯合树脂吸附铅离子是螯合反应,所以pH值对金属离子在树脂上的吸附能力有很大影响[18]。考察了消化液体系pH值对螯合树脂吸附铅离子的影响。由图1可以看出,当溶液pH值在2以下时,溶液中的氢离子与金属离子竞争螯合位点,树脂吸附能力较小;随着pH值增大,树脂对铅离子的吸附能力逐渐增强,在pH 5.5~6.5时时吸附容量最大。因此进行固相萃取试验时,溶液pH值选择5.5~6.5效果最佳。
2.3 螯合树脂去除基底能力研究
在固相萃取试验过程中,对每毫升流出液中铅和钠的浓度进行实时监测,并绘制洗脱曲线考察钠离子和铅离子的分离效果,如图2所示。

图2 钠离子和铅离子淋洗曲线Fig.2 Elution curve for Na+and Pb2+
由图2可以看出,1 mL~10 mL为上样过程,螯合树脂并不吸附钠离子,很快流出液中即可检测出高浓度的钠离子,但是铅离子被萃取柱完全吸附,流出液中铅离子浓度为零;11 mL~20 mL为去离子水清洗固相萃取柱的过程,在清洗过程的前7 mL,柱中残留的钠离子被洗出,铅离子浓度仍旧为零,未被洗出;在去离子水清洗过程的后3 mL,钠离子和铅离子浓度均为零,说明固相萃取柱中残留的钠离子已被完全洗出,铅离子仍旧吸附于萃取柱中;21 mL~30 mL为5%硝酸解吸附过程,此过程中铅离子从螯合树脂上脱离,洗出液中铅离子浓度在很快达到高峰后逐渐降低,直至未检出,说明铅离子完全被洗出。由此可以看出,铅离子和钠离子在不同时间段分别从固相萃取柱中流出,实现了有效分离。
2.4 抗干扰能力测试
食品中重金属元素检测的挑战性在于待测元素通常含量较低,而基体中的常量元素 Na、K、Ca、Mg、Cl等的含量高,极易对测定过程带来干扰[26-28]。此外,含有螯合基团的树脂一般可以与多种金属元素相结合,食品样品中通常含有一定量的Fe、Mn、Cu、Zn等微量元素,有可能存在与待测离子的竞争螯合位点的情况,并影响待测离子的检测效果。因此,为研究固相萃取柱的抗干扰能力,向待测样品溶液中添加一定浓度的共存离子,然后按照前述萃取测定步骤进行检测。结果显示,常见金属离子不会对铅的测定产生干扰,待测元素的加标回收率在97.1%~102.3%之间,满足日常检测的要求,结果见表3。
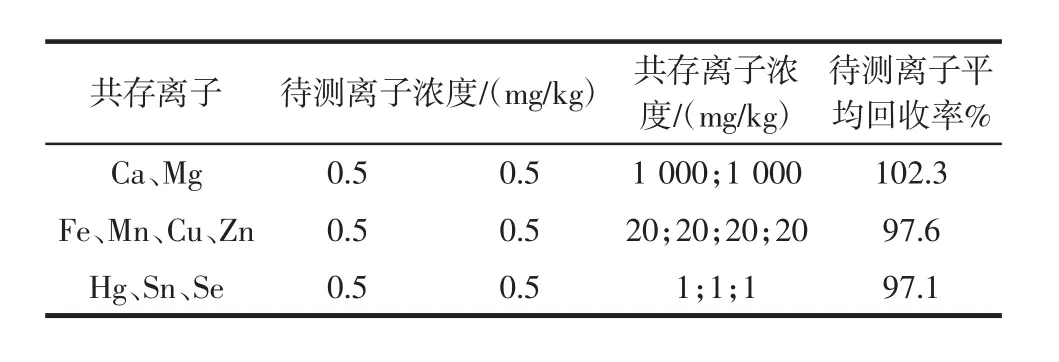
表3 共存离子的影响Table 3 The effect of coexisting ions
2.5 线性方程及重复性
试验中以 0、5、10、20、30、40、50 μg/L 为浓度梯度做线性曲线,线性方程为Y=0.003 2X+0.002 9,线性相关系数为0.999 3。以榨菜作为试验样品验证方法的重复性,平行试验6次,RSD为2.6%,满足检测要求。方法的重复性见表4。
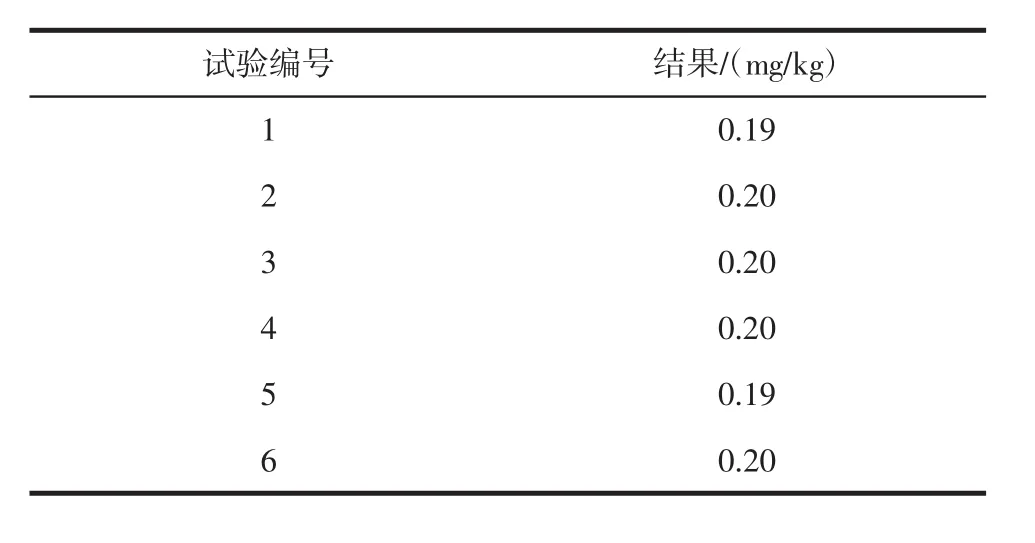
表4 方法的重复性Table 4 Repeatability of this method
2.6 检出限和定量限
根据国际纯粹和应用化学联合会(IUPAC)对检出限和定量限作出的规定,试验中选取空白咸鸭蛋样品中加标,当测定吸光度值为噪音响应值3倍时,所对应的加标浓度为本方法的检出限;当测定吸光度值为噪音响应值十倍时,所对应的加标浓度为本方法的定量检出限。当取样量为1.0 g,定容体积为50 mL,上柱体积为20 mL,洗脱后定容体积为10 mL时,本方法的检出限为0.01mg/kg,定量检出限为0.03mg/kg,满足日常检测的要求。
2.7 方法应用
应用本方法,对随机抽样的5种腌制样品中铅的含量进行了检测,腌制品种类覆盖了市场常见的腌制品种类(包括腌制肉制品、腌制蔬菜制品、腌制蛋类制品)。按照本试验方法,测定各腌制品中铅的含量,同时进行高、低两梯度加标回收试验,结果列于表5。
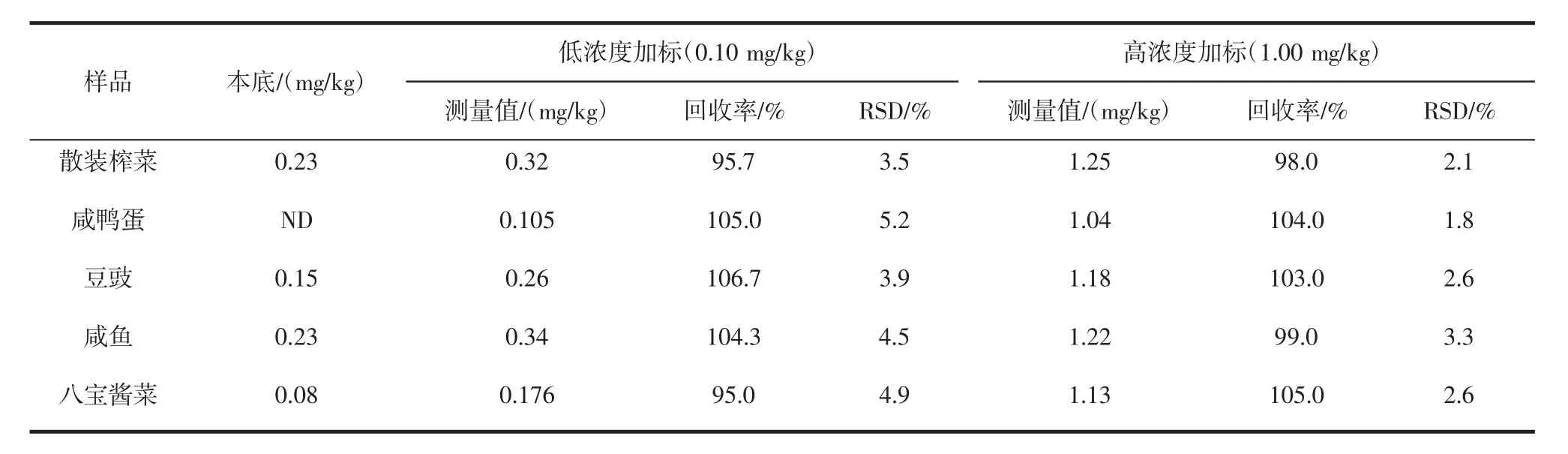
表5 不同种类腌制品加标回收率和精密度试验Table 5 Recovery and precision test(n=6)with different kinds of pickled products
从表中结果可以看出,高低两种梯度加标回收率在95%~106.7%之间,RSD在1.8%~5.2%之间,表明本方法完全符合食品日常检测要求。
3 结论
腌制品中的高盐成分会严重影响铅的测定,本研究将固相萃取技术与原子吸收光谱法联用,成功解决了腌制品中痕量铅的检测问题。固相萃取技术实现了待测元素和氯化钠的有效分离,避免了采用原子吸收光谱法检测时的基体干扰问题,大大提高了腌制品中铅元素检测的准确性和重复性。采用本方法开展了5种腌制品中铅的测定和加标试验,结果显示本方法简单、有效,完全可以满足相关标准要求。本方法所需耗材廉价、仪器简单、可操作性强,满足样品高通量前处理的要求,适用于日常食品检测。
参考文献:
[1]中国国家标准化管理委员会.GB 5009.12-2017食品安全国家标准食品中铅的测定[S].北京:中国标准出版社,2017
[2]Acar O,Kalfa O M,Yalcinkaya O,et al.Assessment of arsenic,chromium,copper and manganese determination in thermal spring waters by electrothermal atomic absorption spectrometry using various chemical modifiers[J].Analytical Methods,2013,5(3):748-754
[3]胡小玲,张瑰,刘志峰.石墨炉原子吸收法直接测定食盐中铅的方法研究[J].中国卫生检验杂志,2004,14(4):428-429
[4]Butler O T,Cairns W R L,Cook J M,et al.2014 atomic spectrometry update-a review of advances in environmental analysis[J].Journal of Analytical Atomic Spectrometry,2015,31(1):35-89
[5]彭彩红,张平,陈永亨,等.火焰原子吸收光谱法测定工业废水中铊、铅、镉时高盐分的干扰[J].理化检验-化学分册,2016,52(8):952-954
[6]张为,赵嘉微,王琳.ICP-AES分析高盐样品时雾化器堵塞问题的研究[J].光谱实验室,2004,21(5):977-978
[7]杨朝勇,陈发荣,庄峙厦,等.微柱固相萃取-电感耦合等离子体质谱联用技术用于测定高盐样品中痕量的铅[J].厦门大学学报(自然科学版),2001,40(5):1062-1066
[8]Veguería S F J,Godoy J M,Campos R C D,et al.Trace element determination in seawater by ICP-MS using online,offline and bath procedures of preconcentration and matrix elimination[J].Microchemical Journal,2013,106(1):121-128
[9]Wang L,Li H,Dong Y,et al.Determination of trace elements in salt lake brines using inductively coupled plasma optical emission spectrometry after magnesium hydroxide precipitation[J].Analytical Methods,2015,7(19):8235-8240
[10]Li Y,Guo W,Wu Z,et al.Determination of ultra-trace rare earth elements in high-salt groundwater using aerosol dilution inductively coupled plasma-mass spectrometry(ICP-MS)after iron hydroxide co-precipitation[J].Microchemical Journal,2016,126:194-199
[11]董朝和.浅谈双硫腙检测样品中金属含量体会[J].安徽预防医学杂志,1999,5(1):100
[12]张源,罗文鸿,李慧.浊点萃取-石墨炉原子吸收法测定高盐样品中的痕量铅[J].光谱学与光谱分析,2006,26(7):1349-1351
[13]乌尼尔,其其格,高娃,等.食盐中痕量铅含量测定的研究[J].食品安全质量检测学报,2013(3):895-898
[14]时二静,马迎辉,司静静,等.基体改进剂用于GFAAS测定高盐食品中铅的研究[J].河南科技,2016(13):128-131
[15]胡曙光,苏祖俭,蔡文华,等.石墨炉原子吸收法测定高盐食品中的铅及其干扰消除的研究[J].中国食品卫生杂志,2015,27(4):394-398
[16]彭荣飞,侯建荣,黄聪.ICP-MS直接测定酱油中Pb和As的研究[J].中国卫生检验杂志,2008,18(7):1315-1316
[17]聂西度,符靓.ICP-MS法测定食品级壳聚糖中的微量杂质元素[J].光谱学与光谱分析,2016,36(8):2621-2624
[18]Zhu S,Chen B,He M,et al.Speciation of mercury in water and fish samples by HPLC-ICP-MS after magnetic solid phase extraction.[J].Talanta,2017,171:213-219
[19]SerkanS,ahan,U gˇurS,ahin.An automated solid phase extraction coupled with electrothermal atomic absorption spectrometric determination of Pb(II)in high salt content samples[J].Talanta,2011,86(30):128-132
[20]Fujimoto K,Shimura M.Determination of trace amounts of elements in high-purity iron by ICP MS after ion chromatographic separation using a cumulated bed of cation-and anion-exchange resins[J].Bunseki Kagaku,2001,50(3):175-182
[21]He M,Huang L,Zhao B,et al.Advanced functional materials in solid phase extraction for ICP-MS determination of trace elements and their species-A review[J].Analytica Chimica Acta,2017(973):1-24
[22]Hsu K C,Hsu P F,Hung C C,et al.Microfluidic desorption-free magnetic solid phase extraction of Hg(2+)from biological samples using cysteine-coated gold-magnetite core-shell nanoparticles prior to its quantitation by ICP-MS[J].Talanta,2017,162:523-529
[23]Habila M A,Alothman Z A,El-Toni A M,et al.Carbon-coated Fe 3 O 4,nanoparticles with surface amido groups for magnetic solid phase extraction of Cr(III),Co(II),Cd(II),Zn(II)and Pb(II)prior to their quantitation by ICP-MS[J].Microchimica Acta,2017(12):1-7
[24]Minami T,Konagaya W,Zheng L,et al.An off-line automated preconcentration system with ethylenediaminetriacetate chelating resin for the determination of trace metals in seawater by high-resolution inductively coupled plasma mass spectrometry[J].Analytica Chimica Acta,2015,854:183-190
[25]Alothman Z A,Habila M,Yilmaz E,et al.Solid phase extraction of Cd(II),Pb(II),Zn(II)and Ni(II)from food samples using multiwalled carbon nanotubes impregnated with 4-(2-thiazolylazo)resorcinol[J].Microchimica Acta,2012,177(3/4):397-403
[26]Mendil D,Kiris T,Tuzen M,et al.Separation-preconcentration of Cu,Cd,Pb and Ni in various water and food samples on Sepabeads SP-207[J].International Journal of Food Science&Technology,2013,48(6):1201-1207
[27]肖玉芳,陆丽君,李明.SPE-ICP-MS联用测定地下水中的Pb、Cu、Cd和Cr[J].环境科学与技术,2016(s2):364-367
[28]Soltani M D,Behzadi M,Taher M A.Preparation and Application of Nanostructure Ion-Imprinted Polymer for Selective Solid-Phase Extraction of Pb Ions in Water,Hair,and Food Samples[J].Journal of Aoac International,2016,99(5):1363-1369
